颈内静脉入路与锁骨下静脉入路行输液港置入术的对比分析
2023-08-08尹随吴昊陈立如彭雷胡耶基林庆徐全
尹随 吴昊 陈立如 彭雷 胡耶基 林庆 徐全
中心静脉穿刺(或切开)置入静脉输液港可降低化疗时的静脉炎发生率[1],与经外周静脉置入中心静脉导管 (PICC)比较,并发症少,冲管间隔周期长,对日常活动影响小[2-4]。输液港的常用入路包括颈内静脉穿刺、锁骨下静脉穿刺、贵要静脉穿刺以及切开置管(较为少见)等。置入通路的选择受限于基座安置区域和血管条件,也和医生操作习惯有关。有研究表明,长期使用颈内静脉置入输液港有效性和安全性优于锁骨下静脉。但颈内静脉入路导管较长,穿刺点处易形成锐角导致输液不畅。为比较不同入路的优劣,我们对104例输液港置入病例的临床资料进行分析。
对象与方法
一、对象
2019年1月~2021年12月期间行输液港置入术行化疗的病人共104例,按照入路分为颈内静脉入路组(A组)和锁骨下静脉入路组(B组)。A组55例,男性29例,女性26例,平均年龄56.58岁,平均身高163.31 cm,体质指数(BMI)(23.22±2.15)kg/m2,其中肺癌49例,食管癌2例,胸腺瘤4例。B组49例,男性28例,女性21例,平均年龄55.71岁,平均身高164.71 cm,BMI(23.14±2.75)kg/m2,其中肺癌45例,食管癌2例,胸腺瘤2例。纳入标准:(1)经组织病理学确诊为恶性肿瘤(主要包括肺癌、食管癌等);(2)年龄>18岁,男女不限;(3)化疗不少于4周期;(4)所有治疗方案均获得病人知情同意并签字。排除标准:化疗期间因输液港并发症之外的其他并发症死亡;出现严重化疗并发症或其他全身系统性疾病。
二、方法
1.术前准备:(1)评估病人术区情况(双侧颈部、上胸部皮肤以及脂肪厚度等),确定入路选择次序;(2)于胸部CT测量好置管深度(胸锁关节上缘到上腔静脉右心房入口处距离);(3)向病人讲解手术操作过程及注意事项等。
2.置入方法:(1)右侧颈内静脉中入路:平卧位,头略后仰面向左侧,确定由胸锁乳突肌胸骨头、锁骨头及锁骨内1/3构成的三角,以三角顶点作为穿刺点,用标记笔标明穿刺点和港体位置。可用超声显示颈内静脉位置并标记。取5 ml注射器抽取利多卡因于穿刺点行局部麻醉,针尖指向右侧乳头方向,与皮肤45度,负压进针1~2 cm,抽到暗红色血后退出。取穿刺针沿试穿位置及方向进针(可超声引导),抽到暗红色血后,进入导丝,退出穿刺针。将穿刺点切开约0.5 cm,向下稍分离开皮下组织,旋转置入穿刺鞘。撤出穿刺鞘内芯,置入导管,撤出导丝。导管深度为穿刺点到胸锁关节上缘距离+术前CT测量胸锁关节上缘到上腔静脉右心房入口处距离。于锁骨下方2 cm处制作囊袋,建立皮下隧道,牵引导管至切口处,裁剪后与港体连接妥当。确认回抽及冲管通畅后,缝合两处切口。X片确认导管位置及有无气胸等并发症(图1)。(2)右侧颈内静脉后入路:穿刺点为胸锁乳突肌外缘中下1/3处,朝向胸骨柄上窝,水平进针。进针深度约1 cm。其余步骤同中入路。(3)右侧锁骨下静脉入路:穿刺点为锁骨中点下缘1 cm稍偏外1 cm处,沿锁骨背面,朝向胸锁关节上缘进针。其余步骤大致与颈内静脉中入路相同。(4)左侧锁骨下静脉入路:左侧操作除导管长度+3 cm外,其余同右侧。
图1 X片确认导管位置
3.观察指标:收集病人一般资料,包括性别、年龄、身高、肿瘤类型等情况,以及手术时间、术中出血、导管长度、术后疼痛评分、术后异物感、术后堵管发生率、感染发生率等指标。
三、统计学方法

结果
1.两组术中情况比较见表1。与B组比较,A组手术时间较长,但差异无统计学意义。A组中有3例由右侧锁骨下静脉穿刺未成功转颈内静脉穿刺的病人,对于手术时间延长有一定影响。A组穿刺时间较短,术中出血较少,与B组比较差异有统计学意义(P<0.05)。两组气胸、误穿动脉各有1例。A组导管移位发生率低于B组。A组导管长度较锁骨下静脉入路延长约3~4 cm,差异有统计学意义(P<0.05)。
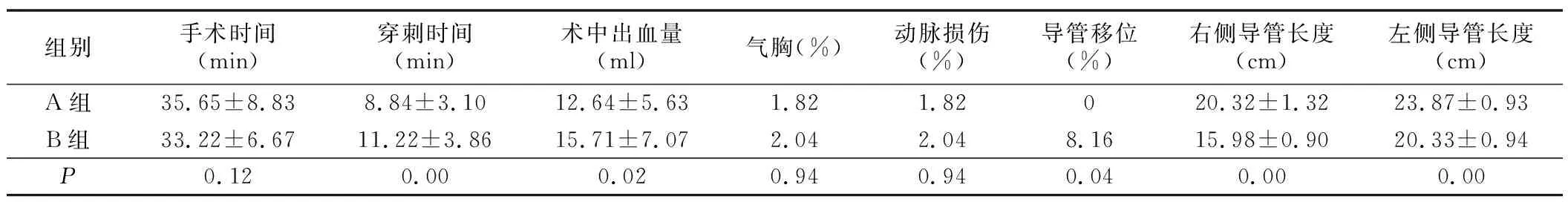
表1 两组术中情况比较
2.两组术后情况比较见表2。两组病人术后指标如术后疼痛评分、术后异物感、术后堵管发生率、感染发生率等比较,差异无统计学意义(P>0.05)。A组术后堵管方面发生率较低,但差异无统计学意义(P>0.05)。
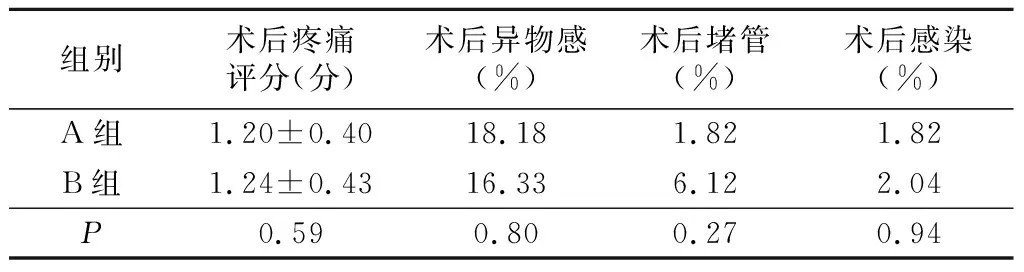
表2 两组病人术后指标比较
3.随访:颈内静脉入路组平均随访13.14个月,随访率100%,锁骨下静脉入路组平均随访13.49个月,随访率100%。A组术后远期异物感发生率为29.09%,B组为28.57%,两组比较差异无统计学意义(P>0.05)。两组各有1例出现感染,经静脉应用抗生素治疗后好转,化疗结束后予以拆除输液港。并无导管断裂、移位、注射座翻转等并发症。
讨论
我国整体癌症的发病率仍持续上升[5]。化学治疗(简称化疗)是治疗癌症的重要手段。化疗药物存在较多不良反应,长期大量用药可导致静脉炎等并发症。经中心静脉置管输液成为了化疗的必要输液方式。PICC成为化疗病人的主流选择。但PICC存在冲管换药频繁、易感染且不便于日常生活。近年来,经中心静脉穿刺置入静脉输液港可降低化疗时的静脉炎发生率,且相较于PICC,并发症少、冲管间隔周期长、对日常活动影响小[1-4]。输液港的常用入路包括颈内静脉穿刺、锁骨下静脉穿刺、贵要静脉穿刺以及切开置管(较为少见)等方式[6]。
本研究发现,颈内静脉入路有以下几方面优势:颈内静脉解剖位置较为表浅,头偏向对侧时,静脉恰好位于胸锁乳突肌锁骨头的深面,穿刺成功率较高,穿刺时间较短。有文献报道,经颈内静脉穿刺成功率98.68%,其中无辅助引导穿刺(盲穿)成功率97.99%,超声引导下穿刺成功率99.80%,经锁骨下静脉穿刺(盲穿)成功率88.83%[7]。可见超声引导颈内静脉穿刺成功率最高,颈内静脉盲穿次之,两者均明显高于锁骨下静脉穿刺。本研究中颈内静脉入路穿刺时间较短,且有3例病例因锁骨下静脉穿刺未果而改行颈内静脉穿刺。穿刺成功率高,可有效减少由反复穿刺导致气胸、动脉损伤、胸导管损伤等并发症的发生[8]。
右侧颈内静脉与头臂静脉、上腔静脉三者几乎成一直线,便于置管。我们一般首选右侧颈内静脉入路。这样导丝及导管进入上腔静脉较为顺利,导管移位进入锁骨下静脉发生率极低。锁骨下静脉穿刺置管时,导丝及导管可能向上逆行进入颈内静脉,出现导管移位[9]。锁骨下静脉位于锁骨和第一肋之间,位置较为恒定便于穿刺,但导管受两面骨性结构挤压易出现pinch-off综合征[10],导致输液不畅、管道堵塞,长期磨损甚至出现导管断裂等并发症。颈内静脉穿刺置管较为安全,远期堵管发生率较低。目前中心静脉穿刺多使用超声辅助[11-12],锁骨下静脉为锁骨所阻挡,超声较难显示。而颈内静脉较为表浅且无骨组织影响,全程几乎都可在超声上明确看到,可选择术前超声定位,亦可术中超声引导穿刺,亦能显示导丝进入上腔静脉情况,便于操作。但颈内静脉入路也存在导管较长,穿刺点处易形成锐角导致输液不畅等缺点。本研究发现,颈内静脉入路导管长度较锁骨下静脉入路延长约3~4 cm,但并无明显影响。部分病例采用后入路穿刺,即在胸锁乳突肌后缘中、下1/3交界处,此穿刺点位置较低,导管长度及角度均较中入路为优。操作中置入导丝后适当分离穿刺点皮下组织间隙,利于导管弧形转折,不至于在穿刺处折成锐角。后入路穿刺置管导管于胸锁乳突肌后方置入颈内静脉,不影响转颈等动作,较为舒适。
颈内静脉穿刺较为安全,应为静脉输液港首选置入方式。但穿刺时一旦不顺,可能血管出现夹层或周围组织间隙血肿形成,穿刺难以成功。因此,术前应充分评估好血管条件,选择好首选穿刺入路的同时,做好可随时更改穿刺入路的准备。
