藜麦SSR指纹图谱构建及遗传多样性分析
2023-08-07陈翠萍闫殿海张书苗左皓南高森刘洋
陈翠萍 闫殿海 张书苗 左皓南 高森 刘洋
(1 青海大学农林科学院,810016,青海西宁;2 农业农村部植物新品种测试(西宁)分中心,810016,青海西宁)
藜麦(Chenopodium quinoaWilld.)是一年生的苋科藜属双子叶植物,原产自南美洲安第斯山脉地区,又称为南美藜和奎奴亚藜等,有5000~7000年的栽培历史[1]。藜麦营养均衡、蛋白质含量高且氨基酸组成完美,富含矿物质、不饱和脂肪酸和维生素等成分,由于其营养组成丰富,现已成为炙手可热的商品作物[2-5]。藜麦的营养价值被联合国粮食和农业组织(Food and Agriculture Organization,FAO)认为是唯一一种可以满足人类基本营养需求的食物[6]。
早在1987 年,我国西藏农牧学院和西藏农业科学院便开始了藜麦的引种试验[7]。目前,藜麦已成为我国农业供给侧改革种植结构调整的重要作物。由于藜麦是引进作物,在引进过程中出现品种多、乱、杂、遗传背景和遗传信息等种质特征不清楚的问题,导致不易进行种质资源的鉴定、评价、研究和利用,极大地限制了藜麦产业的健康可持续发展。早期的种质资源遗传多样性研究多使用的是形态学标记法、系谱分析法以及同工酶法,随着DNA 分子标记技术的不断发展,RFLP(restriction fragment length polymorphism)、AFLP(amplified fragment length polymorphism)、RAPD(random amplified polymorphic DNA)以及SSR(simple sequence repeats)等分子标记技术用来进行遗传多样性分析研究,其中SSR 分子标记具有灵敏度强、操作简单、分布较广和多态性丰富等优点,已在遗传多样性分析、分子育种、指纹图谱构建等领域应用较为广泛[8-11]。目前,小麦、玉米和大豆等作物的指纹图谱已有多篇报道[12-14],但藜麦的指纹图谱鲜有报道。
本研究利用SSR 分子标记法对不同来源的96份藜麦材料进行SSR 引物的筛选,构建藜麦DNA指纹图谱和遗传多样性分析。同时,SSR 引物的多态性评价也为藜麦品种鉴定和DUS 测试中指纹图谱的构建及近似品种的筛选提供参考。
1 材料与方法
1.1 供试材料
本试验收集国内外藜麦种质材料共计96 份,由青海省农林科学院作物育种栽培研究所提供,各材料均在青海连续自交种植多年以上,种质材料编号和来源信息见表1。

表1 藜麦材料的编号及来源Table 1 The numbers and sources of quinoa materials
1.2 试验方法
1.2.1 藜麦基因组DNA 的提取 试验于2020 年4-10 月在青海省农林科学院试验基地进行。在藜麦苗期,选取5 株长势一致的植株,混合等量叶片,利用CTAB 法提取藜麦基因组DNA,利用超微量紫外分光光度计测定DNA 的浓度和纯度,并将其保存在-20℃冰箱中[15-17]。
1.2.2 引物 选取表型差异较大的4 份藜麦DNA,从221 对引物中筛选具有多态性、条带清晰且稳定的引物用于96 份藜麦种质材料的遗传多样性分析。221 对引物均来源于Jarvis 等[17]公布的引物信息,由上海捷瑞生物工程有限公司合成。
1.2.3 PCR 扩增 采用左皓南等[18]扩增程序的方法,94℃3min;94℃30s,60℃30s,72℃1min 9个循环,每个循环减0.5℃,94℃30s,55℃45s,72℃1min 2 个循环;72℃10min;4℃保存。并根据不同SSR 引物的特性调节退火温度。
1.2.4 电泳产物检测 利用6%的变性聚丙烯酰胺凝胶电泳对扩增的PCR 产物进行垂直电泳检测,进行银染染色,NaOH、甲醛溶液显色和漂洗,读带并拍照记录。
1.3 数据处理
根据扩增结果,将同一引物扩增出的大小相同的条带视为1 个等位变异,并进行记录。在96 个DNA 样本中同一等位基因位点上有相同明显条带的记作1,无明显条带则记作0,以此做出“0-1”矩阵型读带表。利用PopGen 32 软件分析读带表,计算出多态性指数等,采用NTSYSpc 2.1 软件进行UPGMA 方法聚类分析并做图。
2 结果与分析
2.1 SSR标记在96份藜麦种质材料上的多态性分析
从221 对SSR 引物中共筛选出18 对(表2)具有特异性条带的引物。18 对SSR 引物在96 份藜麦种质材料中共得到了94 个等位基因位点,每对引物的等位基因位点在3~10 个,平均每对引物可检测到的等位基因位点数为5.2(表3 和图1)。其中KAAT021 检测到的等位基因位点数最多,为10 个;KGA010、KGA100 和BGA200 最少,仅为3 个,其余14 对引物在4~7 个。

图1 引物KGA145 扩增结果Fig.1 The results of amplification by KGA145

表2 SSR 引物的序列信息Table 2 Sequence information of SSR primers

表3 18 对SSR 引物扩增结果Table 3 Amplification results of 18 pairs of SSR primers
18 对SSR 标记的观察杂合度(Ho)的变化范围为0.16~0.55,均值为0.36;期望杂合度(He)的变化范围为0.13~0.35,平均值为0.24;Shannon多样性指数(I)变化范围为0.23~0.52,平均值为0.37;多态信息含量(PIC)的变化范围为0.19~0.38,平均值为0.28。其中,KGA100 和KCAA015的PIC 和I都较高,表明KGA100 和KCAA015 具有较高的多态性检测效率。
2.2 DNA 指纹数据库的初步构建
将某一品种从其余95 个品种中区分开的特征引物共有16 个(KAAT001、KAAT016、KAAT041、KCAA015、KGA010、KGA100、KGA128、KGA134、KGA145、KGA156、BGA200、KAAT018、KAAT021、KCAA078、KCAA065、KGA114),其中KAAT041可以一次性区分12 个品种,分别是BZ-46、BZ-32、BZ-29、BZ-66(W)、BZ-68(P)、BZ-42、BZ-46、BZ-68(P)、PB-03、y1-10、BZ-62、y1-24。能将2~3 个品种鉴定出来的引物共有17 对,利用这类引物组合可进行品种鉴定,使其操作简单且具有高效性。为了构建指纹图谱,利用2 种或2 种以上的引物可提高鉴别的准确性,经分析,组合利用上述18对多态性引物可将96 份DNA 样品完全鉴别。
利用18 对引物对96 份藜麦DNA 材料扩增出的条带进行遗传多样性分析,综合分析引物多态信息含量值的大小、引物带型统计难易程度和Shannon多样性指数,以十进制数字进行编码,构建96 份藜麦种质材料的指纹图谱,表4 为部分藜麦种质的指纹图谱(表中数字为引物对该品种可扩增出的条带数),用于构建96 份种质材料指纹图谱的引物组合见表5。
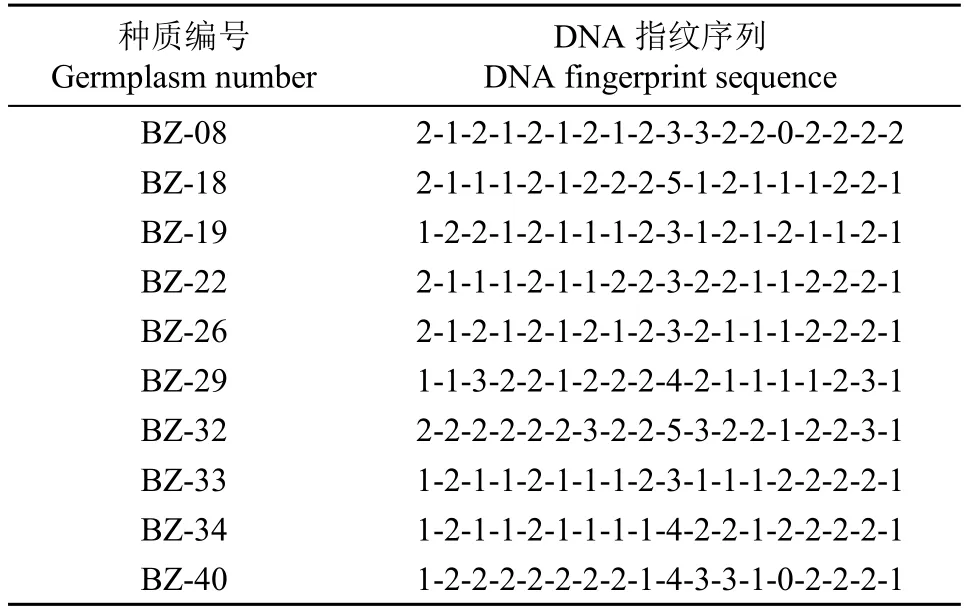
表4 部分藜麦种质指纹图谱Table 4 Fingerprint of some quinoa germplasms

表5 96 份藜麦材料指纹图谱的引物组合Table 5 Primer combinations for identification of 96 quinoa materials
2.3 遗传多样性分析
对96 份种质材料进行遗传多样性分析,结果(图2)表明,供试材料之间的遗传相似系数介于0.55~0.98,平均为0.77。其中BZ-04 和BZ-38,BZ-07 和BZ-14 的遗传相似系数(0.98)最大。而BZ-18与BZ-24 遗传相似系数(0.55)最小。不同材料之间的遗传相似系数值大多分布在0.60~0.80,分别占34.82%和46.41%,这表明96 份藜麦种质材料亲缘关系较近。

图2 遗传相似系数分布Fig.2 Distribution of genetic similarity coefficients
根据不同种质间的遗传相似系数对96 份藜麦种质材料进行UPGMA 法聚类分析(图3)。在相似系数为0.31 处将96 份藜麦种质材料分为3 个类群,其中,类群Ⅰ主要包括中国西藏、青海、甘肃3 个地区共65 份种质材料;类群Ⅱ包括中国西藏的2 份种质材料(BZ-18 和BZ-19);类群III 包含29份种质材料,多为阿根廷种质材料。在相似系数0.33 处可将类群Ⅰ进一步分为3 个亚类,其中第1亚类包含33 份种质,其中西藏23 份、青海西宁3份、青海海西4 份、甘肃3 份;第2 亚类包含24份种质,其中西藏4 份、青海西宁18 份、青海海西2 份;第3 亚类包含8 份种质,全来自青海海西。在相似系数0.32 处可将类群Ⅲ分为2 个亚类,其中第1 亚类包含8 份种质,其中中国西藏7 份,中国青海西宁1 份;第2 亚类21 份种质,全部为阿根廷种质材料。

图3 96 份藜麦种质资源聚类分析Fig.3 Cluster analysis of 96 quinoa germplasms
3 讨论
SSR 分子标记是基于PCR 技术的一种分子标记,在基因组中的多态性很高。它克服了RFLP、RAPD 等标记的不足,被认为是研究遗传多样性较为有效的分子标记系统,越来越被广泛应用。
本研究共筛选了221 对SSR 引物,能够扩增出多态性条带的引物仅有18 对,占比8.1%。品种间SSR 分子标记的多态性相对较差,可能是由于96份藜麦材料的遗传差异性较小和亲缘关系接近等原因,综合表现为较低的多态性。每对引物的平均等位基因数为5.2,而Fuentes 等[19]检测59 份智利藜麦种质得出每对SSR 引物检测到7.5 个等位基因,Christensen 等[20]得出每对引物平均扩增11 个等位基因,宋娇[21]利用46 对引物在114 份藜麦种质中每对引物平均扩增3.59 个等位变异数。由此可见,平均等位基因数量的多少与所用分子标记有关,也与所选种质资源之间亲缘关系远近有关。因此,在选用SSR 分子标记进行种质资源评价中尽可能选用等位基因数量较多的分子标记。
本试验聚类分析结果表明,来自于阿根廷地区的种质被单独聚为一大类,说明相同地域的品种更容易被聚为一类,但是也有交叉现象,比如来源于我国西宁PB-06 编号的种质与阿根廷种质的遗传相似系数接近,说明亲缘关系接近。聚类分析将96份藜麦种质分为3 个类群,类群Ⅰ品种最多,为中国西藏、甘肃和青海的种质材料,且大部分西藏种质和青海海西种质材料的亲缘关系更加接近,表明这些种质材料可能是从同一亲本材料或者亲缘关系较近的种质材料引种的;类群Ⅱ仅有中国西藏2份种质,可能是随着地理区域分布,2 份种质材料与其余的种质亲缘关系较远;类群Ⅲ多为阿根廷种质,表现出明显的地域性。聚类分析的结论也验证了亚群分布与地理区域密切相关[22]。在对藜麦进行遗传多性分析和种质资源评价时应结合表型性状和分子标记数据[23]。
分子标记与形态学标记相较而言稳定性和特异性更高,因此,利用分子标记为基础构建的DNA指纹图谱鉴别植物品种更准确。SSR 分子标记已经成功应用在多个作物的指纹图谱构建方面[24-26]。利用分子标记构建藜麦指纹图谱的研究还较为少见。本研究利用筛选出的18 对多态性引物可将96 份DNA 样品完全鉴别,所筛选的SSR 分子标记为藜麦种质分类、指纹图谱构建、品种鉴定和品种权保护提供重要的理论依据与技术支撑。
4 结论
共筛选出了18对适用于藜麦的SSR分子标记,并对96 份来源不同的藜麦种质材料进行遗传多样性分析和DNA 指纹数据库构建,将96 份藜麦种质材料完全区分并鉴定出来;聚类分析将96 份藜麦种质材料分为3 个类群。
