侵染青海辣椒的辣椒隐症病毒2基因组克隆与分析
2023-08-07罗海林闫佳会郭青云
罗海林,袁 雷,闫佳会,郭青云
(青海大学 农林科学院,青海省农业有害生物综合治理重点实验室,农业农村部西宁作物有害生物科学观测实验站,青海 西宁 810016)
辣椒隐症病毒2(Peppercrypticvirus2,PCV2)是一种重要的辣椒病毒病。PCV2在国内外均已有报道,1995年Arancibia等[1]在Hungarian Wax辣椒上发现一种独特的dsRNA病毒,随后Sabanadzovic和Valverde将其命名为Peppercrypticvirus2(PCV2)[2]。目前,在美国、印度、韩国、意大利等地均有其侵染辣椒的报道[3-5]。在我国,PCV2是近年来发现的新病毒,PCV2于2017年首次在重庆辣椒上发现[6]。同年,王少立等[7]在山东辣椒上检测出PCV2。随后申冕等[8]研究发现新疆辣椒中普遍存在PCV2的侵染。
PCV2属于双分病毒科Partitiviridae丁型双分病毒属Deltapartitivirus[9],是一种双链RNA (dsRNA) 病毒,内含dsRNA1和dsRNA2两个线性的单顺分子,被外壳蛋白单独包被成直径约30 nm的等距病毒粒子,其中dsRNA1编码RNA依赖的RNA聚合酶,dsRNA2内含一个开放阅读框,编码一个由约430个氨基酸组成的外壳蛋白。PCV2的两个基因组片段是被分开包裹的,所以至少有两个病毒粒子被传播到一个新的细胞中,才会引发侵染[9]。PCV2通常是在细胞分裂期间垂直传播或在细胞与细胞的亲密接触期间水平传播[10],目前没有已知的可传播PCV2的自然媒介,其只能通过花粉或种子传播,不能通过嫁接或机械播种传播[11-12]。
青海位于青藏高原东北部,具有独特的冷凉气候,日照时数长,有利于高原冷凉蔬菜生态产业的发展[13]。辣椒作为青海重要的高原特色蔬菜,风味独特广受欢迎,发展前景较好。其中乐都长辣椒品质优良、丰产性好、抗逆性强,广受欢迎;循化线辣椒生产效益高,发展前景好[14]。在已知的病原病害中,病毒病是制约辣椒生产的最常见的病害之一。青海已报道的侵染辣椒的病毒病有烟草花叶病毒(Tobaccomosaicvirus,TMV)、黄瓜花叶病毒(Cucumbermosaicvirus,CMV)、蚕豆萎蔫病毒2(Broadbeanwiltvirus2,BBWV2)[15]、番茄斑萎病毒(Tomatospottedwiltvirus,TSWV)[16],以及辣椒轻斑驳病毒(Peppermildmottlevirus,PMMoV)[17]。2021年,对青海省辣椒病毒病调查发现,辣椒的产量降低,但植株无明显发病症状的现象,疑似存在隐症病毒的侵染。对疑似病样进行分子检测,克隆其基因组全序列并分析其全基因组结构特征,明确该辣椒上存在PCV2的侵染。这是青海首次报道PCV2的全基因组序列,本研究对当地辣椒病毒病防治工作具有重要的指导意义。
1 材料与方法
1.1 试验材料
供试病样为2021年采自青海省海东市的辣椒病叶,共46份,用液氮速冻后存于-80 ℃冰箱备用,该病叶在田间无明显症状。
克隆用特异性引物根据PCV2的两条dsRNA全基因组序列设计病毒特异性引物,并委托杨凌天润奥科生物科技有限公司合成。
1.2 样品总RNA的提取
辣椒病叶的总RNA提取用Trizol法并略作修改[18]:取-80 ℃冰箱中保存的辣椒样品0.1 g,用液氮速冻后放入组织破碎仪中打碎成粉末,然后加入1 mL Trizol,颠倒混匀,室温静置5 min。加入200 μL氯仿,剧烈振荡15 s,室温静置5 min后12 000 r·min-1,4 ℃离心15 min。弃沉淀取上清液并加入等体积的异丙醇,颠倒混匀,-20 ℃反应30 min,12 000 r·min-1、4 ℃离心10 min。弃上清液并用75%的乙醇漂洗沉淀,8 000 r·min-1,4 ℃离心5 min,重复2次。将沉淀晾干并加入20 μL的ddH2O溶解沉淀。检测RNA的纯度后置于-80 ℃冰箱保存(本试验RNA的D260/D280在1.8~2.0符合试验要求)。
1.3 PCV2病毒分子检测鉴定
用Fastking一步法RT-PCR试剂盒(天根生物科技有限公司)以提取的总RNA为模板合成cDNA,反应体系20 μL:5×FastKing-RT SuperMix 4 μL,总RNA 2 μL,RNase-Free H2O 14 μL。反应程序为42 ℃ 15 min,95 ℃ 3 min。反应结束后cDNA保存到于-20 ℃冰箱。用PCV2特异性引物PCV2F和PCV2R[7],以cDNA为模板进行PCR检测,PCR反应体系共20 μL:2×TaqMix 10 μL,cDNA 1 μL,PCV2特异性引物上下游各1 μL,ddH2O 7 μL。反应程序:94 ℃ 5 min;94 ℃ 45 s,59.8 ℃ 45 s,72 ℃ 25 s,34个循环;72 ℃ 10 min。取5 μL PCR产物于1%琼脂糖凝胶电泳15 min,观察其条带并拍照。
1.4 PCV2 RNA全基因组序列克隆
反转录用PrimerScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒(宝日医生物科技有限公司),反应体系:5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL、稀释到1 μg的RNA 1 μL、RNase Free H2O 6 μL,42 ℃反应5 min,然后加入PrimerScript RT Enzyme Mix Ⅰ 1 μL、RT Primer Mix×4 1 μL、5×PrimerScript Buffer 2 4 μL、RNase Free H2O 4 μL,37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。反应结束后cDNA保存到于20 ℃冰箱。
PCR反应体系25 μL(宝日医生物科技有限公司):5×PrimeSTAR HS Buffer (Mg2+Plus) 5 μL,dNTP 2 μL,引物各1 μL,cDNA 1 μL,primeSTAR HS DNA polymerase 0.25 μL,RNase-Free H2O补足至25 μL。反应程序94 ℃ 1 min;98 ℃ 10 s,Tm(退火温度根据引物设置) 5 s,72 ℃延伸,延伸时间为1 kb·min-1,34个循环;72 ℃ 10 min。PCR扩增后用PCR产物进行凝胶电泳检测,将获得的目的片段回收纯化。回收产物连接pEASY-Blunt载体并转化至Trans-T1感受态细胞中(北京全式金生物技术有限公司),挑选至少3个阳性克隆送至杨凌天润奥科生物科技有限公司测序。
1.5 序列分析方法
特异性引物用PrimePrime5软件设计,测序结果经NCBI比对(https://blast.ncbi.nlm.nih. gov/Blast.cgi)后用SeqMan软件拼接获得PCV2的RNA全长序列。将拼接后的序列用MEGA6.0软件比对并用最大似然法(maximum likelihood)、自导复制(bootstrap)1 000次构建系统进化树。
2 结果与分析
2.1 辣椒病样的分子检测
感病辣椒植株于2021年6 —10月在青海省西宁市和海东市辣椒主要种植区采集,病株田间无明显病毒病发病症状。为明确辣椒病毒病的种类,我们对田间采集的辣椒叶片的病毒病种类进行了RT-PCR检测,结果发现,用特异性引物PCV2F和PCV2R(引物序列见表1)检测PCV2时[7],共有20份扩增得到约400 bp的条带,与目的条带375 bp大小相近,而其余样品和健康植株均没有扩增到相应的条带。将扩增到目的条带的样品随机抽取3个进行克隆转化并测序,测序结果在NCBI网站上比对,BLAST结果显示,其与PCV2的核苷酸一致性和氨基酸一致性较高。上述结果说明,在海东市采集的辣椒病样中可能存在PCV2的侵染。
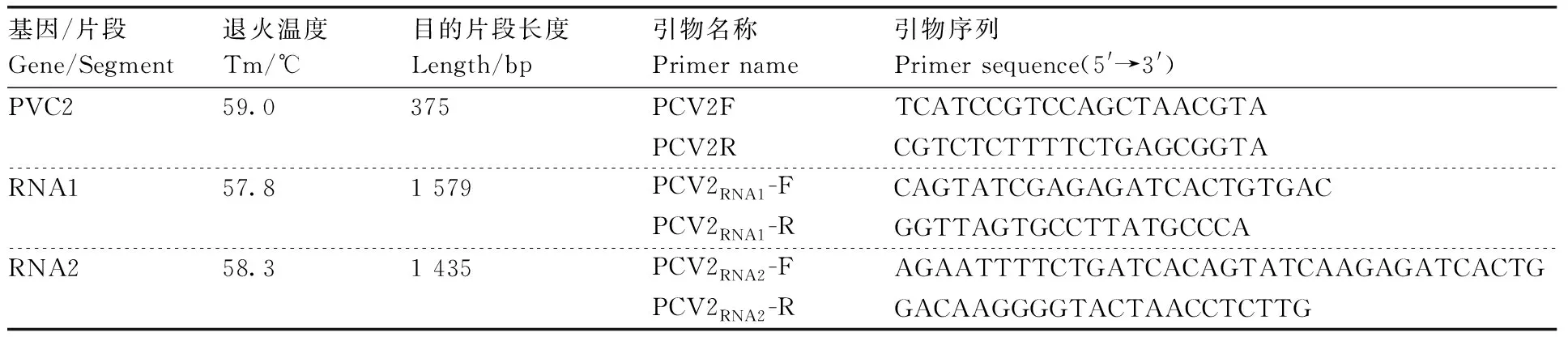
表1 PCV2的检测和全基因组克隆特异性引物序列
2.2 PCV2全基因组克隆及结构分析
根据PCV2的两条dsRNA的基因组序列分别设计全长特异性引物(表1),以海东市辣椒病样的总RNA为模板,用特异性引物PCV2RNA1-F/PCV2RNA1-R扩增RNA1,用特异性引物PCV2RNA2-F/PCV2RNA2-R扩增RNA2,分别得到约1 500 bp的目的片段(图1)。测序结果利用DNAMAN软件过滤比对后获得PCV2 RNA1和RNA2的全基因组序列,RNA1全长1 579 bp,RNA2全长1 435 bp。RNA1编码与基因组复制和表达相关的RNA依赖的RNA聚合酶(RdRp)。RdRp由102~1 538 bp编码的478个氨基酸组成,而RNA2编码外壳蛋白(CP)。CP由64~1 356 bp编码的430个氨基酸组成(图2)。

Marker,DL 2000 Marker;PCV2-RNA1,特异性引物PCV2RNA1-F/PCV2RNA1-R扩增结果;PCV2-RNA2,特异性引物PCV2RNA2-F/CV2RNA2-R扩增结果。Marker,DL 2000 Marker; PCV2-RNA1, Amplification results of specific primers PCV2RNA1-F/PCV2RNA1-R; PCV2-RNA2, Amplification results of specific primers PCV2RNA2-F/CV2RNA2-R.图1 PCV2全基因组克隆Fig.1 Cloning of PCV2 complete gene sequences
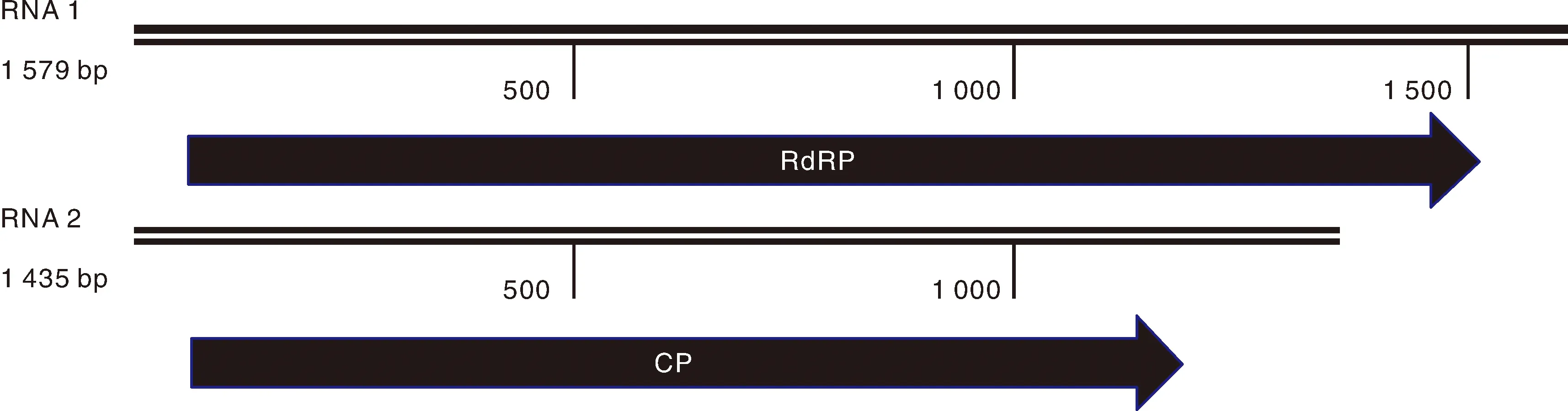
图2 PCV2青海分离物的基因组结构Fig.2 Genome structure of PCV2 Qinghai isolate
2.3 同源性及聚类进化分析
对获得的PCV2青海辣椒分离物(PCV2-QH)基因组中的两条dsRNA链进行同源性分析和聚类分析,其中BLAST分析结果显示(表2),RNA1与中国、韩国、美国、多米尼加共和国以及土耳其等地区的PCV2分离物的核酸一致性为65%~99%,其与中国新疆分离物PCV2-XJ(MT328005.1)、多米尼加共和国分离物DR(KX525268.1)以及韩国分离物SC10-2(KY923703.1)、YY(LC195294.1)等核苷酸完全一致(99%),且氨基酸序列均高于98%,分别为99.21%、99.02%、98.89%和98.36%;RNA2与中国、韩国、美国、多米尼加共和国以及土耳其等地区的PCV2分离物的核苷酸一致性为83%~99%,氨基酸一致性为97.92%~99.83%,其与中国新疆分离物PCV2-XJ核苷酸序列一致性为99%,氨基酸序列一致性为99.64%,上述结果表明其为PCV2的一个分离物。将PCV2青海分离物与已报道的PCV2基因组序列进行聚类分析(图3和图4),结果表明,RNA1与RNA2分别与已报道的PCV2分离物聚为一支,RNA1与分离物Chiltepin53(MG542629.1)、Ember (MG542626.1)、Jalapeno criollo(MG542630.1)聚为一个分支,RNA2与重庆分离物PCV2-CQ(KX905078.1)和Chiltepin53(MG542623.1)聚为一个分支,上述结果表明,从青海辣椒上分离到的病毒病为PCV2。
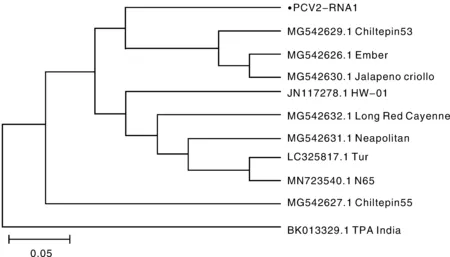
各支上的数值表示1 000次Bootstrap自导复制的置信度。●表示本研究测定的PCV2青海分离物RNA1。Confidence values of 1 000 bootstrap replication in each branch are above the branch. ●, PCV2 Qinghai isolate sequence studied.图3 根据PCV2的RNA1核苷酸一致性构建的系统进化树Fig.3 Phylogenetic tree based on nucleotide sequence consistency of RNA1 of PCV2

各支上的数值表示1 000次Bootstrap自导复制的置信度,●表示本研究测定的PCV2青海分离物RNA2。Confidence values of 1 000 bootstrap replication in each branch are above the branch. ●, PCV2 Qinghai isolate sequence studied.图4 根据PCV2的RNA2核苷酸一致性构建的系统进化树Fig.4 Phylogenetic tree based on nucleotide sequence consistency of RNA2 of PCV2
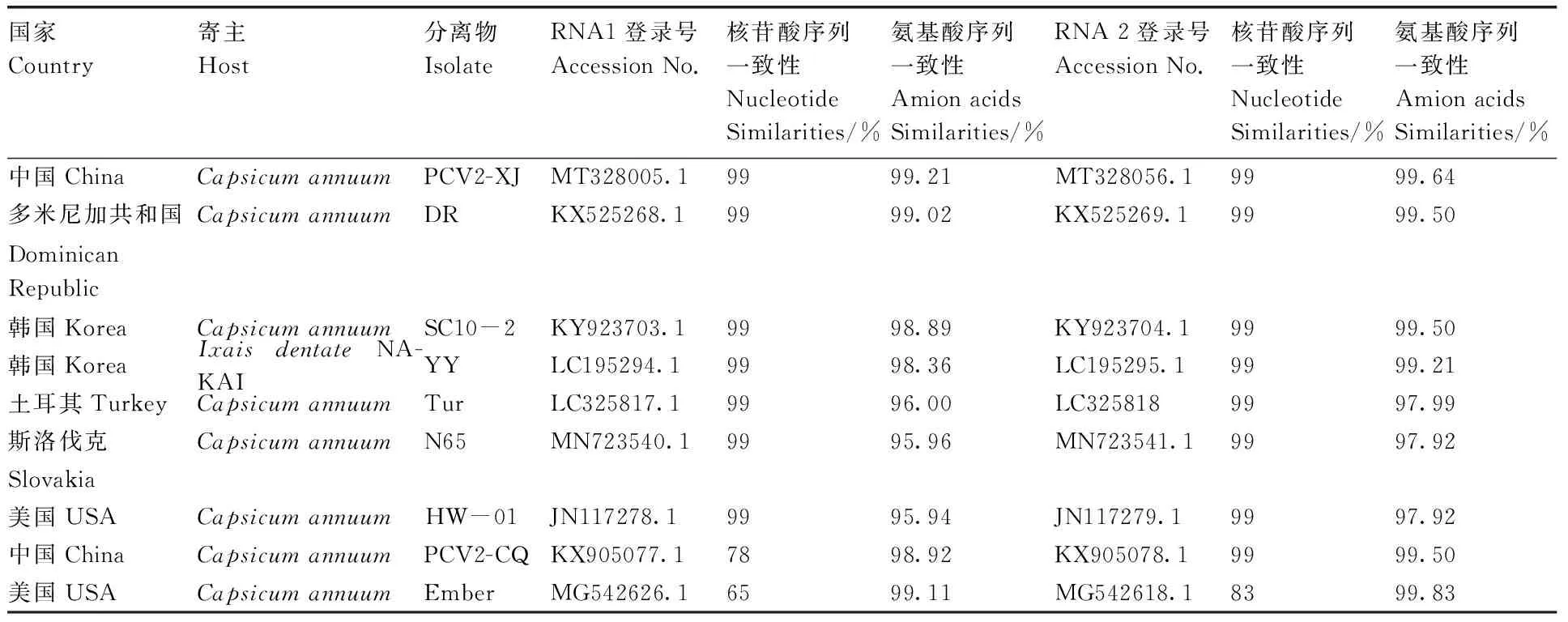
表2 青海辣椒分离物RNA序列与其他相关核苷酸序列和氨基酸序列相似性比较
2.4 PCV2-QH与已报道的其他分离物的突变碱基分析
新疆报道的PCV2序列是目前国内报道的比较完整的序列,且青海与新疆的部分气候特征较为相似,用新疆的序列与青海的序列比对,明确两地序列是否有差异。将NCBI网站上的PCV2全基因组序列与本试验获得的PCV2-QH的序列进行比对,结果显示,青海PCV2辣椒分离物与其他分离物核苷酸一致性较高,高达99%,氨基酸一致性也较高,均高于97%。对PCV2-QH和PCV2中国新疆分离物(PCV2-XJ)的全基因组序列进行序列多态性位点分析,结果显示,PCV2-QH与PCV2-XJ 的dsRNA1有7个差异位点,这些位点均位于编码区且其中6个位点为非同义替换,1个为同义替换,导致RdRp中存在6个氨基酸差异;dsRNA2有11个差异位点,其中10个位于非编码区,1个位于编码区且为同义替换(表3)。上述分析结果表明,虽然PCV2-QH与PCV2-XJ的核苷酸序列一致性和氨基酸序列一致性较高,但还是存在多位点差异。
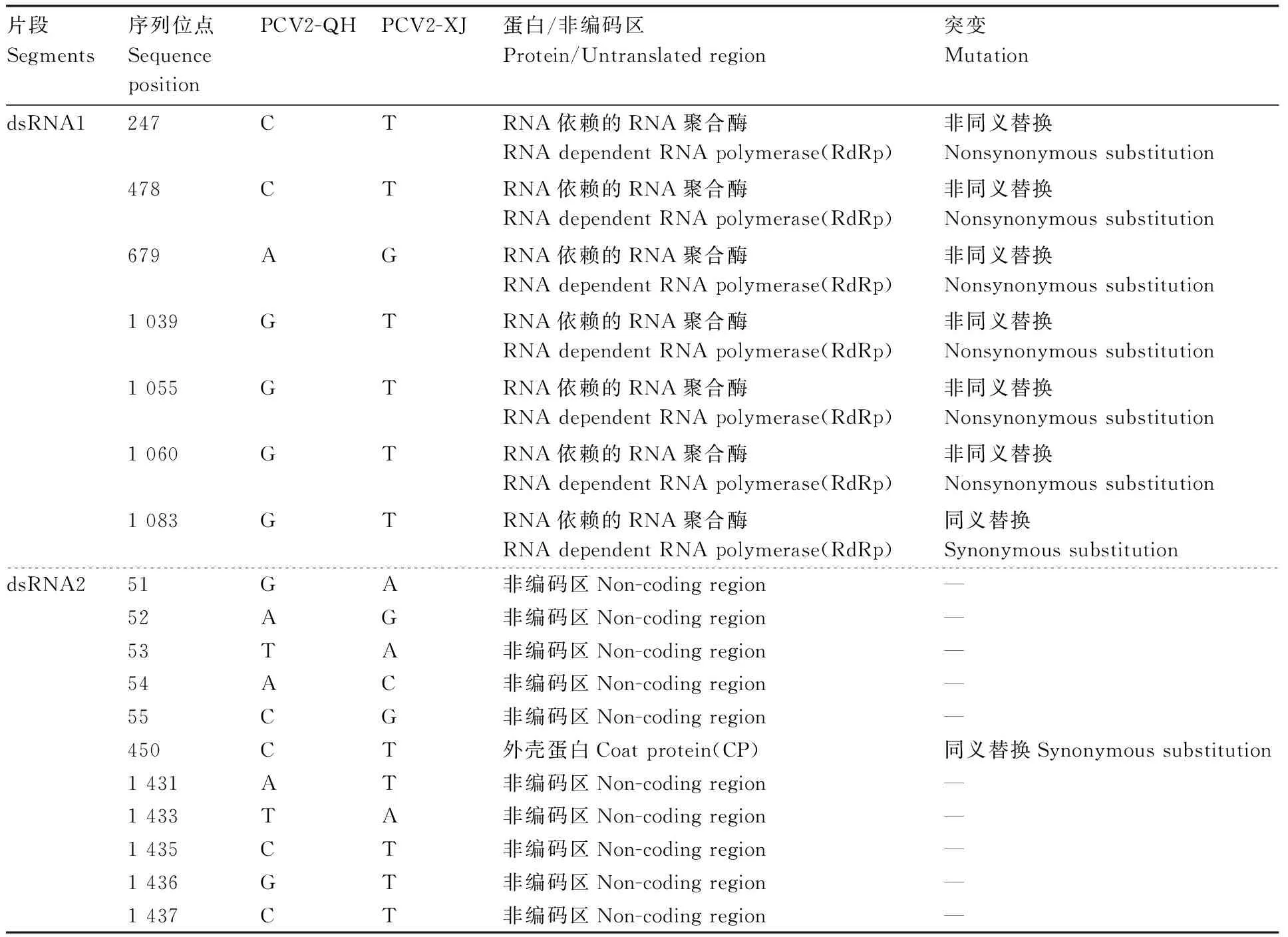
表3 PCV2-QH和PCV2-XJ的全基因组序列的核酸多态性分析
3 讨论
辣椒是青海省重要的经济作物,种植面积逐年增加。同时,病害的发生和严重程度对辣椒产量和品质的影响越来越大。病毒病是辣椒生产中最常见的制约因素之一,全世界最少有70种病毒可以侵染辣椒[19]。PCV2是丁型双分病毒属的代表种,丁型双分病毒属是双生病毒的重要分支。目前,该属只包含从植物中分离的病毒[9],内含两个基因组片段,每个基因组片段被单独包裹,每个dsRNA包含一个开放阅读框,分别编码RdRp和CP[20]。本研究首次在青海省检测出PCV2侵染辣椒,克隆并分析PCV2的全基因组序列,结果表明,PCV2-QH与其他分离物核苷酸一致性和氨基酸一致性较高,但存在少量差异位点。其中dsRNA1编码的RdRp在病毒的复制中起关键作用,其与PCV2-XJ存在6个氨基酸差异位点;而dsRNA2编码的CP蛋白无氨基酸差异,CP蛋白较为稳定。
PCV2是近年来新发现的一种隐症病毒,与其他隐症病毒类似,隐症病毒通常为潜伏侵染,症状轻微且难以检测[21],病毒通过种子在细胞内高效传播,发生在青海的PCV2是否与当地种子调运有关,有待进一步调查。PCV2没有已知的传播媒介,只能通过种子或者花粉传播,目前没有特效的农药进行防治。因此,播种前期注意种子消毒处理,例如温烫浸种、福尔马林浸种等方法。本试验在青海检测出PCV2,对于辣椒病毒病的预测预警以及精准防控研究提供了技术支撑,有利于辣椒产业的健康发展。隐症病毒常和其他病毒复合侵染,PCV2常与番茄斑萎病毒、黄瓜花叶病毒、马铃薯Y病毒(PotatovirusY ,PVY)等复合侵染[22],Martinez等[4]研究发现,PCV2与TSWV复合侵染,但PCV2侵染同时是否伴随其他病毒侵染有待于后续研究进一步验证。
