促生长植物激素对桑树叶片衰老过程生理生化指标的影响
2023-08-07许自龙林天宝吕志强刘培刚
朱 燕,魏 佳,许自龙,林天宝,杨 升,刘 岩,吕志强,刘培刚,*
(1.浙江省农业科学院 蚕桑与茶叶研究所,浙江 杭州 310021; 2.浙江省农业科学院 亚热带作物研究所,浙江 温州 325005)
桑树(MorusalbaL.)是一种多年生木本特种经济树种,其叶子是传统蚕丝产业最主要的生物饲料。叶片衰老是植物叶片发育后期的一个重要特征,也是经济作物的一个重要农艺性状。桑树秋叶硬化率达 60% 以上称之为硬化期,代表叶片进入衰老期,而硬化期早晚对于晚秋蚕茧产量、质量具有重要的影响。因此,叶片硬化期早晚成为桑树品种选育的一个重要参考指标[1]。另外,桑叶是我国传统中药材之一,其中,以经霜桑叶药效最佳,因此,硬化迟桑树品种更适于中药材或霜桑茶的加工与应用[2]。
植物内在发育信号与环境因素协同通过诱导植物体内不同类型激素水平变化来调控叶片的硬化与衰老过程[3]。其中,一些植物激素如生长素(auxin,IAA)、细胞分裂素(cytokinin,CTK)和赤霉素(gibberellin,GA)等被证实具有促进植物生长、延迟植物衰老的作用,三者在植物的衰老过程中含量呈现不断下降趋势[3-4]。另外,在我们前期研究中发现,叶片中抗氧化酶活性、渗透调节物质含量及丙二醛(malondialdehyde,MDA)含量等与桑树叶片硬化、衰老过程密切相关,可以作为桑树叶片衰老的重要评判指标[1,5]。
本研究通过对3 种促生长类植物激素对桑树叶片衰老相关指标的调控的研究,进一步了解促生长植物激素在桑树叶片衰老过程中发挥的调控作用,为实现桑叶硬化延迟、晚秋期桑叶质量提升提供理论帮助。
1 材料与方法
1.1 试验材料
以迟衰(硬化期晚)桑树品种强桑1号与早衰(硬化期早)桑树品种荷叶白为试验材料。这2个桑树品种均为10年生,以低干拳式树形养成。关于这2个品种叶片的硬化期,可详见前期研究报道[5]。供试桑树品种于浙江省农业科学院蚕桑与茶叶研究所桑树品种资源圃中种植保存。
1.2 激素及抑制剂
外源促生长类激素及抑制剂:生长素(2, 4-D,100 mg·L-1),细胞分裂素(6-BA,400 mg·L-1),赤霉素(GA3,100 mg·L-1);生长素抑制剂(2, 3, 5-triiodobenzoic acid,TIBA,5 mg·L-1),细胞分裂素抑制剂(lovastatin,LOV,4 mg·L-1),GA抑制剂:(chlormequat chloride,CCC,1 000 mg·L-1)。
1.3 桑树处理及样本采集
同一品种桑树随机选取生长势基本一致,环境条件差异小,叶片发育状态相近的植株进行促生长激素及抑制剂处理,每处理6株,利用各外源激素及其抑制剂喷洒叶片(每株500 mL),保证每片叶子都能充分喷洒到激素与抑制剂,连续处理 7 d。对照组采用清水进行喷洒处理。田间其他管理一致。
处理完毕后,桑树再生长7 d,每隔14 d进行一次桑叶样本采集,共取样4个阶段。每个处理第一次取成熟叶第 10 片叶子,然后在相应位置做好标记,在后面3次取样时,取相同位置叶片。
1.4 桑叶可溶性蛋白、脯氨酸和丙二醛含量检测
准确称取 1 g新鲜叶片,置于研钵中加液氮研磨成粉,然后按照相关试剂盒说明书(南京建成生物技术有限公司),分别进行各桑叶样本SP、Pro和MDA提取与含量测定。每个桑叶样品设3个重复,酶标仪检测时每个重复设置6个复孔。
1.5 叶片抗氧化酶活性检测
准确称取 1 g新鲜叶片于液氮中研磨后,按照样品与生理盐水1∶10 的体积比加入预冷的生理盐水,混匀后2 500 r·min-1离心10 min,吸取上清用于抗氧化酶活性检测。按照CAT、POD和SOD活性检测试剂盒的说明书(南京建成生物技术有限公司)步骤进行测定。每个桑叶样品设3个重复,酶标仪检测时每个重复设置6个复孔。
1.6 叶片中内源激素含量测定
准确称取1 g新鲜叶片,液氮充分研磨后加入PBS磷酸缓冲液中充分匀浆,然后在2 500 r·min-1、4 ℃ 条件下离心10 min,离心后取上清。然后按照相应ELISA试剂盒(上海纪宁实业有限公司)步骤分别进行IAA、CTK和GA含量检测。每个样本设3个重复,每个重复进行酶标仪检测时设置6个复孔。
1.7 统计分析
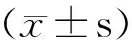
2 结果与分析
2.1 桑树叶片衰老进程中植物激素的变化
硬化迟桑树品种强桑1号和硬化早桑树品种荷叶白 2品种叶片生长发育的 4 个不同发育阶段3种促植物生长激素水平测定结果见图 1。由图 1 结果可以看出,强桑1号叶片中的 IAA、CTK(Z+ZT)和GA水平在不同发育不同阶段均显著(P<0.05)高于荷叶白,结果表明叶片中3种促植物生长激素的水平降低与桑树叶片的衰老过程密切相关。
2.2 外源激素及抑制剂对桑树叶片内源激素水平的影响
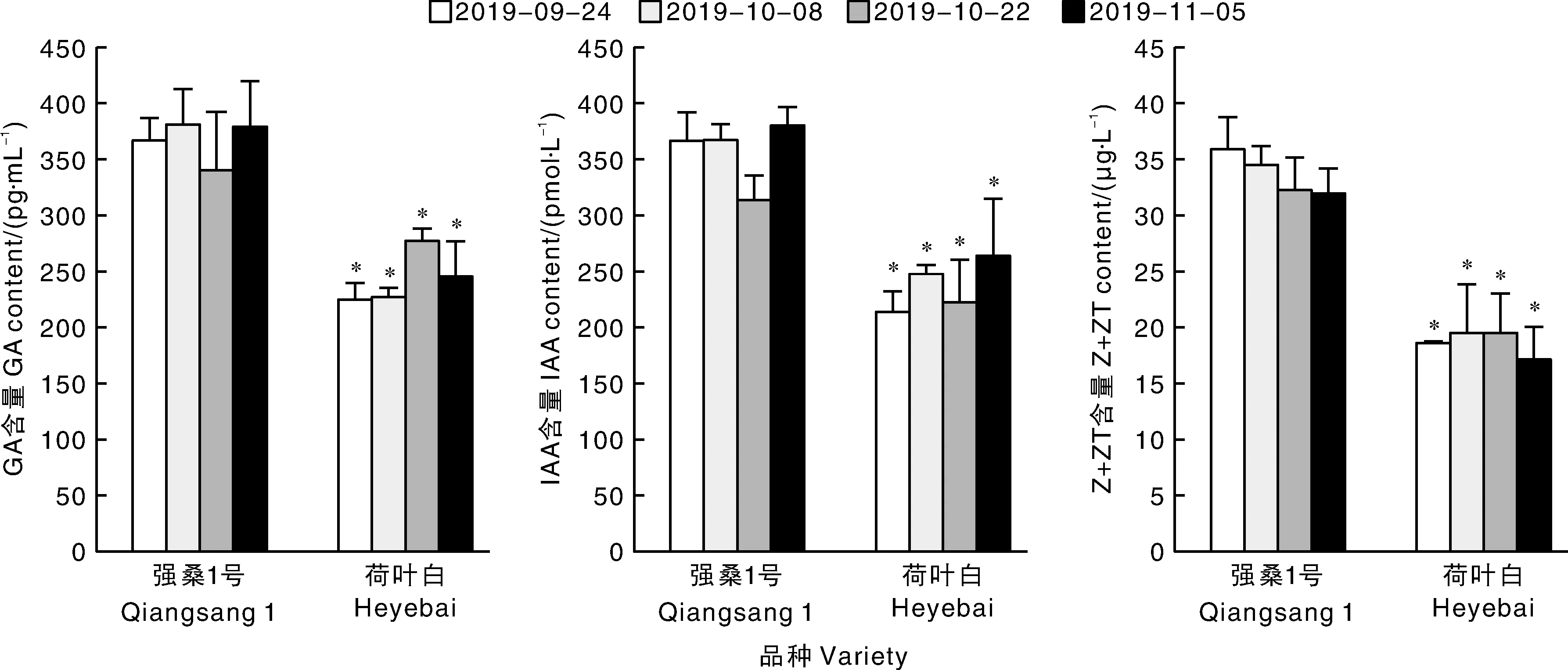
外源激素及抑制剂对桑树叶片内源激素水平的影响,结果见图2。由图2可以看出,分别经外源激素2, 4-D、6-BA 和GA3处理之后,2个品种同时间节点叶片中的 IAA、CTK和GA含量均较对照组显著增加(P<0.05);而经抑制剂TIBA、LOV和CCC处理后,2个品种同时间节点叶片中IAA、CTK和GA含量较对照组显著下降(10月22日强桑1号,对照与TIBA、CCC处理无显著差异);同时发现,经过外源激素与抑制剂处理,在各时间节点强桑1号叶片中IAA、CTK和GA依旧显著(P<0.05)高于荷叶白。该结果证实,通过外源促生长类激素能够诱导桑树叶片内源促生长类激素含量的增加,而外源抑制剂能够抑制叶片内源促生长类激素的合成。
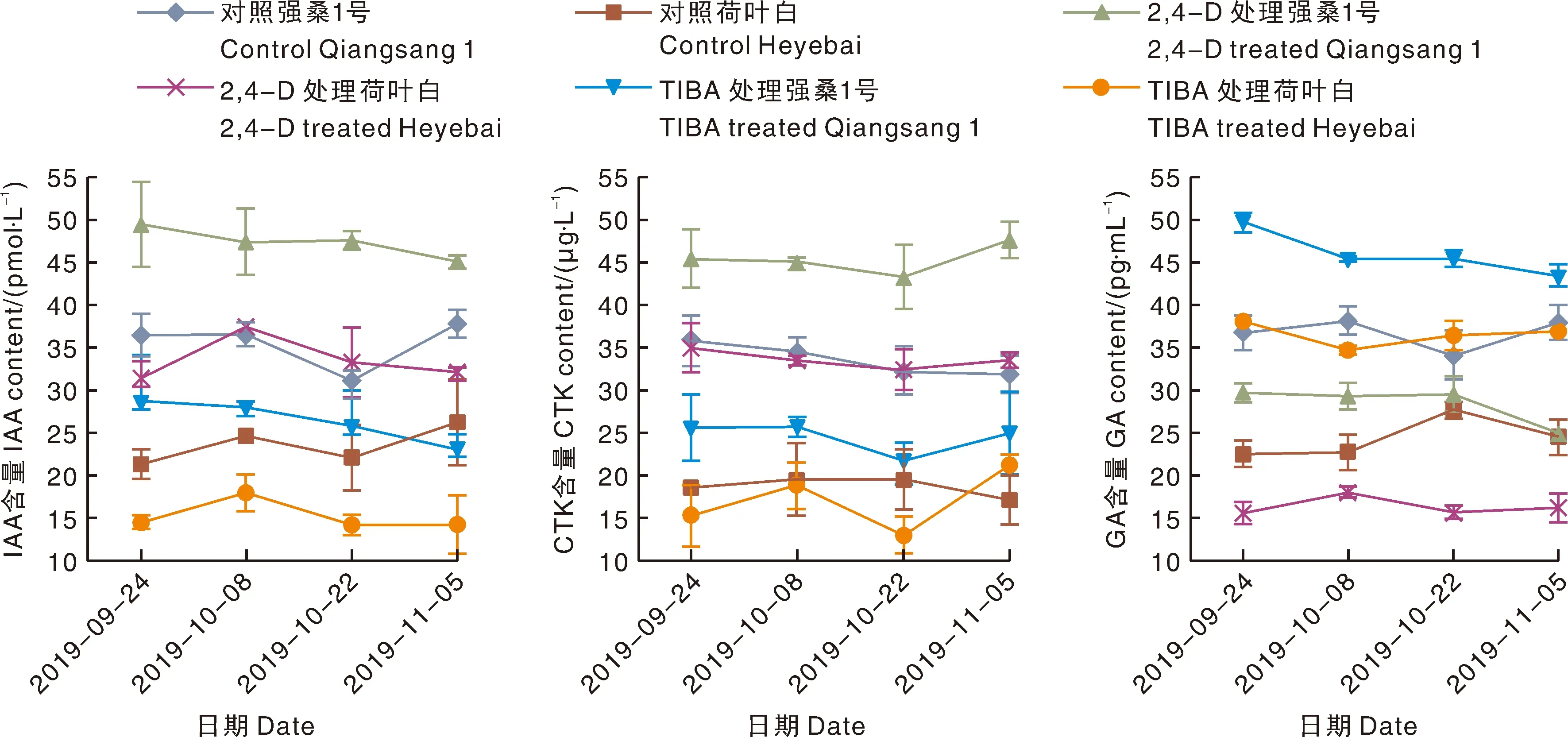
图2 外源激素及其抑制剂对桑树叶片内源激素水平的影响Fig.2 Effects of exogenous hormones and their inhibitors on endogenous hormones in mulberry leaves

图3 外源激素及其抑制剂对桑树叶片抗氧化酶活性的影响Fig.3 Effects of exogenous hormones and their inhibitors on antioxidant enzyme activities in mulberry leaves
2.3 外源激素及抑制剂对桑树叶片抗氧化酶活性的影响
外源激素及抑制剂对桑树叶片抗氧化酶(CAT、POD及 SOD)活性的影响,结果见图 3。由图 3可以看出,在发育过程中,对照组强桑1号叶片中抗氧化酶CAT、POD及SOD活性显著高于对照组荷叶白(P<0.05)。经过外源激素2, 4-D、6-BA 和GA3处理之后,2个品种同时间节点叶片中抗氧化酶CAT、POD及 SOD活性较对照组相比均显著提升(P<0.05),且处理后强桑1号叶片中抗氧化酶CAT、POD及SOD活性仍然在绝大多数时间节点显著(P<0.05)高于处理后荷叶白。
3种抑制剂 TIBA、LOV和CCC处理对2个品种叶片中CAT、POD及 SOD活性影响存在很大差异。强桑1号叶片中CAT活性在LOV和CCC
“*”表示与强桑1号中同时期指标相比差异显著(P<0.05)。“*” represents significant differences at P<0.05.图1 桑树叶片发育4个不同时期促生长类植物激素的变化Fig.1 Changes in contents of plant growth hormone in mulberry leaves at differential stages
处理后显著升高(P<0.05),TIBA处理后活性无显著性变化;荷叶白经TIBA、LOV和CCC处理后叶片中CAT 活性先增后降,其中LOV和CCC处理的中后期3个时间节点差异显著(P<0.05)。强桑1号叶片中POD活性在TIBA和LOV处理后较对照组变化不显著,而经CCC处理后叶片中POD活性显著增高(P<0.05);荷叶白叶片POD活性在TIBA、LOV和CCC处理后较对照组升高,其中TIBA与CCC处理后各时间节点均显著高于对照组(P<0.05)。同时发现,TIBA与LOV处理对2个品种叶片中SOD活性无显著影响,而CCC处理后2个品种叶片中SOD活性高于对照组(P<0.05)。
2.4 外源激素及抑制剂对桑树叶片MDA积累的影响
外源激素及抑制剂对桑树叶片中MDA积累的影响,结果见图4。由图4结果可以看出,随着衰老进程的推进,对照组的强桑1号叶片中MDA含量先减后增,而对照组的荷叶白叶片中MDA含量先增后减,中期2个时间节点强桑1号叶片中MDA含量显著低于荷叶白(P<0.05);与对照组相比,经外源促生长类激素2, 4-D、6-BA和GA3处理后,2个桑树品种叶片中 MDA 含量均显著降低(P<0.05);经LOV处理后,2个品种叶片中MDA含量显著高于对照组(P<0.05);而经CCC处理后,强桑1号叶片中MDA含量高于对照组但差异不显著,而荷叶白3个时间节点显著高于对照(P<0.05)。
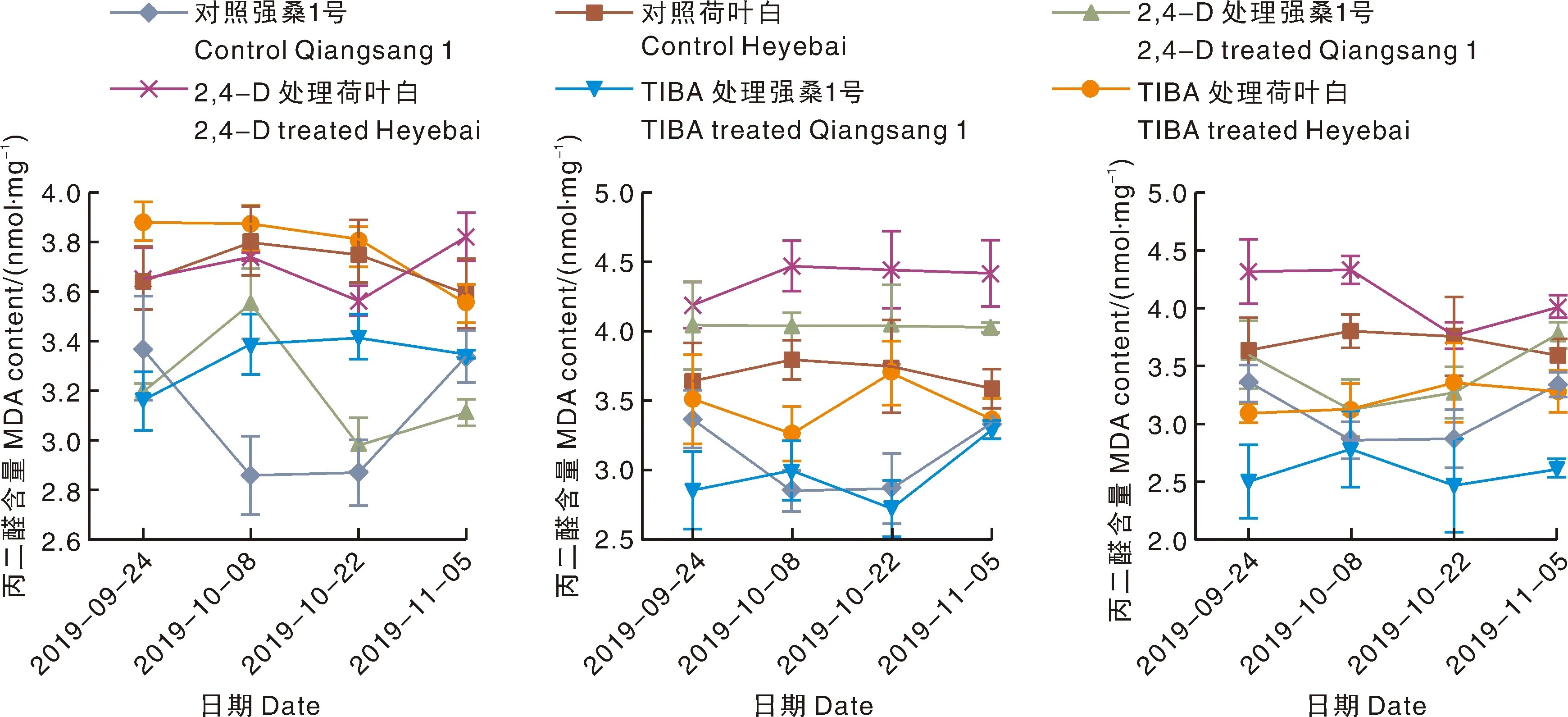
图4 外源激素及其抑制剂对桑树叶片MDA 含量的影响Fig.4 Effects of exogenous hormones and their inhibitors on MDA content in mulberry leaves

图5 外源激素及其抑制剂对桑树叶片 SP 和 Pro 含量的影响Fig.5 Effects of exogenous hormones and their inhibitors on SP content and Pro content in mulberry leaves
2.5 外源激素及抑制剂对桑树叶片 SP 和 Pro 含量的影响
外源激素及抑制剂对桑树叶片SP 和 Pro 含量的影响,结果见图 5。由图 5 结果可以看出:与对照组相比,经外源促生长类激素 2, 4-D、6-BA 和GA3处理后,2桑树品种叶片中 SP 含量均显著增加(P<0.05)(除2,4-D处理荷叶白在 10-22与对照组荷叶白无显著差异);而经过抑制剂 LOV处理后,2桑树品种叶片中各阶段 SP 含量较对照组无显著性差异;经过抑制剂 TIBA和CCC处理后,荷叶白4个阶段叶片较对照无显著性差异。
与对照组相比,经外源促生长类激素 6-BA 和GA3处理后,2个桑树品种叶片中Pro含量均显著增加(P<0.05);经2, 4-D处理后,前2个时间节点2个品种叶片中Pro含量显著高于对照组(P<0.05),后2个时间节点2个品种叶片中Pro含量与对照组不存在显著性差异。经过抑制剂CCC处理后,2个桑树品种叶片中Pro含量显著高于对照组(P<0.05)。
3 讨论
叶片衰老是叶片生长发育进程中的最后阶段,植物叶片的提前衰老往往影响作物的产量。大量研究表明,植物激素与叶片衰老有着密切的关系,通过调控抗氧化酶活性、活性氧伤害及渗透调节物质含量来调控叶片的衰老过程[6-7]。
本研究发现,硬化早的桑树叶片中IAA、CTK和GA含量要显著低于硬化晚的桑树品种,表明促生长植物激素IAA、CTK和GA含量与桑叶硬化衰老密切相关,同时发现经外源激素刺激后,三者在叶片中含量显著增加,而经抑制剂处理后含量显著降低。很多文献报道,IAA、CTK和GA能够促进细胞分裂、延缓器官衰老,且含量在品种间差异显著,在早衰品种中含量相对较低,与植物衰老存在密切关系[8-9]。
研究表明,组织细胞产生的活性氧未得到及时清除是造成衰老的重要原因;而机体内抗氧化酶活性机体活性氧清除方面发挥着至关重要的作用,因此,抗氧化酶活性与叶片衰老进程密切相关,可以用作叶片衰老的重要判定指标[1,10-11]。
本研究发现,经外源促生长类激素处理后,2个桑树品种叶片中CAT、POD及SOD活性均显著提升;经抑制处理后,叶片中CAT、POD及SOD在不同品种表现出了不同的活性变化差异。有研究发现,甜瓜叶片中SOD活性在6-BA与GA3处理后显著上升;另外,SOD和POD活性被发现在2,4-D处理绿豆叶片中显著提升[12-13]。任吉君等[14]报道,通过 CCC 处理可以显著提高琉璃苣叶片中SOD 和 POD 活性。
在植物衰老生理和抗性生理研究中,MDA含量是一个常用指标[15]。Yu等[16]研究证实,成熟树叶中 MDA 含量显著高于嫩叶;而Xu等[4]研究发现,较对照组相比,经促生长类激素 GA3、IAA及Trans-zeatin 处理后,水稻叶片中MDA 含量显著下降。本研究发现,在发育过程中,硬化早荷叶白叶片中MDA 含量显著高于硬化迟的强桑1号;同时,经外源促生长激素处理后,2个品种叶片中的 MDA 含量均呈现下降趋势,而抑制剂处理后则含量显著上升。因此,桑叶中促生长类激素 IAA、CTK和GA在减少 MDA 积累和延缓叶片衰老方面起到重要的作用。
可溶性蛋白和脯氨酸都是植物体内重要的渗透调节物质,他们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用,因此,经常用作筛选抗性的指标之一。本研究发现,外源促生长类激素处理后桑树叶片中SP和Pro含量增加,而外源抑制剂处理后SP和Pro含量不变。其中,CCC处理后,2个品种叶片中SP和Pro含量均升高,其中Pro含量升高显著,类似结果在CCC处理油莎豆叶片中报道过[17]。
综上所述,桑树叶片内源促生长类激素水平高低与叶片衰老迟早密切相关。外源促生长类激素能够显著提升内源促生长类激素的含量,可以通过提升叶片抗氧化酶活性、减轻膜脂过氧化损伤及渗透调节物质含量来实现叶片衰老的延迟。外源抑制剂能够显著降低叶片内源促生长类激素的含量,但对于抗氧化酶活性、膜脂过氧化反应及渗透调节物质含量的调控作用因抑制剂种类与桑树品种不同而存在差异。
