3-亚烯基环戊烯类衍生物的合成
2023-08-06冯上体王子才王云青王程宇
*冯上体 王子才 王云青 王程宇*
(1.山东省临沂市三丰化工有限公司 山东 276034 2.临沂市恒泰安全科技有限公司 山东 276034 3.临沂大学 化学化工学院 山东 276005)
1.引言
亚烯基环戊烯类衍生物是一类重要的有机化合物,是许多天然产物、药物分子的核心骨架,具有广泛的生理药理作用[1-2]。另外3-亚烯基环戊烯类衍生物因其分子内含有共轭双键,可作为有机合成中间体,便于进一步衍生化,便于相关药物分子、天然产物和功能材料的合成与修饰等,具有重要的现实意义[3-4]。目前,关于该类结构的高效构建方法较少,主要是围绕联烯/炔底物的分子间、分子内串联环化反应得到[5-9]。上述报道的合成方法中,存在的主要问题是:(1)反应底物多为联烯/炔,原料不易获得,需要多步合成实现且稳定性较差。(2)需要当量以上的氧化剂,反应后处理相对复杂,对环境不友好。(3)有些反应的反应时间过长,需要长达36h。(4)反应的收率及普适性有待进一步提高。(5)部分反应的反应条件较为较为苛刻,反应温度较高,不便于实际应用。因此,上述合成方法从成本和环保的角度考虑具有一定的局限性。另外,这些方法难以直接构建3-亚烯基环戊烯类化合物,特别是难以在5-位引入可以进一步衍生化的氨甲酰基甲基基团。基于此,我们尝试对3-亚烯基环戊烯类骨架的构建方法展开了系列研究,研究了3-亚烯基环戊烯类化合物骨架的合成方法,发展了一种以烯炔胺、炔丙醇为原料,金/银共催化下,DCE为反应溶剂合成五取代衍生物的方法。同时,优化了反应条件,并进行了反应底物的普适性选择;该方法具有反应条件温和、反应普适性较广(43%~69%),具有较强的官能团容忍性,使产物5-位含氨甲酰基甲基基团,从而便于进一步衍生化的特点。本文共合成了12种新型的五取代3-亚烯基环戊烯衍生物,产物均经过1H NMR,13C NMR和HR-MS(ESI)表征。
2.实验部分
(1)仪器和试剂
主要仪器与试剂见表1和表2。

表2 实验试剂
(2)3-亚烯基环戊烯化合物3a-3l的合成
在手套箱中称取10% PPh3AuCl(0.03mmol,14.9mg)和10% AgOTf(0.03mmol,7.7mg)放入15mL反应瓶中,用橡胶塞密封。用真空油泵将反应瓶抽真空,然后通入氮气球,保持反应体系处于氮气氛围下。称取反应原料烯炔胺底物1a(0.3mmol,75mg)、2a(0.3mmol,62.4mg)放于2mL样品瓶中,加入2mL DCE使之溶解。用一次性塑料注射器吸取上述混合液注入反应瓶中,室温下反应4~6h(TLC检测,原料消失即可处理反应)。反应结束后,将反应液倾入100mL茄形瓶中,用少量乙酸乙酯洗涤反应瓶,使用旋转蒸发仪蒸去溶剂,加入硅胶,干法上样柱层析,以乙酸乙酯与石油醚混合溶剂为淋洗剂,柱层析得到3a,收率52%,黄色油状液体。用类似方法合成3b-3l。
3.结果与讨论
(1)反应条件优化
该方法以烯炔胺底物1a、炔丙醇底物2a为模板原料,对反应条件进行了优化,如图1所示。反应以10mol% PPh3AuCl/10mol% AgOTf为催化剂,固定反应底物摩尔比1a:2a=1:1,筛选了常用的反应溶剂,包括DCE(1,2-二氯乙烷)、toluene(甲苯)、DCM(二氯甲烷)、THF(四氢呋喃)等,反应效果以DCE为最佳溶剂(Entry 1~Entry 4)。随后继续研究了反应底物摩尔比的变化对于反应效果的影响。固定10mol%PPh3AuCl/10mol% AgOTf为催化剂,DCE为反应溶剂,当反应底物摩尔比1a:2a=1.1:1时,反应收率为53%,反应效果影响不大(Entry 5)。当反应底物摩尔比1a:2a=1:1.2时,反应收率为45%,反应收率稍有下降(Entry 6)。因此,经过一系列的反应条件优化,确定最佳的反应条件为:10mol% PPh3AuCl/10mol%AgOTf为催化剂,DCE为反应溶剂,反应底物摩尔比为1a:2a=1:1,室温下反应。该反应的优势在于原料合成较为简便且具有较好的稳定性;该反应室温即可发生,反应条件较为温和;产物5-位含酰胺骨架,便于进一步衍生化,譬如还原成胺类化合物、转化为其他羧酸衍生物等。
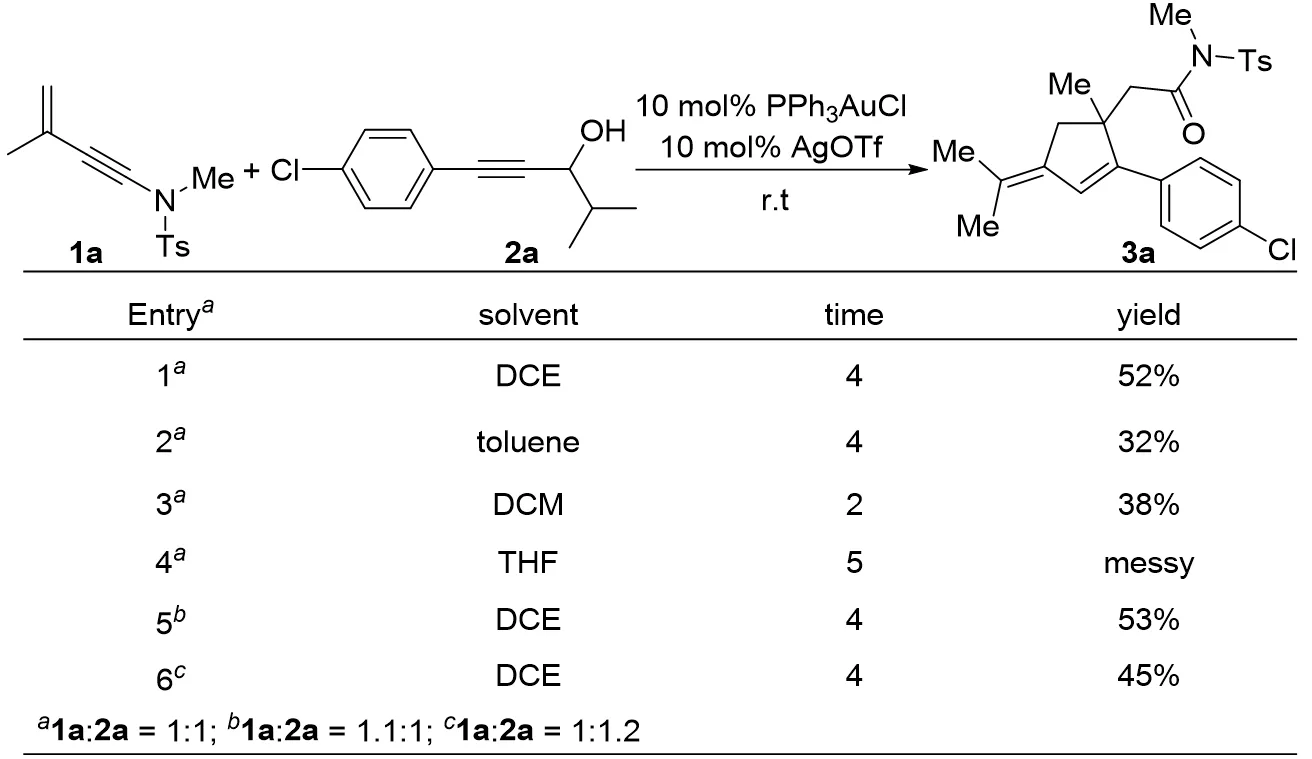
图1 Scheme 1反应条件优化
(2)反应底物的普适性选择
我们合成了一系列不同取代类型的烯炔胺底物1、炔丙醇底物2,在上述优化的最佳反应条件下,进一步考察了反应底物的普适性,结果如图2所示。对于炔丙醇底物2中芳基取代基的电性,包括吸电子基的4-Cl、4-Br、4-NO2、4-COOMe及给电子基团4-Me、4-OCH3、4-菲基等,对于反应效率影响不大,反应均能顺利发生,能以43%~64%的收率得到相应产物(3a~3h)。对于烷基取代的炔丙醇参与反应,也能以45%的收率得到目标产物(3i)。变换R1取代基为苄基、环丙基,R2取代基为Ms基团等,反应均能顺利发生,能以56%~69%收率得到相应产物。

图2 Scheme 2反应底物普适性探究
(3)1H NMR,13C NMR和HR-MS(ESI)表征
3a,黄色油状液体,1H NMR(400MHz,CDCl3):δ7.75(d,J=8.2Hz,2H),6.39-6.44(m,6H),6.60(s,1H),3.42(s,3H),3.23(d,J=17.2Hz,1H),2.95(d,J=17.2Hz,2H),2.64-2.68(m,4H),1.97(s,3H),1.87(s,3H),1.50(s,3H);13C NMR(100MHz,CDCl3):δ171.2,151.0,144.6,136.3,136.1,135.7,132.6,129.7,129.1,128.7,128.2,126.9,123.5,48.2,44.7,44.2,32.8,27.1,21.5,21.2,20.6;HRMS(ESI,m/z)calcd.for C25H28ClNNaO3S[M+Na]+calc.:480.1376;found:480.1362.
3b,黄色油状液体,1H NMR(400MHz,CDCl3):δ7.48(d,J=8.2Hz,2H),7.30(d,J=8.4Hz,2H),7.18(d,J=8.2Hz,2H),7.05(d,J=8.4Hz,2H),3.15(s,3H),2.95(d,J=17.2Hz,1H),2.68(d,J=17.2,2H),2.37-2.41(m,4H),1.71(s,3H),1.60(s,3H),1.22(s,3H);13C NMR(100MHz,CDCl3):δ171.3,151.0,144.7,136.4,136.2,136.2,131.2,129.9,129.2,129.1,127.0,123.7,120.8,48.3,44.8,44.3,32.9,27.2,21.6,21.3,20.7;HRMS(ES I,m/z)calcd.for C25H28BrNNaO3S[M+Na]+calc.:524.0 871;found:524.0864.
3c,棕色液体,1H NMR(400MHz,CDCl3):δ8.00(d,J=8.9Hz,2H),7.55(d,J=8.4Hz,2H),7.37(d,J=9.0Hz,2H),7.21(d,J=8.1Hz,2H),6.59(s,1H),3.10-3.14(m,4H),2.78(d,J=17.2Hz,1H),2.72(d,J=16.0Hz,1H),2.36-2.43(m,4H),1.77(s,3H),1.64(s,3H),1.32(s,3H);13C NMR(100MHz,CDCl3):δ170.9,149.5,146.1,144.9,143.9,136.2,136.0,131.7,129.8,127.4,126.9,126.5,123.3,48.2,44.6,44.5,32.8,27.5,21.4,21.4,20.7;HRMS(ESI,m/z)calcd.for C25H29N2O5S[M+H]+calc.:469.1797;found:469.1784.
3d,淡黄色液体,1H NMR(400MHz,CDCl3):δ7.86-7.88(m,2H),7.53(d,J=8.4Hz,2H),7.29-7.31(m,2H),7.20(d,J=8.0Hz,2H),6.52(s,1H),3.89(s,3H),3.18(s,3H),3.07(d,J=17.2Hz,1H),2.71-2.79(m,2H),2.4 5(d,J=16.0Hz,1H),2.40(s,3H),1.77(s,3H),1.66(s,3H),1.32(s,3H);13C NMR(100MHz,CDCl3):δ171.2,166.8,150.9,144.7,141.9,136.4,136.2,130.1,129.8,129.4,128.2,127.0,126.9,124.7,51.9,48.2,44.7,44.5,32.8,27.3,21.5,21.3,20.7;HRMS(ESI,m/z)calcd.for C27H32NO5S[M+H]+calc.:482.2001;found:482.1996.
3e,淡黄色液体,1H NMR(400MHz,CDCl3):δ7.55(d,J=8.2Hz,2H),7.20-7.27(m,7H),6.39(s,1H),3.21(s,3H),3.07(d,J=17.1Hz,1H),2.74(d,J=17.0Hz,1H),2.72(d,J=15.7Hz,1H),2.48(d,J=16.2Hz,1H),2.40(s,3H),1.77(s,3H),1.67(s,3H),1.31(s,3H);13C NMR(100MHz,CDCl3):δ171.5,152.6,144.5,137.3,136.5,136.4,129.8,128.6,128.1,127.5,127.1,126.9,122.8,48.4,44.9,44.3,32.9,26.9,21.5,21.2,20.6;HRMS(ESI,m/z)calcd.for C25H29NNaO3S[M+Na]+calc.:446.1766;found:446.1759.
3f,棕色液体,1H NMR(400MHz,CDCl3):δ7.57-7.59(m,2H),7.16-7.22(m,4H),7.08(d,J=7.9Hz,2H),6.38(s,1H),3.22(s,3H),3.07(d,J=17.1Hz,1H),2.68-2.77(m,2H),2.46(d,J=16.2Hz,1H),2.41(s,3H),2.35(s,3H),1.77(s,3H),1.66(s,3H),1.31(s,3H);13C NMR(100MHz,CDCl3):δ171.6,152.5,144.5,136.6,136.5,136.4,134.2,129.7,128.8,128.0,127.4,127.1,122.4,48.3,44.9,44.3,32.9,26.9,21.5,21.2,21.1,20.6;HRMS(ESI,m/z)calcd.for C26H31NNaO3S[M+Na]+calc.:460.1922;found:460.1910.
3g,淡黄色液体,1H NMR(400MHz,CDCl3):δ7.55-7.57(m,2H),7.20-7.23(m,4H),6.79-6.82(m,2H),6.33(s,1H),3.80(s,3H),3.21(s,3H),3.06(d,J=17.0Hz,1H),2.68-2.75(m,2H),2.40-2.47(m,4H),1.76(s,3H),1.65(s,3H),1.30(s,3H);13C NMR(100MHz,CDCl3):δ171.6,158.7,152.2,144.5,136.5,136.4,129.8,1 29.7,128.6,127.6,127.1,122.1,113.5,55.2,48.3,44.9,44.3,32.9,26.9,21.5,21.1,20.6;HRMS(ESI,m/z)calcd.for C26H31NNaO4S[M+H]+calc.:476.1872;found:476.1858.
3h,白色固体;mp:125℃;1H NMR(400MHz,CDCl3):δ8.74-8.78(m,2H),8.07(d,J=8.1Hz,1H),7.84(d,J=7.8Hz,1H),7.67-7.71(m,2H),7.59-7.64(m,2H),7.46(s,1H),7.04(d,J=7.9Hz,2H),6.6(d,J=8.2Hz,2H),6.38(s,1H),3.26(s,3H),2.99(d,J=16.7Hz,1H),2.89(d,J=17.2Hz,1H),2.63-2.74(m,2H),2.02(s,3H),1.79(s,3H),1.77(s,3H),1.07(s,3H);13C NMR(100MHz,CDCl3):δ171.6,150.0,144.1,137.0,136.3,133.6,132.0,131.7,131.1,130.3,129.8,129.3,128.7,127.4,126.9,126.8,126.6,126.5,126.5,126.4,122.6,122.5,122.3,50.3,45.3,43.0,32.8,25.7,21.2,21.1,20.7;HRMS(ESI,m/z)calcd.for C33H34NO3S[M+H]+calc.:524.2259;found:524.2248.
3i,淡黄色液体,1H NMR(400MHz,CDCl3):δ7.72(d,J=7.72Hz,2H),7.31(d,J=8.1Hz,2H),5.95(s,1H),3.25(s,3H),2.95(d,J=16.6Hz,1H),2.47-2.54(m,2H),2.42(s,3H),2.28(d,J=16.8Hz,1H),1.87-1.91(m,2H),1.69(s,3H),1.57(s,3H),1.44-1.48(m,2H),1.30-1.35(m,2H),1.05(s,3H),0.90(t,J=7.3Hz,3H);13C NMR(100MHz,CDCl3):δ171.8,154.8,144.7,136.7,129.9,127.4,127.2,124.0,118.9,48.2,44.6,42.8,33.0,30.2,26.7,25.6,22.8,21.6,21.0,20.5,14.0;HRMS(ESI,m/z)calcd.for C23H34NO3S[M+H]+calc.:404.2259;found:409.2253.
3j,黄色液体,1H NMR(400MHz,CDCl3):δ7.38-7.40(m,2H),7.24-7.30(m,8H),7.18-7.21(m,2H),7.13(d,J=8.04Hz,2H),6.40(s,1H),5.08(s,2H),3.00(d,J=17.1Hz,1H),2.72(d,J=16.2Hz,1H),2.64(d,J=17.1Hz,1H),2.47(d,J=16.2Hz,1H),2.39(s,3H),1.79(s,3H),1.67(s,3H),1.28(s,3H);13C NMR(100MHz,CDCl3):δ171.3,152.4,144.4,137.1,136.9,136.7,136.4,129.5,128.5,128.5,128.1,127.8,127.5,127.5,127.4,126.8,122.8,48.8,48.4,44.6,44.3,26.7,21.5,21.2,20.6;HRMS(ESI,m/z)calcd.for C31H34NO3S[M+H]+calc.:500.2259;found:500.2247.
3k,黄色液体,1H NMR(400MHz,CDCl3):δ7.69(d,J=8.3Hz,2H),7.15-7.25(m,8H),6.34(s,1H),2.99(d,J=16.3Hz,1H),2.63-2.69(m,2H),2.44-2.45(m,1H),2.30-2.36(m,4H),1.70(s,3H),1.58(s,3H),1.24(s,3H),0.85-0.87(m,2H),0.67-0.68(m,2H);13C NMR(100MHz,CDCl3):δ173.7,152.2,144.2,137.0,136.7,136.3,129.3,128.6,128.1,128.0,127.4,126.9,122.9,48.7,45.4,44.0,28.2,26.8,21.5,21.1,20.6,9.8,9.8;HRMS(ESI,m/z)calcd.for C27H32NO3S[M+H]+calc.:450.2103;found:450.2101.
3l,黄色液体,1H NMR(400MHz,CDCl3):δ7.37-7.39(m,2H),7.30-7.34(m,2H),7.26-7.27(m,1H),6.50(s,1H),3.15(s,3H),3.07(s,3H),2.94(d,J=16.8Hz,2H),2.74(d,J=16.8Hz,1H),2.58(d,J=16.0Hz,1H),1.82(s,3H),1.73(s,3H),1.49(s,3H);13C NMR(100MHz,CDCl3):δ172.2,151.7,137.1,136.1,129.0,128.2,127.3,127.1,123.3,48.3,44.4,44.2,41.2,32.4,27.4,21.3,20.6;HRMS(ESI,m/z)calcd.for C19H26NO3S[M+H]+calc.:348.1633;found:348.1624.
4.小结
本文发展了一种合成多取代3-亚烯基环戊烯类衍生物的方法,以烯炔胺底物1、炔丙醇底物2为原料,以10% PPh3AuCl和10% AgOTf为催化剂,DCE为反应溶剂,经过多步串联环化反应,“一锅法”合成了12种新型的五取代3-亚烯基环戊烯类化合物,收率43%~69%。该方法反应条件温和,反应普适性广,具有较强的官能团容忍性,且产物5-位含氨甲酰基甲基基团,便于进一步衍生化。
