外施水杨酸诱导烟草苗期对低温胁迫耐寒性的最适浓度筛选
2023-08-05董环宇金铭路任昭辉李俊明朴世领
金 哲, 董环宇, 金铭路, 任昭辉, 苏 亮, 李俊明, 朴世领*
(1.吉林省烟草公司延边州公司;2.延边大学农学院:吉林 延吉 133002;3.吉林烟草工业有限责任公司技术中心,长春 130033)
低温胁迫是影响植物生长发育及作物产量最主要的逆境胁迫之一,会导致产量降低,严重时甚至导致植株死亡[1]。水杨酸(Salicylic acid, SA)是一种小分子酚类化合物,广泛存在于植物体内,逆境条件下,可使植物保持较高的抗氧化酶活性,增强其抗氧化能力[2],从而增强植物的耐寒力。相关研究表明,SA可增强植物在低温胁迫下细胞膜稳定性和抗氧化酶活性,抑制丙二醛和活性氧积累,增强渗透调节物质的含量,缓解低温胁迫对植物造成的损伤[3-4]。以往的研究已经证实了水杨酸对植物耐寒性的显著作用,但有关东北地区在低温胁迫下施加外源水杨酸对烤烟生理特性的影响鲜有报道。该研究对烟草苗期叶面喷施4个梯度的外源水杨酸处理,对与耐寒性相关的生理指标进行主成分分析,筛选出外源水杨酸的最佳施用浓度,为后续研究烟草低温胁迫的机理和在生产上缓解低温胁迫对烟草的不利影响提供理论依据。
1 材料与方法
1.1 材料
以课题组前期工作筛选出的低温敏感型品种NC82为试材,所需的种子材料由吉林省延边朝鲜族自治州农科院烟草研究所提供,外源水杨酸购于北京索莱宝科技有限公司。
1.2 试验设计
1) 种子预处理及育苗 试验所需种子播种前用浓度为1%无水硫酸铜消毒15 min,之后用清水浸种24 h,然后用播种于540 mm×280 mm的装有基质(腐殖质、草炭土、细纱为10∶10∶1)的72孔简塑盘中,在温室内育苗,3叶龄时选择壮苗假植至32孔简塑料盘(540 mm×275 mm)。
2) 低温胁迫及不同浓度水杨酸处理 苗期达到5~6叶龄时,连续3 d每天上午9:00用不同浓度SA进行叶面喷施处理1次,SA浓度梯度分别为0.5(T1)、1(T2)、1.5(T3)、2.0(T4) mmol/L,每株喷施量相同,约为1.5~2 mL。叶面喷施后24 h放于人工气候箱中进行11 ℃低温光照培养。常温对照(CK)叶面喷水后在人工气候箱中25 ℃培养,低温对照(CK0)叶面喷水后先在气候箱中25 ℃培养3 d后再进行11 ℃低温处理,气候箱白天光照度设置为100~560 μmol/(m2·s),光照时数12 h,相对湿度80%。于0、2、6、8 d选取长势一致烤烟幼苗进行取样,每个处理3次重复,并放于-70 ℃超低温冰箱保存。
1.3 测定项目与方法
1) 干物质积累量和根系活力的测定 采用常压干燥法进行测定[6]。对烟株去泥洗净后测定鲜重,后置入设定在100~105 ℃的电热鼓风干燥箱(101-1A型)中完成干燥过程。连续烘干至3次恒重,冷却结束后,测定其质量,得到干重。根系活力参考TTC法进行测定[7]。
2) 抗氧化酶活性和脯氨酸含量的测定 SOD活性参考氮蓝四唑法进行测定[8];CAT活性参考分光光度法进行测定[9];POD活性参考愈创木酚测定法进行测定[10];脯氨酸含量参考茚三酮比色法进行测定[11]。
3) 叶绿素及活性氧代谢指标的测定 选取长势一致幼苗,由上至下第3片真叶采用SPAD-205叶绿素仪测定叶绿素含量。电导率采用ORION TDS型电导率仪进行测定,MDA含量参考硫代巴比妥酸法进行测定[12]。
1.4 数据统计及主成分分析
使用SPSS20和Microsoft Excel 2013软件统计分析试验数据及绘图。对4个梯度SA处理各生理生化指标数据进行单因素ANOVA检验。并采用8 d时各低温胁迫处理的生理生化指标为耐寒性评价的原始数据,对其进行主成分分析。
2 结果与分析
2.1 4个SA浓度处理低温胁迫后干物质和根系活力变化规律
不同浓度SA处理对干物质积累量的影响列于表1。与常温对照(CK)处理相比,各低温胁迫处理的干重随低温天数增加呈缓慢增长趋势,低温胁迫2~4 d时,各处理之间均无显著性差异(P>0.05);胁迫至8 d时,各低温胁迫处理均显著低于CK处理(P<0.05),外施水杨酸浓度T1(0.5 mmol/L)和T2(1 mmol/L)处理间无显著性差异,且均高于其余低温处理;与常温对照相比,T2和T1处理降幅均较小,分别为T2(-8.33%)和T1(-8.95%),其次为T3(-12.65%)和T4(-12.96%),下降幅度最大的是CK0(-13.27%);综合来看外施SA浓度为T2处理时表现最好,最接近CK处理,低温胁迫后仍能保持较高的干物质积累量。

表1 不同浓度SA处理对干物质积累量的影响
不同浓度SA处理对根系活力的影响见表2。
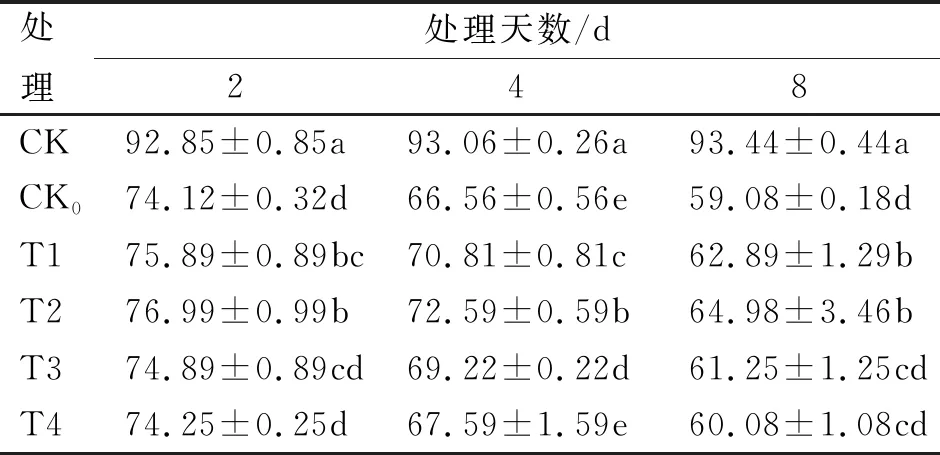
表2 不同浓度SA处理对根系活力的影响
低温胁迫后各低温胁迫处理根系活力均出现逐渐下降的变化规律,而常温对照(CK)处理呈平稳上升趋势,低温胁迫8 d时,T1与T2处理间无显著性差异(P>0.05),但均显著高于其余低温胁迫处理,大小顺序依次为CK、T2、T1、T3、T4和CK0,其中T2处理最接近CK处理,表现最好,而T4处理最接近低温对照CK0处理,表现最差;随胁迫天数的增加,与常温对照(CK)处理相比各低温胁迫处理根系活力的降幅均随低温持续时间的增加而增大,低温处理8 d时,各处理根系活力降幅均达到最大,其值自大到小分别是CK0(-36.77%)、T4(-35.70%)、T3(-34.45%)、T1(-32.69%)和T2(-30.46%),综合来看,预施1 mmol/L浓度的SA处理,可有效减缓根系活力下降程度,效果最好。
2.2 4个SA浓度处理低温胁迫后抗氧化酶活性和脯氨酸含量变化规律
不同浓度SA处理对POD活性的影响见表3。随低温处理天数的增加,常温对照(CK)处理POD活性呈平稳上升趋势,而各低温胁迫处理均为先升高后降低,处理阶段2~4 d,POD活性显著上升,并在4 d时达到最高,其值按大小顺序为,T2(88.21 U/g)、T1(87.29 U/g)、T3(83.25 U/g)、T4(81.92 U/g)、CK0(81.58 U/g)和CK(45.87 U/g),与常温对照相比,不同浓度SA处理POD活性增幅均在处理4 d时最高,其中,T2处理增幅最大,分别为T1、T3、T4和CK0的1.02、1.13、1.17和1.19倍;综合来看,低温胁迫前,外施1 mmol/L SA可最大程度地提高烟草苗期的POD活性。

表3 不同浓度SA处理对POD活性的影响
不同浓度SA处理后SOD活性变化(表4)均呈先升高后降低的趋势,而常温对照(CK)处理稳定上升,各处理受到11 ℃低温胁迫时,SOD活性迅速上升,在2 d时达到峰值,大小排序为T2(220.25 U/g)、T1(218.25 U/g)、T3(213.88 U/g)、T4(207.94 U/g)、CK0(199.32 U/g)和CK(90.62 U/g),T1与T2处理间无显著性差异,但均高于其余低温胁迫处理;低温处理2 d时,与CK处理相比各低温胁迫处理增幅迅速增加,并达到峰值,其增幅大小顺序及数值为T2(143.05%)、T1(140.84%)、T3(136.02%)、T4(129.46%)、CK0(119.95%),T1与T2浓度处理均高于其他浓度处理,但二者间无显著差异(P>0.05);综合来看,外施1 mmol/L SA可最大程度提高低温胁迫后烤烟苗期的SOD活性。
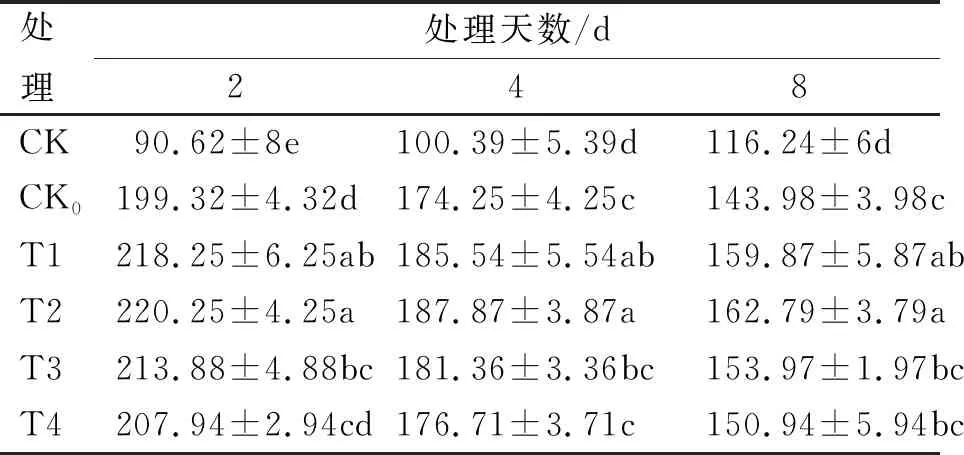
表4 不同浓度SA处理对SOD活性的影响
不同浓度SA处理后CAT活性变化(表5)与SOD活性变化基本一致。
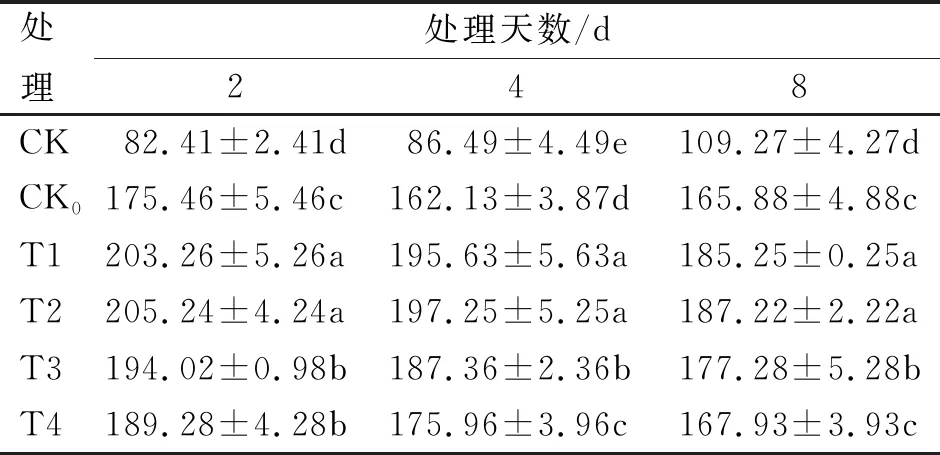
表5 不同浓度SA处理对CAT活性的影响
各低温胁迫处理均在2 d时CAT活性达到最高,分别为T2(205.24 μg/g)、T1(203.26 μg/g)、T3(194.02 μg/g)、T4(189.28 μg/g)和CK0(175.46 μg/g),之后开始下降,而常温对照(CK)呈平缓上升趋势,T1与T2处理间无显著性差异(P>0.05),且显著高于其余低温胁迫处理(P<0.05);与常温对照相比,低温处理2 d时,各低温胁迫处理增幅均达到最高,其中,T2处理增幅最大,分别较T1、T2、T4和CK0处理高2.41、13.62、19.37和36.14个百分点;因此,外施SA浓度为T2时,可最大程度地提高低温胁迫后烤烟苗期的CAT活性。
不同浓度SA处理对Pro含量的影响见表6。随低温持续天数增加,低温胁迫各处理均呈不断上升趋势,且显著高于常温对照(CK),CK处理则保持平稳上升趋势。低温处理至8 d时,各处理Pro含量最高,大小顺序依次为T2(7.09 μg/g)、T1(6.99 μg/g)、T3(6.62 μg/g)、T4(6.39 μg/g)、CK0(6.81 μg/g和CK(2.95 g/g),T2与T1无显著性差异(P>0.05),二者与其他4个处理均有显著性差异(P<0.05);与常温对照(CK)处理相比,各低温胁迫处理增长幅度均随低温持续时间的增加而增大,低温处理2 d时,各处理Pro含量增幅间差异不显著(P>0.05),低温处理8 d时,各处理Pro含量增幅均达到最大,其值从大到小分别是T2(140.34%)、T1(136.95%)、T3(124.41%)、T4(116.61%)、CK0(96.95%);综合来看,外施1 mmol/L SA处理,可有效增加Pro含量,且效果最好。
2.3 4个SA浓度处理低温胁迫后叶绿素含量和活性氧代谢指标变化规律
不同浓度SA处理对叶绿素含量的影响列于表7。随低温天数的增加,各低温胁迫处理的叶绿素含量与常温对照(CK)处理相比,均有不同程度的下降,胁迫至8 d时,各低温胁迫处理下降程度最明显,排序自大到小依次为,CK0(25.01 mg/g)、T4(25.61 mg/g)、T3(25.66 mg/g)、T1(26.54 mg/g)和T2(26.78 mg/g),其中T1与T2处理间无显著性差异(P<0.05),且均显著高于其余低温胁迫处理;胁迫8 d时,与CK处理相比各低温胁迫处理降幅均达到最大,按大小排序依次为CK0(-26.55%)、T4(-24.79%)、T3(-24.64%)、T1(-22.06%)、和T2(-21.35%);由此可见,施用适宜浓度的外源SA,可缓解低温胁迫下烟草苗期的叶绿素下降程度,其中,T2浓度处理表现最为优异。
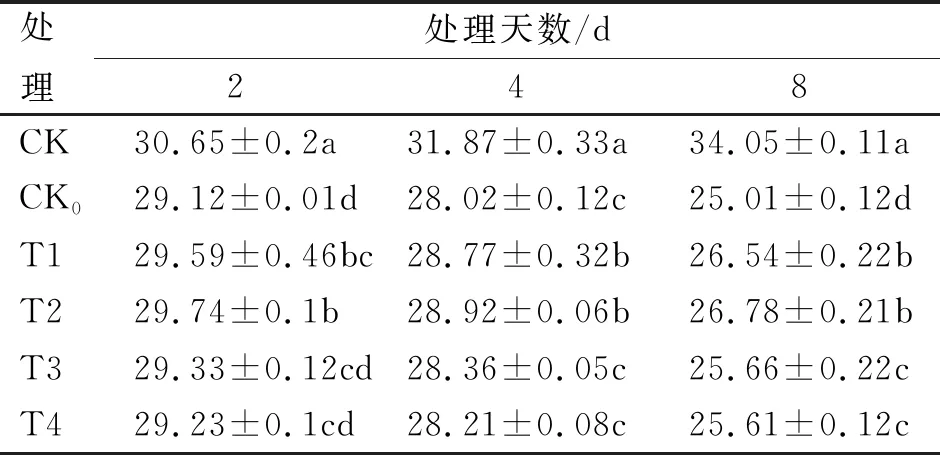
表7 不同浓度SA处理对叶绿素含量的影响
随低温胁迫天数的增加,各处理MDA含量(表8)均有不同程度的增加,在2~8 d时,MDA积累量均呈平稳上升趋势,常温对照(CK)始终趋于平缓趋势。处理8 d时,各处理MDA积累量均最高,按大小顺序排序为CK0(8.78 nmol/g)>T4(8.66 nmol/g)>T3(8.52 nmol/g)>T1(8.19 nmol/g)>T2(7.98 nmol/g),T1与T2处理在8 d时不存在显著性差异(P>0.05),但显著低于CK处理(P<0.05),随胁迫天数的增加,各低温胁迫处理与CK处理相比,MDA含量增幅逐渐上升,6~8 d时,增幅变化较明显,8 d时,MDA增长幅度最大,按积累量增幅排序为CK0(94.68%)、T4(92.02%)、T3(88.91%)、T1(81.60%)和T2(76.94%)。
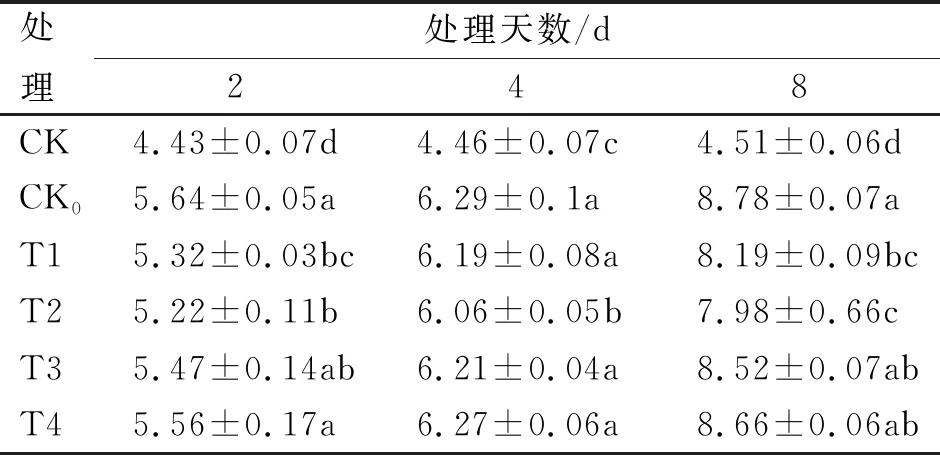
表8 不同浓度SA处理对MDA含量的影响
综合来看,11 ℃低温胁迫前,外施适宜浓度的SA处理,可有效减缓MDA积累量,其中,T2(1 mmol/L)浓度处理最佳,最接近CK处理。
不同浓度处理对电导率的影响见表9,各低温胁迫处理电导率与MDA积累量变化趋势基本一致,随低温胁迫天数不断增加,均呈急剧上升趋势,而常温对照(CK)处理呈缓慢上升趋势,各处理均于8 d时达到最大值,其中,T2与T1处理电导率均较低,分别为T2(41.88%)和T1(42.54%),2处理间无显著性差异(P<0.05),其中,T2浓度处理最接近CK,低温处理CK0表现最差(50.93%),T4(1 mmol/L)浓度处理与CK0最为接近;与常温对照相比,不同浓度SA处理相对电导率增幅均在处理8 d时最高,其中,T2和T1处理增幅均较小,分别为18.10%和19.97%,表现较好,而CK0处理最高,为43.63%,表现最差。因此,11 ℃低温胁迫前,预施适宜浓度的SA处理,可有效减缓电导率上升,其中,T2(1 mmol/L)浓度处理最佳,最接近CK处理。
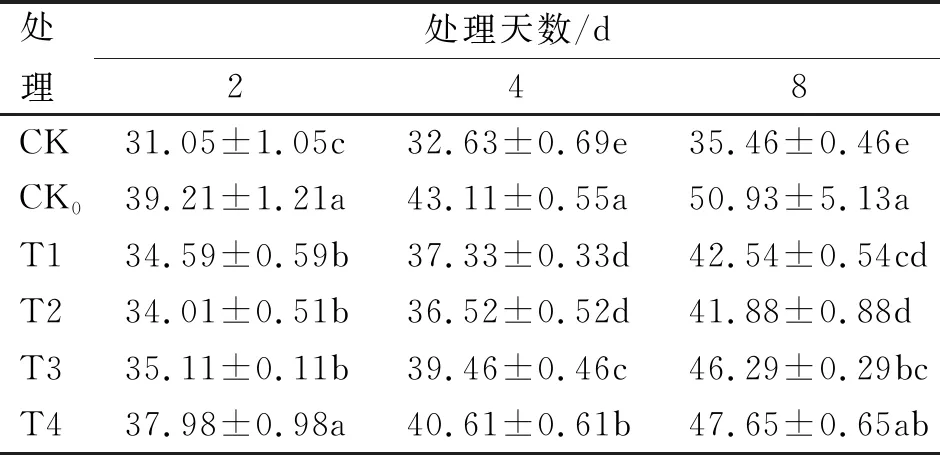
表9 不同浓度处理对电导率的影响
2.4 4个SA浓度处理低温胁迫后8 d时各指标耐寒性主成分分析
对不同浓度处理基于主成分分析的耐寒性综合排序结果见表10。

表10 不同浓度处理低温胁迫8 d时各生理指标主成分分析总得分及排序
外施SA浓度为1 mmol /L时,耐寒性最强,为3.59,0.5和1.5 mmol /L次之,分别为2.39和-0.64,外施2 mmol /L SA的耐寒性最低,为-1.85。
3 讨论与结论
低温胁迫会降低光合速率,影响水分吸收与运输,降低营养物质的积累进而降低植物的干物质积累量。该研究发现,外施1 mmol/L SA后,烤烟的干物质积累量在低温胁迫各个时期均高于低温对照处理(CK0),最接近于常温对照(CK),有效减缓低温胁迫后干物质积累量的下降幅度,这与许勇等[13]研究一致,这是由于外施水杨酸能通过调节抗氧化酶活性、丙二醛含量以及可溶性糖、脯氨酸等保护物质的合成,改变植物体内的碱基平衡状态,并刺激次生代谢过程[14]。
植物根系是活跃的吸收器官和合成器官,直接影响地上部的营养状况及产量水平,低温胁迫会抑制根系的生长,同时也会改变根的代谢和植物形态[15-16]。该试验发现,随低温胁迫天数的持续,烤烟幼苗生长受到抑制,而外施4个梯度的SA处理均能显著缓解低温胁迫的抑制作用,且1 mmol/L缓解效果最好,说明外施适宜浓度SA能够缓解低温胁迫对烤烟幼苗根系活力的影响,这与孙波等[17]人研究结果一致。
抗氧化酶(SOD、POD、CAT)在植物酶促防御机制中起到至关重要的作用,是植物抵御抗氧化的第1道防线[18-19]。SOD能够清除植物在逆境下产生的超氧阴离子自由基,POD是抗氧化系统的组成部分,可有效降低细胞膜脂过氧化,CAT的主要作用是清除植物代谢中产生的H2O2,避免H2O2过量积累而对细胞造成氧化破坏[20]。该试验结果表明,随着低温胁迫时间的延长,各低温胁迫处理抗氧化酶活性均呈先上升后下降的趋势,造成此现象的原因可能是低温胁迫前期烟株体内积累了大量的活性氧,消耗了大量抗氧化酶,导致后期酶活性降低,这与张中华等[21]研究结果一致。SA作为内源信号分子,能够刺激植物在遭遇逆境胁迫时启动生理生化反应,从而提高酶活性。试验结果发现,低温胁迫前外施1 mmol/L SA,烤烟幼苗的抗氧化酶活性均显著高于常温对照处理,说明外施适宜浓度SA可有效刺激酶活性,清除大量的活性氧,降低膜脂过氧化造成的损害,提高烟草耐寒力,这与张俊康等[22]研究结果一致。
低温胁迫下,植物体内的脯氨酸含量会迅速增加,这主要是因为低温会诱导脯氨酸合成酶的活性增强,促使脯氨酸生成;同时,低温也可能减慢脯氨酸降解速度,导致在细胞中积累[23]。该试验研究发现,外施4个梯度水杨酸处理均能够显著提高植物在低温胁迫下的脯氨酸含量,减轻低温胁迫对烤烟幼苗的损伤,其中,1 mmol/L效果最好,这与李美茹等[24]研究结果一致。这可能是因为水杨酸触发了植物中的信号传递系统,使得植物能更有效地适应和抵抗低温胁迫[25]。
前人研究发现[26],植物在遭遇低温胁迫时,会导致细胞内膜脂过氧化和活性氧自由基积累,细胞膜完整性遭到破坏,膜透性加大,诱导膜脂氧化产物MDA含量和相对电导率显著增加。该试验结果表明,11 ℃低温胁迫后,烤烟叶片的相对电导率和MDA含量迅速上升,表明低温对烤烟叶片稳定性和细胞膜结构产生了影响。外施1 mmol/L SA处理显著降低了MDA含量和相对电导率,削弱了细胞膜受损程度,缓解了低温胁迫对烤烟幼苗的损害,这与田丹青等[27]、韩浩章等[28]的研究结果一致。这是由于外施SA可以通过调节质膜中饱和及非饱和脂肪酸的比例来维持质膜稳定性,保持活性氧代谢系统平衡,进而降低膜脂过氧化造成的损害[29]。该试验发现,外施SA浓度过高或过低都不利于缓解低温胁迫对幼苗的损害,这可能是由于低浓度的SA不足以抵抗低温胁迫下自由基对细胞的损害,而高浓度SA又不利于SA蛋白与SA相结合,进而导致活性氧自由基的大量积累,这与王诗雅等[30]的研究结果一致。
低温胁迫导致叶绿素合成减少、降解速度加快,以及光合过程受损[31]。该试验发现,外施1 mmol/L外源SA显著提高了植物叶绿素含量,这主要是因为水杨酸可以抑制叶绿素分解酶的活性,降低叶绿素的降解速率;同时,它还可以通过调节内源激素水平,促进叶绿素的合成,这与马曙晓等[32]的研究结果一致。
主成分分析(PCA,Principal Component Analysis) 是一种常用的数据分析方法。其操作是通过线性转换(数据标准化处理),将数量众多的变量选出较少个数重要变量,这些变量能够概括原始信息的85%以上,并且可在此基础上进行综合分析[33-34]。外施水杨酸诱导烟草苗期对低温胁迫耐寒性的综合排序从大到小依次为1 mmol/L>0.5 mmol/L>1.5 mmol/L>2 mmol/L>低温对照(CK0)。
综上所述,外施水杨酸浓度为1 mmol/L时,能够显著提高低温敏感型品种(NC82)的耐寒力,缓解低温胁迫对烤烟幼苗造成的损害。
