LED 红光上调MAPK 信号促进炎性环境中人牙髓干细胞成骨/成牙本质分化
2023-08-03刘源惠以宁姜冰郑艮子王瑶
刘源,惠以宁,姜冰,郑艮子,王瑶
1.西南医科大学附属口腔医院预防保健科,四川 泸州(646000);2.西南医科大学口腔医学研究所,四川 泸州(646000);3.口颌面修复重建和再生泸州市重点实验室,四川 泸州(646000);4.西南医科大学,四川 泸州(646000)
人牙髓干细胞(human dental pulp stem cells,hDPSCs)是来源于人恒牙/乳牙牙髓的外胚层间充质干细胞,适当诱导下具有良好的多向分化能力,为组织再生提供细胞来源[1]。研究发现革兰氏阴性菌脂多糖(lipopolysaccharide,LPS)可影响hDPSCs增殖,低浓度LPS 促进hDPSCs 合成期细胞增多,促进其增殖、迁移;高浓度LPS 可使hDPSCs DNA 总量减少、蛋白合成降低、增殖能力降低、抑制碱性磷酸酶能力活性,减弱成骨向分化能力,严重可引起细胞死亡[2-3]。因此,积极探索有利于LPS 所致炎性环境下hDPSCs 分化的细胞干预条件,有助于为骨再生和牙齿再生提供新的治疗思路。
发光二极管(light-emitting diode,LED)红光亮度高、方向性强、相干性好,可对研究对象施加照射后产生光化学效应,不会造成局部温度明显提高,并且不会对组织或细胞造成不可逆损伤[4]。有实验研究表明,LED 红光影响牙髓干细胞生长速率、克隆潜能以及成骨和软骨细胞分化[5]。由此可见LED 红光可对牙髓干细胞的分化产生影响,但LED 红光对LPS 所致炎性环境下hDPSCs 成骨/成牙本质分化的影响鲜有报道。
细胞的分化受到信号通路和细胞因子的调控,有丝分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路介导细胞外信号诱导的核反应,有4 个亚族:细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38、细胞外调节蛋白激酶5(extracellular regulated protein kinases 5,ERK5),在调节细胞因子、黏附分子、趋化因子,调节系统性炎症反应中起着重要作用[6]。本实验拟通过LPS 构建体外炎性环境,探究LED 红光调控hDPSCs 成骨/成牙本质分化及作用机制,为牙和颌骨缺损修复机制提供实验依据。
1 材料和方法
本实验已通过西南医科大学附属口腔医院伦理审批(批号:20211119003)。
1.1 主要试剂和仪器
α-MEM(BI,以色列);优级胎牛血清(四季青生物,中国);0.25%胰酶细胞消化液(碧云天生物,中国);LPS(索莱宝,中国);BCIP/NBT 碱性磷酸酯酶显色试剂盒(碧云天生物,中国);0.2%茜素红染液(索莱宝,中国);一抗(鼠抗人):CD34-APC、CD44-PE、CD45-FITC、CD73-PE、CD90-PE 抗 体(Ebioscience,美国);二抗(羊抗鼠):HRP-Goat anti Mouse(ASPEN,中国);一抗(兔抗人):GAPDH(ab181602, Abacam,英国)、JNK、p-JNK(#9252,#4668,CST,美国)、p38、p-p38(AF6456,#4511,Affbiotech,美 国)、ERK1/2、p - ERK1/2(ab184699,ab201015,Abacam,英国)、ERK5、p-ERK5(#3552,#3371,CST,美国)、碱性磷酸酶(alkaline phosphatase,ALP)(ab133602,Abacam,英国)、成骨细胞特异性转录因子(osterix,OSX)(DF7731,Affbiotech,美国)、牙本质基质蛋白-1(dentin matrix protein-1,DMP-1)(PA5-120492,Thermofisher,美国)、牙本质涎 磷 蛋 白(dentin sialo phospho protein,DSPP)(DF14398,Affbiotech,美国);二抗(羊抗兔):HRPGoat anti Rabbit(AS1107,ASPEN,中 国);U0126(MCE,美国);SB203580(MCE,美国);SP600125(MCE,美国);BIX02189(MCE,美国);CCK-8 试剂盒(APExBIO,美国);BCA 蛋白浓度测定试剂盒(增强型)(碧云天生物,中国);碱性磷酸酶检测试剂盒(碧云天生物,中国);SYBR Green PCR 试剂盒(ELK,中国);ELISA 试剂盒(凡科维,中国上海);SDS-PAGE 凝胶制备试剂盒(碧云天生物,中国)。LED 红光灯(T6,芮森,中国);酶联免疫检测仪(MultiskanTMFC,Thermo,美国);倒置相差荧光显微镜(DMi8,Leica,德国);荧光定量PCR 仪(QuantStudio6 Flex System,Life Technologies,美国);SDSPAGE 电泳仪(165-8000,Bio rad,美国)。
1.2 hDPSCs 的分离、培养、鉴定
取西南医科大学附属口腔医院颌面外科拔除的新鲜健康的第三磨牙或因正畸治疗需要拔除的前磨牙,用含20%(v/v)青霉素-链霉素的PBS 清洗至无明显血污,无菌条件下沿牙髓长轴劈开,拔髓针取出牙髓组织,PBS 冲洗后眼科剪剪碎组织,Ⅰ型胶原酶消化、终止、离心重悬后得到单细胞悬液。加入含15%(v/v)青霉素-链霉素FBS、1%(v/v)青霉素-链霉素的α-MEM 培养液,于37 ℃、5% CO2细胞孵箱中培养,隔3 d 半换液。细胞长出后记为原代,当生长密度达80% ~85%时,用胰酶消化传代,取生长状态好的P3 代细胞进行后续实验。
取第3 代细胞,适量PBS 重悬细胞,各加入CD34-APC、CD44-PE、CD45-FITC、CD73-PE、CD90-PE 抗体,避光条件下孵育30 min,流式细胞仪检测表面抗原标志物。取第3 代细胞以2×104个/mL 密度接种于6 孔板中,待细胞长至80%密度后开始成骨诱导和成脂诱导。诱导7 d 行ALP 染色,21 d 行茜素红染色和油红O 染色,并分别采集镜下图。
1.3 LPS 浓度筛选
hDPSCs 经0.25%胰酶消化,离心,终止后以2×103个/孔、200 μL/孔均匀接种细胞至96 孔板中,接种完毕后在接种有细胞的孔周围封闭一圈PBS。37 ℃、5%CO2孵育箱培养过夜后,次日更换为含不同浓度LPS(0、1、5、10 μg/mL)的普通培养基,每组设置3 个复孔,隔2 d 换液。分别于培养第1、3、5、7 天同一时间使用CCK-8 试剂盒检测细胞增殖活力,使用酶标仪测定在450 nm 波长处OD 值。
1.4 LED 红光能量测定
根据课题组前期实验测量[7],当LED 红光发射灯距离高精度光功率计2 cm 时,根据公式:光功率密度(W/cm2)=光总功率(W)/单位面积(cm2),测定光功率密度为66.7 mW/cm2,通过公式辐照曝光量(J/cm2)=光功率密度(W/cm2)×时间(s),计算得出辐照曝光量分别为2、4、6、8、10 J/cm2时,所需辐照时间为30、60、90、120、150 s。辐照第一天记为1 d,隔48 h 辐照一次。
1.5 LED 红光对炎症环境下hDPSCs 成骨/成牙本质分化的影响
根据实验1.3 结果,10 μg/mL 为后续LPS 刺激浓度。设置CG(矿化诱导)组、LPS+CG 组及LPS+CG+不同能量(2、4、6、8、10 J/cm2)光照组;矿化诱导培养基为10 mmol/L β-甘油磷酸钠+50 μg/mL 维生素C+10 mol/L 地塞米松+10%(v/v)FBS+1%(v/v)青霉素-链霉素的α-MEM 培养基。hDPSCs 经0.25%胰酶消化、终止、离心后,加入完全培养基以2×104个/mL 密度接种至培养皿中,细胞融合至70%后按分组加入相应诱导液并进行光照。
1.5.1 ALP 染色及活性测定 细胞处理第7 天根据BCIP/NBT 显色试剂盒说明书,细胞清洗、固定后进行碱性磷酸酶避光染色15 min,倒置显微镜下采集各组图像。处理第7 天,细胞漂洗后每皿加入细胞裂解液,12 000 rpm 离心5 min,收集总蛋白溶液。根据BCA 试剂盒说明书,酶标仪测定波长为562 nm 的各孔OD 值,绘制蛋白标准曲线并计算各处理组蛋白浓度。根据碱性磷酸酶检测试剂盒说明书,96 孔板设置空白孔,标准品孔以及样品孔并加入相应工作液,每孔设置2 个副孔。轻吹混匀后37 ℃孵育10 min,酶标仪测定波长为450 nm 的各孔OD 值。根据公式计算各处理组ALP 活性。
1.5.2 qRT-PCR 检测hDPSCs 成骨/成牙本质分化相关基因 细胞处理第7 天,Trizol 法提取细胞总RNA,将已提取的总RNA 65 ℃变性5 min,立即转入冰上操作。依次加入2 μL 的5*RT Master Mix、RNA template,Nuclease-free Water 补 足 至10 μL。溶解混匀后,以37 ℃,15 min;50 ℃,5 min;98 ℃,5 min;4 ℃程序进行反应反转录为cDNA。根据SYBR Green PCR 试剂盒说明书进行PCR 扩增,反应 程 序 为:95 ℃,3 min;95 ℃,5 s;56 ℃,10 s,72 ℃,25 s,循环40 次;65 ℃,5 s;95 ℃,50 s。引物序列见表1。根据公式2-ΔΔCT计算ALP、OSX、DMP-1、DSPP 基因相对表达量。

表1 引物序列Table 1 Primers sequence
1.5.3 茜素红染色及钙结节定量测定 细胞处理第21 天根据茜素红染色说明书,细胞清洗、固定后使用茜素红S 染液染色5 min,倒置显微镜下采集各组图像。每组培养皿中加入1 mL 氯化十六烷吡啶溶液,充分溶解,根据分组向96 孔板中加入200 μL 溶解液,每实验组设置2 个复孔,调零孔加入200 μL 氯化十六烷吡啶溶液。使用酶标仪测定在562 nm 波长处OD 值。根据公式计算各处理组钙结节。
1.6 ELISA 法测定炎症细胞因子表达
根 据 实 验1.5 结 果,4 J/cm2是LED 红 光 调 节10 μg/mL LPS 所致炎性环境下成骨/成牙本质分化的最佳能量,后续选择4 J/cm2对细胞进行辐照。设置分组:LPS+CG 组,LPS+CG+LED 组。
取hDPSCs 以2×104个/mL、2 mL/皿接种于培养皿中,细胞融合至70%后按分组加入相应诱导液并进行LED 红光辐照,记为实验第1 天,每3 d 更换培养基。分别于实验第1、3、5、7 天无菌管收集培养基液体(包括已换液培养基),3 500 rpm × 20 min离心,仔细收集上清液,吹打混匀后分别收集1 mL上清液。根据ELISA 试剂盒说明书,96 孔酶标包被板进行加样与加酶,每孔设置2 个副孔。封板后37 ℃温育60 min,重复洗涤5 次并拍干,加入显色剂后37 ℃避光显色15 min,终止反应后酶标仪上测定波长为450 nm OD 值。根据公式计算各处理组在1、3、5、7 天细胞分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白细胞介素-1β(interleukin-1β,IL-1β)浓度。
1.7 Western blot测定MAPK信号通路相关蛋白表达
细胞处理第7 天,提取各处理组细胞总蛋白。SDS-PAGE 电 泳 将20 μg 蛋 白 转 移 到PVDF 膜 上。5%脱脂牛奶封闭1h,去除封闭剂后,4 ℃加入一抗(p-ERK1/2、ERK1/2、p-p38、p38、p-JNK、JNK、p-ERK5、ERK5、GAPDH)过夜。TBST 洗涤3 次,加入稀释的二抗,室温孵育30 min。TBST 洗涤4 次后,配制ECL 溶液进行化学发光,并通过Alpha-EaseFC 软件分析目标带的OD 值。GAPDH 作为参考蛋白,计算LPS+CG组与LPS+CG+LED组ERK1/2、p38、JNK、ERK5 及磷酸化蛋白相对表达量。
设置LPS+CG 组、LPS+CG+LED 组、LPS+CG+LED+U0126(抑 制ERK1/2)组、LPS+CG+LED+SB203580(抑制p38)组、LPS+CG+LED+SP600125(抑制JNK)组、LPS+CG+LED+BIX02189(抑制ERK5)组。细胞处理第7 天,Western blot 法检测各处理组ALP、OSX、DMP-1、DSPP 蛋白相对表达量。
1.8 统计学分析
SPSS 27.0 进行统计学分析,计量资料采用均数±标准差进行描述,两组间数据比较采用单因素方差分析,P<0.05 为差异具有统计学意义。使用GraphPad Prism 6绘图。
2 结 果
2.1 hDPSCs 的培养与鉴定
牙髓组织培养第7 天镜下可见组织块周围有细胞贴壁长出,从中央向四周放射状生长,细胞形态为梭形,类似成纤维细胞样。传代后可见细胞生长状态良好,形态均匀一致(图1a& 1b)。

Figure 1 Culture and identification of hDPSCs图1 hDPSCs 的培养与鉴定
第三代hDPSCs 表面抗原检测结果为:间充质干细胞表面抗原标志物呈阳性表达:CD44、CD73、CD90 的表达率依次为99.93%、93.75%、99.81%:造血系统来源细胞表面抗原标志物阴性表达:CD34、CD45 的表达率依次为0.68%、0.09%(图1c)。成骨诱导7 d 后,ALP 染色镜下细胞呈蓝紫色(图1d)。成骨诱导21 d 后,茜素红染色镜下见大小不一的红染钙结节分布于细胞之间(图1e)。成脂诱导21 d后,油红O 染色示镜下细胞复层排列,橘红色脂滴出现在部分细胞胞浆内(图1f)。
2.2 不同浓度LPS 溶液对hDPSCs 增殖的影响
CCK-8 示第1、3、5、7 天,0 μg/mL LPS 组与1 μg/mL LPS 组增殖无显著差异(P= 0.894,P=0.998,P= 0.965,P= 0.870)。5 μg/mL LPS 组在第5 天增殖低于0 μg/mL LPS 组、1 μg/mL LPS 组(P<0.001,P<0.001)。10μg/mL LPS 组在第5、7 天增殖低于0 μg/mL LPS 组、1 μg/mL LPS、5 μg/mL LPS组(第5 天:P<0.001,P<0.001,P= 0.009,第7 天:P<0.001,P<0.001,P= 0.002)(图2)。由此可见,LPS 浓度为5、10 μg/mL 时,均可降低hDPSCs增殖能力,但10 μg/mL LPS增殖抑制作用强于5 μg/mL,因此本实验选择10 μg/mL 作为后续实验诱导炎症微环境的刺激浓度。

Figure 2 Effect of different concentrations of lipopolysaccharides on the proliferation of human dental pulp stem cells图2 不同浓度脂多糖溶液对人牙髓干细胞增殖的影响
2.3 LED 红光对炎症环境下hDPSCs 成骨/成牙本质分化的影响
LED 红光辐照hDPSCs 7 d 后,ALP 染色结果显示LPS+CG 组较CG 组稍浅,光照组蓝染程度均高于LPS+CG 组(图3a)。ALP 定量结果显示LPS+CG组ALP 活力低于成骨组(P= 0.007),光照组ALP 活力均高于CG 组与LPS+CG 组(均P<0.001),LPS+CG+4 J/cm2组ALP 活力高于其他光照组(均P<0.001)(图3b)。
第7天qRT-PCR检测矿化基因ALP、OSX、DMP-1、DSPP 表达结果显示,CG 组与LPS+CG 组无显著差异(P= 0.968,P= 0.267,P= 0.902,P= 0.449)。LPS+CG+2 J/cm2、4 J/cm2、6 J/cm2、8 J/cm2组均高于CG 组与LPS+CG 组(P<0.05)。LPS+CG+4 J/cm2组高于LPS+CG+2 J/cm2、6 J/cm2、8 J/cm2、10 J/cm2组(vs.LPS+CG+6 J/cm2,ALP:P= 0.017;OSX:P=0.001;DMP-1:P= 0.007;DSPP:P= 0.013,其余均P<0.001)。且LPS+CG+8 J/cm2组OSX、DMP-1、DSPP 表达低于LPS + CG + 6 J/cm2组(P= 0.016,P= 0.013,P<0.001),LPS+CG+10 J/cm2组ALP 表达低于LPS+CG+8 J/cm2组(P= 0.004)(图4)。

Figure 4 Effect of LED red light on the expression of mineralization related genes in human dental pulp stem cells in inflammatory environment图4 LED 红光对炎症环境下人牙髓干细胞矿化相关基因表达的影响
LED 红光辐照21 d 后,茜素红染色结果显示CG 组钙结节数目多于LPS+CG 组,LPS+CG+4 J/cm2钙结节染色数目多且较大,较其他LPS+CG+光照组钙结节染色深(图5a)。钙结节定量结果显示LPS+CG 组钙结节定量少于CG 组(P<0.001),LPS+CG+光照组钙结节定量均多于LPS+CG 组与CG 组(均P<0.001),LPS+CG+4 J/cm2组钙结节定量多于其他LPS+CG+光照组(均P<0.001)(图5b)。

Figure 5 Effect of LED red light on the formation of calcium nodules in osteogenic/odontogenic differentiation of human dental pulp stem cells in inflammatory environments图5 LED 红光对炎性环境下人牙髓干细胞成骨/成牙本质分化钙结节形成的影响
2.4 LED 红光影响炎性环境下hDPSCs 矿化时炎症因子的表达
ELISA 结果显示,细胞分泌TNF-α 与IL-1β 的趋势均为先升后降。第1 天,TNF-α 与IL-1β 的分泌无明显差异(P= 0.887,P= 0.066)。第3 天,LPS+CG 组的TNF-α 与IL-1β 的分泌表达量均高于第1 天(P<0.001,P= 0.034),LPS+CG+LED 组的TNF-α 与IL-1β 分 泌 量 高 于 第1、5、7 天(P<0.001),且LPS+CG 组的分泌量低于LPS+CG+LED组(P<0.001)。第5 天,LPS+CG 组的TNF-α 与IL-1β 的 分 泌 表 达 量 高 于 第1、3、7 天(均P<0.001),LPS+CG 组的分泌量高于LPS+CG+LED 组(P<0.001)。第7 天,LPS+CG 组与LPS+CG+LED组的TNF-α 与IL-1β 的分泌表达量低于第5 天(P<0.001),且LPS+CG+LED 组的分泌表达量低于LPS+CG 组(P= 0.002,P= 0.011)(图6)。
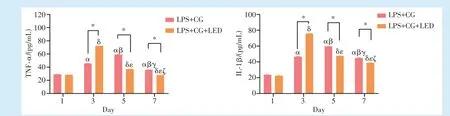
Figure 6 Effect of LED red light on the expression of inflammatory factors during mineralization of human dental pulp stem cells in inflammatory environment图6 LED 红光对炎性环境下人牙髓干细胞矿化时炎症因子表达的影响
2.5 LED 红光介导MAPK 信号通路调控炎症环境下牙髓干细胞成骨/成牙本质分化
MAPK 信号通路蛋白表达如图7,第7 天,LPS+CG+LED 组的p-ERK1/2、p-p38、p-JNK 的相对表达量高 于LPS+CG 组(P<0.001),LPS+CG+LED 组的p-ERK5 相对表达量高于LPS+CG 组(P=0.003)。

Figure 7 Effect of LED red light on the expression of MAPK signaling pathway during mineralization of human dental pulp stem cells in inflammatory environment图7 LED 红光对炎性环境下人牙髓干细胞MAPK 信号通路表达的影响
未加MAPK 通路阻滞剂时,LPS+CG 组ALP、OSX、DMP-1、DSPP 蛋白表达量均低于LPS+CG+LED 组(P<0.001);加 入MAPK 通 路 阻 滞 剂 后,LPS+CG+LED+U0126(抑 制ERK1/2)、LPS+CG+LED+SP600125(抑制JNK)、LPS+CG+LED+BIX02189(抑制ERK5)组ALP、OSX、DMP-1、DSPP 蛋白表达量均低于LPS+CG+LED 组(ALP:LPS+CG+LEDvs.LPS+CG+LED+SP600125(抑制JNK),P= 0.004,其余均P<0.001);LPS+CG+LED+SB203580(抑制p38)组的ALP、OSX、DMP-1 蛋白表达量与LPS+CG+LED 组相比较无显著差异(P= 0.065,P=0.193,P= 0.099),DSPP 蛋白表达量低于LPS+CG+LED 组(P<0.001)(图8)。

Figure 8 Effects of LED red light on the osteogenic/odontoblastic differentiation proteins of human dental pulp stem cells in inflammatory environment through MAPK signaling pathway图8 LED 红光调控MAPK 信号通路对炎性环境下人牙髓干细胞成骨/成牙本质分化蛋白的影响
3 讨 论
hDPSCs 来源于人牙髓组织,免疫原性低,具有高增殖能力,提供合适的外部诱导,在诱导因素胞外基质、细胞因子和物理因子等作用下,可以被定向诱导分化,是再生医学中具有前景的间充质干细胞[8]。有研究报道,LED 红光影响牙髓干细胞的细胞周期、线粒体膜电位和衰老[9];5 J/cm2的LED红光促进高糖环境下牙周膜干细胞增殖和成骨分化,减 轻 氧 化 损 伤[10];2 J/cm2、4 J/cm2LED 红 光(850 nm,80 mW/cm2)显著提升乳牙牙髓干细胞活力、总蛋白产量、ALP 活力以及ALP、Col-I 基因表达[11]。不同能量密度LED 红光对间充质干细胞的增殖、分化有影响。低或不足的能量密度,未达到生物刺激阈值,不会发生细胞反应;较高则可能破坏光感受器,导致生物调节效应降低[12],合适的LED 红光辐射剂量才能对间充质干细胞产生积极的生物学效应。
成骨/成牙本质分化是牙齿形成的基础,也是骨生成的关键步骤。在hDPSCs 生长分化的炎性环境中,由于0、1μg/mL LPS 的增殖速率无明显差异,5、10 μg/mL 的增殖速率依次降低,与刘影等[13]研究结果一致,因此选择10 μg/mL LPS 诱导炎症微环境。本实验中hDPSCs 在10 μg/mL LPS 刺激下的矿化诱导比单纯矿化诱导7 d ALP 染色稍浅及活力测定稍低,说明10 μg/mL LPS 对hDPSCs 的成骨/成牙本质分化效应为抑制,与Sattari 等[2]报道的LPS 对DPSCs 的分化效应一致。LED 红光辐照LPS致炎环境下的hDPSCs,比LPS 矿化诱导下和单纯矿化诱导下ALP 染色、茜素红染色更深,ALP 活力和钙结节定量测定值更高,RT-PCR 检测的成骨特异性基因ALP、OSX 与成牙本质特异性基因DMP-1、DSPP 相对表达量更高,说明LED 红光正向调控炎性环境下的hDPSCs 的成骨/成牙本质分化。其中,4 J/cm2能量密度LED 红光辐照hDPSCs,ALP 染色、ALP 活力测定、RT-PCR、茜素红染色及钙结节定量测定结果最佳,说明4 J/cm2能量密度是LED 红光上调10 μg/mL LPS 致炎环境下促成骨/成牙本质分化的最佳辐照能量。
有研究报道4 J/cm2LED 红光上调牙周膜干细胞ALP、Runt 相关转录因子2(Runt-related transcription factor 2,Runx2)、骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)、骨涎蛋白(bone sialoprotein,BSP)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等基因和蛋白表达,促进干细胞成骨和成血管分化[7,14]。还可以上调牙乳头干细胞的DMP-1、DSPP、BSP、ALP 和Runx2 基因和蛋白的表达,促进干细胞成牙本质和成骨分化[15-16]。本实验也发现4 J/cm2LED 红光促成骨/成牙本质分化能力最强,随能量密度的增加,其成骨向分化能力呈依赖式下降,符合物理治疗中Arndt-Schulze 法则:弱刺激引起生命活动,中等刺激促进生命活动直到达峰值,强烈刺激抑制生命活动直到产生负反应,最强刺激使生命活动停止[17]。
研究报道LPS 可以通过TLR4/MyD88/NF-κB 信号通路诱导牙髓干细胞分泌TNF-α、IL-8、IL-12,引起牙髓损伤[18];Zhai 等[19]研究发现LPS 刺激hDPSCs 后,炎症介质IL-1α、IL-1β、IL-6、TNF-α 基因和蛋白表达升高。本实验中LPS 作为炎症刺激源,处理hDPSCs 后释放TNF-α 和IL-1β 等炎性介质,培养液中炎性介质浓度升高则会引起hDPSCs 增殖与分化的缓慢抑制,与前面报道一致。本研究示10 μg/mL LPS 成骨/成牙本质诱导培养下,非光照组TNF-α 和IL-1β 分泌量在第5 天达到高峰,第7 天炎症反应得到缓解;4 J/cm2LED 红光组炎性介质分泌在第3 天达到高峰且高于非光照组,第5 天炎症反应得到缓解,可能是由于4 J/cm2LED 红光加速了炎症反应的进程。第5、7 天时,4 J/cm2LED 红光组TNF-α 和IL-1β 分泌量低于非光照组。说明4 J/cm2LED 红光在促进炎性环境下成骨的同时,减少了炎症因子TNF-α 和IL-1β 的释放,从而达到抗炎的目的,该结果与其他研究[20]报道的LED 红光光疗下调炎性因子与趋化因子的表达一致。
间充质干细胞成骨/成牙本质分化是一个由多种矿化基因调控、多种信号通路共同参与的一个复杂分化过程。MAPK 信号通路有4 个亚族:ERK1/2、JNK、p38 与ERK5。其中ERK 信号通路主要调控细胞生长和分化,p38 与JNK 信号通路的主要生理效应主要与炎症、细胞凋亡、应激反应有关[21]。因此,物理刺激因素可能激活部分或全部MAPK 亚族通路。本研究中LED 红光促进MAPK信号通路蛋白p-ERK1/2、p-JNK、p-p38、p-ERK5 表达增高,提示ERK1/2、JNK、p38、ERK5 可能参与了LED 红光促进炎症环境下hDPSCs 成骨/成牙本质分化的过程。LED 红光分别联合信号通路ERK1/2特异性阻滞剂U0126、JNK 特异性阻滞剂SP600125以及ERK5 特异性阻滞剂BIX02189 干预hDPSCs时,ALP、OSX、DMP-1、DSPP 矿化蛋白相对表达量低于LPS+CG+LED 组,说明LED 红光激活了ERK1/2、JNK、ERK5 亚通路,也有可能MAPK 阻滞剂加入后诱导干细胞凋亡,成骨/成牙本质分化向分化细胞数目减少,导致矿化蛋白部分表达下调有关[22]。然而LED 红光联合信号通路p38 特异性阻滞剂SB203580 干预hDPSCs 时,LPS+CG+LED+SB203580 组与LPS+CG+LED 组矿化蛋白表达量无明显差异,可能是由于LED 红光未激活p38 信号通路,或者是因为SB203580 有效抑制炎症因子(如IL-1β、TNF-α)诱导的部分信号转导[23],逆转了炎性因子所导致的成骨抑制。因此LED 红光可能通过激活MAPK 信号通路中的ERK1/2、JNK、ERK5 亚通路,来促进炎症环境下hDPSCs 成骨/成牙本质分化。这些MAPK 亚通路的激活与Yamauchi 等[24]研究LED 红光所激活的通路一致。
综上,本研究探讨了能量密度为2 ~10 J/cm2的LED 红光调控10 μg/mL LPS 致炎环境下hDPSCs成骨/成牙本质分化,其中4 J/cm2的LED 红光促成骨/成牙本质分化效应最佳,且减少炎症因子分泌,同时ERK1/2、JNK、ERK5 通路参与LED 红光调控炎性微环境下hDPSCs 成骨/成牙本质分化。不同的参数指标(光源、波长、能量密度、输出功率、照射频率、细胞与光源发射器之间的距离等)对干细胞具有不同的生物学效应,探索治疗的最佳参数有利于为牙髓干细胞的体外处理技术提供实验数据支持。
【Author contributions】Liu Y designed the study, performed the experiments and wrote the article.Hui YN, Jiang B, Zheng GZ designcd the study, performed the experiments and analyzed the data.Wang Y designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
