置管引流与微创旋切对哺乳期乳腺脓肿患者炎性因子及免疫功能的影响
2023-08-02温素奇温革新张国辉张国生
温素奇 江 涛 温革新 张国辉 张国生
(1 广东省人民医院赣州医院(赣州市立医院),江西 赣州 341000;2 赣南医学院第一附属医院,江西 赣州 341000)
哺乳期乳腺炎是一种常见于哺乳期女性的乳腺炎性疾病,可发生于哺乳期的任何阶段。因其缺乏规范化的诊治流程,常致反复发作,甚至进展为乳腺脓肿,给患者身心造成了极大的痛苦[1]。乳腺脓肿传统的治疗方法是切开引流,但该方法存在创伤大、切口疼痛明显、愈合时间长、影响乳房外观等缺点,逐渐被保留哺乳功能的术式如细针穿刺反复抽吸脓液、置管冲洗引流、麦默通微创旋切系统切除等取代,总体上是朝着微创排脓方向发展[2]。近来,多项研究证实超声引导下置管引流与麦默通微创旋切术对乳腺脓肿均有较好的疗效[3-5]。但目前的研究多集中于这两种术式的临床效果观察,关于这两种术式对患者炎性因子与免疫功能影响方面鲜有报道。因此,本研究就超声引导下置管引流与麦默通微创旋切术对哺乳期乳腺脓肿患者炎性因子及免疫功能的影响进行对比,以期为临床上选择对降低炎性因子水平、改善免疫功能效果更佳的手术方式提供参考依据。
1 资料与方法
1.1 一般资料 选取2020年8月至2022年2月在赣州市立医院普外科就诊的哺乳期乳腺脓肿患者64例,随机分为对照组和观察组,每组32例。对照组行超声引导下置管引流,观察组行麦默通微创旋切术。对照组患者年龄21~43岁,平均年龄(28.7±5.2)岁。观察组患者年龄22~41岁,平均年龄(29.4±6.4)岁。两组患者一般情况比较差异无统计学意义(P>0.05),具有可比性。所有患者签署知情同意书,研究获得医院伦理委员会批准。
1.2 纳入及排除标准
1.2.1 纳入标准 ①符合哺乳期乳腺脓肿的诊断标准。②取得患者同意并签署知情同意书。
1.2.2 排除标准 ①精神障碍,不能配合治疗者。②合并重要脏器疾病者。
1.3 方法
1.3.1 对照组 患者取仰卧位,患侧上肢外展90°,采用静脉全身麻醉。彩超定位乳腺脓肿位置,穿刺抽液明确诊断并留取脓液行细菌培养及药敏试验。采用乳晕边缘或乳房下皱襞弧形或放射状切口,长1.0~1.5 cm,探查、分离脓腔间隔,吸除脓液,剥离脓腔内坏死组织及间隔,用生理盐水和双氧水反复冲洗残腔至冲洗液清亮,于脓腔留置硅胶引流管1根并缝合切口,给予持续负压引流。术后无明显脓性引流液及乳汁后拔除引流管,术后7~9 d拆除切口缝线。
1.3.2 观察组 患者体位、麻醉方式及乳腺脓肿彩超定位同对照组。选择距离病灶较近且位置较低处切口长约4 mm。术者左手用超声探头引导,右手持8G旋切刀穿刺至脓肿下方,启动旋切、抽吸,将超声下显示的所有无回声及低回声区完全切除。切除完毕予以生理盐水和双氧水反复冲洗残腔,至冲洗液清亮,并适度加压包扎。
1.4 观察指标
1.4.1 血常规指标的测定 两组患者均分别于治疗前及治疗后第3天清晨空腹抽取肘静脉血。采用全自动血细胞分析仪检测血液中白细胞(white blood cell,WBC)计数。
1.4.2 炎性因子及免疫指标的测定 两组患者均分别于治疗前及治疗后第3天清晨空腹抽取肘静脉血。采用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)法检测血清中白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)及肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)水平;采用双抗体夹心ELISA法检测血清中降钙素原(procalcitonin,PCT)、C-反应蛋白(C-reactive protein,CRP)水平;采用流式细胞术检测CD4+T细胞、CD8+T细胞;采用免疫散射比浊法检测IgG和IgM。
1.4.3 乳腺脓肿治愈率(治愈标准判断)于术后第5天观察患侧乳房,参照2020年《中国哺乳期乳腺炎诊治指南》[6]规定,以局部炎性症状消失,超声检查无明显液性暗区为治愈标准。
1.5 统计学方法 数据采用SPSS 22.0统计学软件进行分析,符合正态分布的计量资料用(±s)表示,组间比较采用独立样本t检验或Mann-WhitneyU秩和检验;计数资料以[n(%)]表示,组间比较采用Fisher精确概率检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后WBC、CRP、PCT水平比较 与治疗前相比,两组患者治疗后的WBC、CRP、PCT水平均明显下降,差异有统计学意义(P<0.05)。治疗后两组之间比较,观察组与对照组治疗后的WBC、PCT水平相仿,差异无统计学意义(P>0.05)。但观察组治疗后CRP水平比对照组下降更明显,差异有统计学意义(P<0.05)。见表1。
表1 两组患者治疗前后WBC、CRP、PCT水平比较(±s)

表1 两组患者治疗前后WBC、CRP、PCT水平比较(±s)
注:与治疗前相比,aP<0.05;与对照组相比,bP>0.05;cP<0.05。
2.2 两组患者治疗前后IL-6、IL-8及TNF-α水平比较 与治疗前相比,两组患者治疗后的IL-6、IL-8及TNF-α水平均明显下降,差异有统计学意义(P<0.05)。治疗后两组之间比较,观察组治疗后的IL-6、IL-8及TNF-α水平均比对照组下降更明显,差异有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后IL-6、IL-8及TNF-α水平比较(±s)
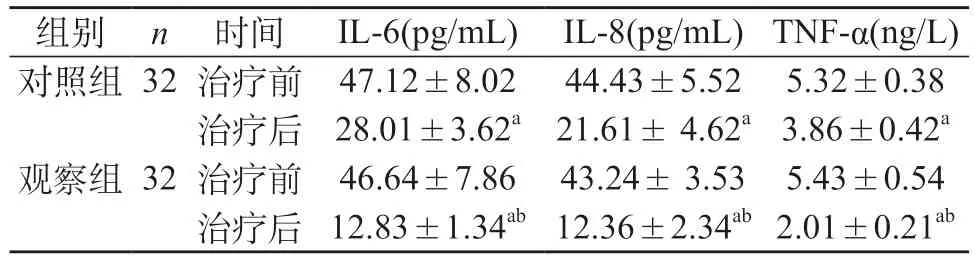
表2 两组患者治疗前后IL-6、IL-8及TNF-α水平比较(±s)
注:与治疗前相比,aP<0.05;与对照组相比,bP<0.05。
2.3 两组患者治疗前后CD4+、CD8+、IgG和IgM水平比较 与治疗前比,观察组治疗后外周血CD4+淋巴细胞百分率明显降低,CD8+淋巴细胞百分率明显升高,IgG和IgM水平均明显下,差异有统计学意义(P<0.05);对照组治疗后外周血CD4+百分率降低,CD8+百分率升高,差异无统计学意义(P>0.05);但对照组治疗后IgG和IgM水平均明显下降,差异有统计学意义(P<0.05)。与对照组相比,观察组治疗后的IgG和IgM水平下降幅度更大,差异有统计学意义(P<0.05)。见表3。

表3 两组患者治疗前后CD4+、CD8+、IgG和IgM水平比较(-x±s)
2.4 两组患者术后第5天乳腺脓肿愈合情况比较 对照组出现4例脓肿引流不尽以及1例乳漏[15.63%(5/32)],观察组出现1例切口感染[3.13%(1/32)],两组比较,差异无统计学意义(P=0.224)。
3 讨论
哺乳期乳腺炎多在乳汁淤积的基础上发展而来,乳腺脓肿则是产妇未及时处理乳腺炎发展而来[7]。既往观点认为乳腺炎的发病原因主要是细菌感染[8],但这种观点已得到挑战。哺乳期乳腺炎发病机制已从简单的感染性疾病转变为更大的概念——炎症性疾病。感染性致病菌的数量与该病的易患性和严重程度无关,而与乳腺小叶腔内高压引发的哺乳期乳腺免疫系统内炎症信号网络之间的相互作用密切相关[9-10]。目前乳腺脓肿一般应用抗生素的经验治疗方法,尚无循证医学证据[11]。固有免疫应答产生的炎性介质可刺激乳腺导管,使患者出现的乳腺局部肿胀、疼痛[12];系统性免疫应答所产生的前炎性因子将导致全身发热症状。一直以来,哺乳期乳腺脓肿的治疗以排脓减压为基本原则。随着医疗器械发展及治疗理念的更新,超声引导下的微创手术治疗,包括置管引流术和麦默通微创旋切术等,已成为其主要的外科治疗模式[13-14]。鉴于此两种术式对对哺乳期乳腺脓肿患者炎性因子及免疫功能的影响尚不明确,进行了此次研究。
T淋巴细胞分为CD4+T淋巴细胞和CD8+T淋巴细胞,主要负责机体的细胞免疫。CD4+T淋巴细胞是一组辅助T细胞,主要是在细胞免疫的效应阶段,分泌多种淋巴因子,介导其他免疫细胞的活性,加速抗原物质的消除。CD8+T淋巴细胞又称细胞毒性T细胞,可诱导靶细胞的凋亡,同时对辅助性T淋巴细胞和B细胞具有调节作用。在健康人体中,T淋巴细胞亚群间相互诱导,又相互制约,故其数量始终保持一定的正常比例[15]。当机体出现感染性疾病时,T淋巴细胞亚群的数量和比例失调,导致患者的免疫调节功能紊乱[16]。感染性疾病患者的CD4+T细胞比例明显升高,而CD8+T淋巴细胞比例明显降低[17]。因此,T淋巴细胞亚群的变化可在一定程度上反映机体的细胞免疫功能状态。而IgG、IgM在机体的早期免疫防御中起重要作用,是血液循环内抗感染的主要抗体。急性哺乳期乳腺炎患者血液中IgG、IgM异常升高可促进乳腺导管发生水肿,导致乳汁淤积,而乳汁淤积又会加重乳腺导管水肿,相互促进,增加了治疗难度。总体来说,两组哺乳期脓肿的患者治疗转归还是较好的。微创旋切组术后第5天时只出现1例切口感染[3.13%(1/32)],而置管引流组术后虽然出现4例脓肿引流不尽以及1例乳漏[15.63%(5/32)],但两组之间差异并无统计学意义,说明这两种术式对哺乳期乳腺脓肿的最终治疗效果并无差异。
综上所述,对于哺乳期乳腺脓肿的治疗,超声引导下置管引流与麦默通微创旋切术均能控制乳腺炎症、感染。但麦默通微创旋切术能更快的控制哺乳期乳腺炎症及感染,降低炎性因子水平,且能改善免疫功能,缩短康复进程,具有较好的临床应用价值。同时,因本研究纳入的病例数较少,存在一定的局限性。因此,本研究结果还有待大样本的临床研究加以证实。
