糖尿病足溃疡感染患者创面Bcl-2、PDGFR-α表达与预后的关系研究
2023-08-01向光大
向 林,董 靖,刘 敏,向光大
中部战区总医院内分泌科,湖北武汉 430070
糖尿病足溃疡(DFU)是糖尿病患者严重慢性并发症之一,据统计,约25%的糖尿病患者会发生DFU[1]。同时DFU也是导致糖尿病患者截肢的主要原因,在所有非创伤性截肢病例中,DFU大约占40%左右[2]。此外,DFU还会增加患者心脑血管疾病以及死亡风险,给患者及其家庭带来沉重的心理和经济负担[3]。感染作为DFU患者创面愈合迁延不愈、反复发生的重要原因之一,也是导致DFU病情加重、致残、致死的主要原因。研究表明,相较于未感染的DFU患者,伴感染患者的截肢风险增高15.5倍[4]。DFU患者易发生感染的主要原因在于这些患者多伴有神经病变、血管病变,前者可导致痛温觉减退、足部畸形,增加皮肤破溃风险,引发感染;后者可导致足部干燥破裂,病原菌入侵引发感染[5]。临床认为DFU感染的发生机制可能与局部高血糖、炎症反应失衡、生长因子及其受体表达异常等有关[6]。血小板源生长因子(PDGFR)是一种碱性多肽生长因子,只有与靶细胞膜上的特异性受体PDGFR-α结合后才能发挥作用,并直接或间接参与创面愈合的调控[7];B细胞淋巴瘤(Bcl)-2是一种原癌基因,该基因与胰岛B细胞的凋亡相关[8],可通过增加其凋亡数量,导致高血糖的出现,进而间接影响创面愈合。但目前有关于Bcl-2、PDGFR-α的研究多集中于小鼠模型或人皮肤溃疡,对于Bcl-2、PDGFR-α表达与DFU愈合的关系鲜有报道。故本研究旨在探究DFU感染患者创面Bcl-2、PDGFR-α表达与预后的关系。
1 资料与方法
1.1一般资料 选取本院2019年3月至2021年6月诊治的125例DFU患者作为研究对象。纳入标准:(1)符合DFU诊断指南[9];(2)无血液、自身免疫性相关疾病;(3)患者临床资料完整。排除标准:(1)非糖尿病引起的溃疡;(2)溃疡组织存在明显坏死、骨髓炎;(3)入组前1个月接受生长因子等敷料或高压氧治疗;(4)合并恶性肿瘤或心脑血管疾病者。根据是否发生感染分为感染组(87例)和未感染组(38例)。两组患者一般资料比较无统计学意义(P>0.05),具有可比性。见表1。
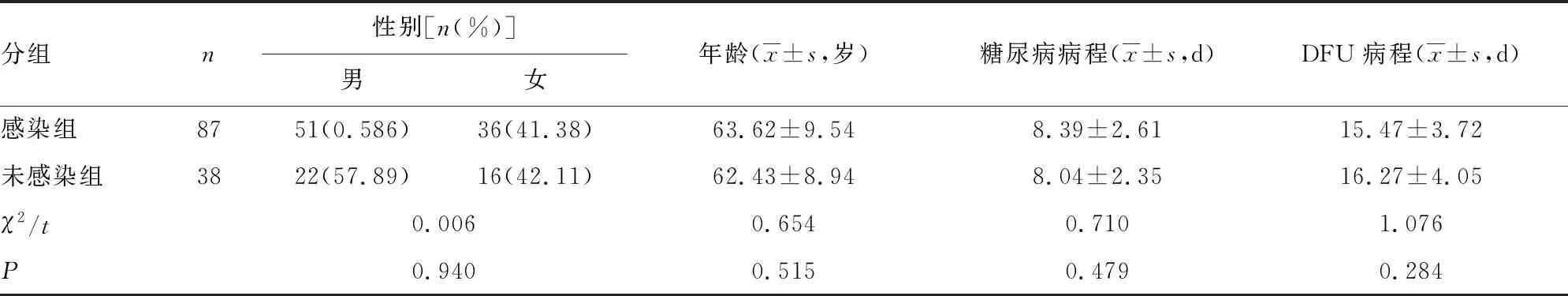
表1 两组一般资料比较
1.2方法 患者入院后均给予常规清创处理,根据患者具体情况每1~3 d进行1次换药,清除表面坏死组织。取患者创面中的新鲜肉芽组织,放入液氮中冷却,然后将组织标准本转移至-80 ℃冰箱中保存。将肉芽组织研磨呈粉末状,加1 mL Trizol溶液混匀,室温静置5 min。加0.2 mL氯仿溶液,摇匀,室温静置3 min。在4 ℃、离心力12 000×g的情况下离心15 min。取上层水相,以1∶1的体积加异丙醇,在4 ℃、离心力12 000×g的情况下离心15 min。弃去上清液,加1 mL的75%的乙醇溶液,震荡洗涤,在4 ℃、离心力7 500×g的情况下离心5 min。弃去上清液,自然风干5~10 min。加入去离子水洗涤,于55 ℃下恒温孵育10 min,提取总RNA。引物序列:PDGFR-α上游和下游(5′-3′)分别为GACACTGGGAGATTCGGAGC 和AGAGATCATTGGAGGCCGTG。Bcl-2上游和下游(5′-3′)分别为AAGATTGATGGGATCGTTGC和GCGGAACACTTGATTCTGGT。内参上游和下游(5′-3′)分别为CCGCATCTTCTTTTGCGTCG和TCCACCCATGGCAAATTCCA。PCR反应条件设置:95 ℃ 5 min,进入循环反应,95 ℃ 15 s、58 ℃ 30 s、72 ℃ 30 s,循环40次,在每个循环的第3个阶段进行荧光信号收集。采用SDS v2.0.1软件对荧光信号进行处理,采用2-ΔΔCt法计算各个目的基因的mRNA相对表达水平。
1.3观察指标 (1)比较感染组和未感染组DFU患者Bcl-2、PDGFR-α表达水平。(2)根据国际DFU工作组以及美国感染病学会制定的DFU感染分级标准[10]对DFU感染患者进行分级,分为轻度感染、中度感染以及严重感染,其中将只有皮肤或皮下组织出现感染,红斑在伤口周围延伸<2 cm,为轻度感染;红斑距创面边缘≥2 cm,感染深至皮肤和皮下组织以下更深的组织,为中度感染;体温>38 ℃或<36 ℃,心率为90次/分,呼吸速率>20次/分或二氧化碳分压(PaCO2)<4.3 kPa(32 mmHg),白细胞计数>12 000/mm3或<4 000/mm3或>10%,满足上述任意两项及以上者即为严重感染。分别比较不同感染程度患者Bcl-2、PDGFR-α表达水平,并分析感染程度与表达水平的相关性。(3)随访半年,主要通过门诊随访或电话随访方式进行,期间无失访人员。将患者未愈合、截肢、死亡等纳入预后不良组,将创面皮肤完全附带或形成结痂,达到愈合标准的患者纳入预后良好组,收集患者临床资料,分析影响DFU感染患者预后的因素,并分析Bcl-2、PDGFR-α表达对于预后的预测价值。

2 结 果
2.1感染组和未感染组Bcl-2、PDGFR-α表达水平的比较 感染组患者Bcl-2、PDGFR-α表达水平均显著低于未感染组(P<0.05),见表2。
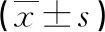
表2 感染组和未感染组Bcl-2、PDGFR-α表达水平比较
2.2不同感染程度Bcl-2、PDGFR-α表达水平比较 Bcl-2、PDGFR-α表达水平:严重感染者<中度感染者<轻度感染者,差异均有统计学意义(P<0.05),见表3。
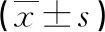
表3 不同感染程度Bcl-2、PDGFR-α表达水平比较
2.3Bcl-2、PDGFR-α表达水平与感染严重程度相关性 Bcl-2、PDGFR-α表达水平与感染严重程度均呈负相关(r=-0.280、-0.516,P<0.05)。
2.4影响DFU感染患者预后的单因素分析 预后不良组患者Bcl-2、PDGFR-α表达水平显著低于预后良好组(P<0.05),其余指标单因素分析差异均无统计学意义(P>0.05)。见表4。

表4 影响DFU感染患者预后的多因素分析

表4 影响DFU感染患者预后的单因素分析或n(%)]
2.5影响DFU感染患者预后的多因素分析 以DFU感染患者预后是否良好为因变量,以Bcl-2、PDGFR-α表达为自变量,进行Logistic回归分析,结果显示Bcl-2、PDGFR-α表达降低是导致DFU感染患者预后不良的危险因素(P<0.05)。见表4。
2.6Bcl-2、PDGFR-α表达对于DFU感染预后的预测价值 Bcl-2、PDGFR-α表达对于DFU感染患者预后均具有较好的预测价值,而两者联合预测曲线下面积(AUC)、特异度分别为0.765、71.83%,高于Bcl-2、PDGFR-α表达水平单项用于预测。见表5和图1。

图1 Bcl-2、PDGFR-α表达水平用于DFU感染患者预后预测的ROC曲线分析
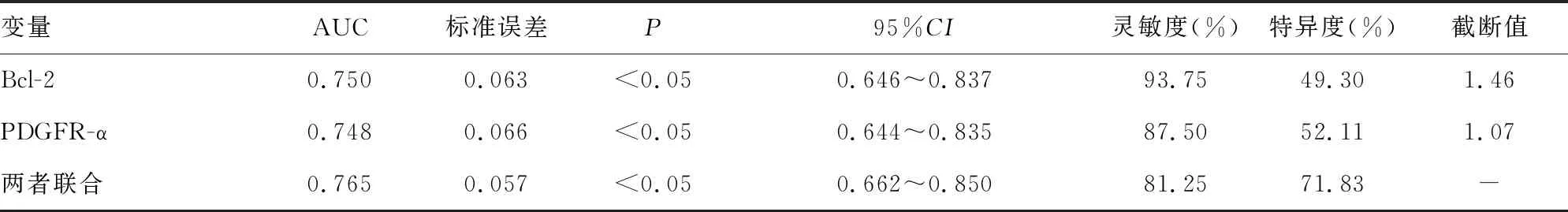
表5 Bcl-2、PDGFR-α表达对于DFU感染预后的预测价值
3 讨 论
DFU患者因自身免疫力较低,多伴有神经病变或血管病变,创面愈合情况较差,极易发生感染,而感染会进一步加重患者病情,两者相互作用,从而影响患者预后[11]。尽管近年来不断有新型广谱抗菌药物出现,同时较多的综述或指南均给予了包括局部清创、外科干预、抗菌药物等DFU感染治疗方案[12-13],但感染的发生率仍存在上升趋势。既往研究表明约71%的DFU患者会发生感染[14]。在本研究中,DFU患者的感染发生率为69.6%,与既往上述研究结果相类似,进一步证实了DFU的易感染性。而DFU患者因多种并发症的存在,增加了抗菌药物的选择难度,促使患者预后变差。故早发现、早诊断、早治疗对于DFU患者的预后至关重要。
近年来研究发现,细胞因子及其受体在DFU的发生以及修复过程中具有重要作用[15]。PDGF是发现较早的结缔组织生长因子,来源于平滑肌细胞、血管内皮细胞、成纤维细胞等多种细胞。该因子可通过促进多种细胞增殖,同时趋化合成细胞外机制,增强细胞黏附,形成肉芽组织,促使损伤后的组织修复,可见其在创面愈合过程中起到十分重要的作用[16]。国内刘洋等[17]通过对DFU患者溃疡组织以及正常皮肤组织的PDGF表达情况进行比较,发现前者表达水平明显降低。另国外CADAMURO等[18]研究也表明PDGFR-α可通过调节组织重塑促进成纤维细胞的生成。本研究以DFU感染和未感染患者为研究对象,结果显示DFU感染患者创面PDGFR-α表达水平明显降低,而且随着感染程度的增加,PDGFR-α表达水平呈现递减趋势,提示PDGFR-α可能与DFU患者创面感染相关。分析其原因,PDGFR-α可介导炎症细胞、成纤维细胞等,促进肌动蛋白重排,促使炎症细胞向受损部位迁移和转运,同时介导血管内皮细胞,达到促进新生血管形成的目标。而降低或抑制PDGFR-α的表达,则会导致细胞核内PDGFR-α基因表达的降低,进而降低生长因子活性,难以发挥其生产的生物学作用,致使创面迁延不愈,增加感染风险[19]。既往已有研究表明DFU患者感染程度与溃疡程度呈正相关[20],可见创面经久不愈也是引发感染的重要因素。除此之外,高血糖被认为也是导致DFU患者感染的重要因素[21],高血糖的发生会导致患者机体抵抗力降低,从而增加感染风险。Bcl-2是一种癌基因,可通过抗氧化通路、破坏孔道蛋白的活性、调节线粒体渗透性转变孔道复合物的成分等机制抑制细胞凋亡,近年来研究表明该基因与糖尿病患者胰岛B细胞凋亡密切相关[22]。吕晓玉等[23]研究表明Bcl-2与DFU创面中Wnt/β-catenin通路被抑制密切相关;另郑敏等[24]也发现Bcl-2相关细胞凋亡机制参与了DFU创面病理过程。本研究结果显示,DFU感染患者创面Bcl-2表达水平明显降低,而且随着感染程度增加,呈现递减趋势,提示Bcl-2可能与DFU患者创面感染相关。笔者认为,一方面Bcl-2水平的降低,导致抑制凋亡能力也相应降低,进而促使创面凋亡细胞数量显著增加,出现组织坏死或创面不愈,进而增加感染风险。另一方面,细胞凋亡增加,可能影响Bcl-2家族之间的动态平衡,进而促使胰岛B细胞凋亡受影响,促使机体发生高血糖,降低抵抗力,从而导致感染概率增加。感染的发生势必会对DFU患者的预后产生负面影响,导致患者发生截肢甚至死亡[25]。故探究Bcl-2、PDGFR-α表达与DFU感染患者预后的关系十分必要。本研究通过Logistic单因素以及多因素分析,结果显示创面Bcl-2、PDGFR-α表达水平降低是导致DFU感染患者不良预后的独立危险因素,并进一步通过ROC曲线分析得出检测创面Bcl-2、PDGFR-α表达情况可为DFU感染患者预后提供一定的预测价值。DFU创面内细胞过度凋亡被认为是重要的病理特征,推测可能随着PDGFR-α表达降低,组织修复能力减弱,同时Bcl-2抑制凋亡能力降低,细胞凋亡的增加,进一步导致创面组织损伤加重,感染程度增加,进而导致不良预后。
综上所述,DFU患者感染的发生与Bcl-2、PDGFR-α表达密切相关,且Bcl-2、PDGFR-α表达降低是导致患者预后不良的危险因素,临床可加强对Bcl-2、PDGFR-α表达的监控,进而为预后判断提供参考。目前本研究的局限在于未通过体外试验进一步论证Bcl-2、PDGFR-α表达影响DFU感染患者预后的具体机制,这也是后期有待开展的研究方向。
