国内中枢神经系统表面铁沉积临床特征探究
——附病例报道一例
2023-07-31林钲宇杨晨蔡然泽费国强
林钲宇,杨晨,蔡然泽,费国强,2
中枢神经系统表面铁沉积(superficial siderosis of the central nervous system,SSCNS)是一种因慢性蛛网膜下腔出血后,含铁血黄素及游离铁沉积于软脑膜、脑组织和脊髓表面所致的中枢神经系统变性疾病。其常见的原因有硬膜病变、外伤或手术、肿瘤等,但仍有部分患者病因不明[1]。典型的临床表现为感音性听力下降、小脑性共济失调和锥体束征三联征,还可有其他脑脊髓神经功能缺损症状,这与铁沉积的部位、范围、沉积的时间相关。既往诊断主要依靠尸检或活检,随着医学影像技术的发展,MRI已成为主要诊断手段及病因筛查方法。由于该病多隐匿起病,进展缓慢,其无症状期可达4个月至50年,发病年龄多为40~60岁[1],因此需与脊髓小脑变性、多系统萎缩等相鉴别。该病的治疗主要有外科干预出血病因、去除沉积铁、对症支持及康复治疗,但大部分患者疗效往往欠佳。虽然SSCNS 从1908 年首次报道[2]至今已100余年,但全球仅数百例病例报道[3],国内第一次对SSCNS 的描述见于1997 年[4],约10 年后才出现首例病例报道[5],仍属罕见病。本文报道2022年5 月复旦大学附属中山医院(厦门)神经内科收治的1例SSCNS病例,并结合相关文献进行分析探讨。
1 资料与方法
1.1 病例资料
患者,男,64岁,汉族,务农,因“听力下降、进行性行走不稳2 年”于2022 年5 月入院。患者2020 年起无明显诱因出现双耳听力下降,外院检查提示“双耳中度感音性耳聋”。后逐渐出现行走不稳、言语含糊、反应迟钝。2022年初上述症状加重,伴性格改变(外向→内向)、少言、思睡,否认幻觉、意识障碍、头晕头痛、视物异常、恶心呕吐、吞咽困难或呛咳、肢体无力僵硬抖动等。病程中患者饮食、二便可,体质量无明显变化。既往否认高血压、糖尿病等慢性病史。患者40余年前高坠史,全身多发外伤,否认头部外伤;10余年前左耳颞部刀伤史;2022年初跌倒致右眉弓处外伤。小学文化;长期务农及工地搬运建材;吸烟数十年,每日2~3包,已戒烟半年;无饮酒史、毒物接触史。已婚已育1 子2女,子女体健。否认家族遗传性疾病。体格检查:生命体征平稳,心肺腹部查体无异常。神经系统查体示反应迟钝、近记忆减退、计算力减退,言语稍含糊,双侧听力粗测减退、气导>骨导、Weber 居中,左侧巴氏征(+),双侧指鼻稳准、跟膝胫试验无法配合,Romberg征睁闭眼均(+),直线行走不能。MMSE 17分(扣分点主要在注意力和计算力、回忆能力、语言能力)。实验室检查:血清铁9.4 μmol/L↓、总铁结合力49 μmol/L↓;WBC 10.58×109/L↑,粪便OB(±);余尿粪常规、肝肾功能、电解质、心脏标志物、凝血功能、贫血、甲功、自身抗体、肿瘤标志物等均未见异常。影像学检查:颅内动脉、颈动脉、椎动脉CTA 见顶部大脑表面浅静脉扩张(图1)。全神经系统轴MRI 示:左侧额顶叶硬膜下积血;T2WI及SWI序列上可见脑干周围、小脑、双侧大脑表面、脊髓表面低信号改变,考虑含铁血黄素沉积;第四脑室扩大,部分脑沟增宽加深,小脑萎缩。颈胸段脊髓前部硬膜外可见长条状长T1长T2异常信号,提示硬膜外积液;C5/6椎间盘向左侧椎间孔区突出压迫硬脊膜囊,胸腰椎退变(图2)。脊髓MRI 水成像未见明显脑脊液外漏。常规肌电图未见异常。纯音测听+声导抗示:双耳重度感音性听力下降。脑活检及脑脊液检查:在征得患者及家属知情同意的情况下,患者进行了软脑膜活检,术中见脑表面淡黄色改变,病理结果提示普鲁士蓝染色阳性,考虑软脑膜铁沉积(图3)。患者入院后行两次腰椎穿刺均未取得脑脊液,故活检时经侧脑室穿刺采集脑脊液行实验室检查,脑脊液外观淡黄色改变,蛋白0.51 g/L↑、红细胞400/mm3↑,余常规生化指标均正常,光镜下可见皱缩红细胞(图4)。根据患者临床症状、影像学检查及脑活检,诊断为SSCNS,由于未找到明确病因,最终考虑为病因未明的经典型幕下铁沉积(infratentorial superficial siderosis,iSS)。予丁螺环酮、维生素C、胞磷胆碱、银杏叶提取物片等药物对症治疗,至出院时(入院治疗26 d 后)患者行走不稳稍改善,但听力及认知减退并无明显变化。
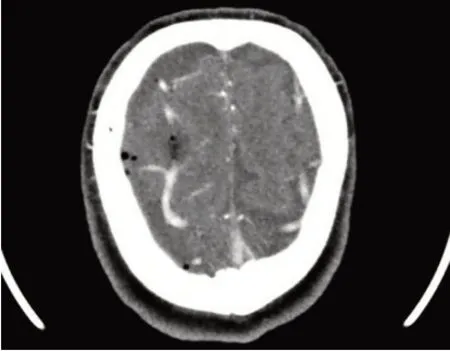
图1 患者颅内动脉CTA见顶部大脑表面浅静脉扩张
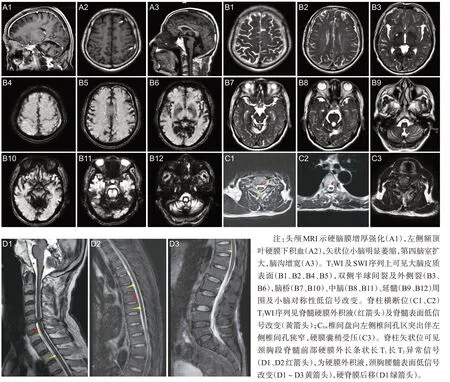
图2 患者中枢神经系统MRI
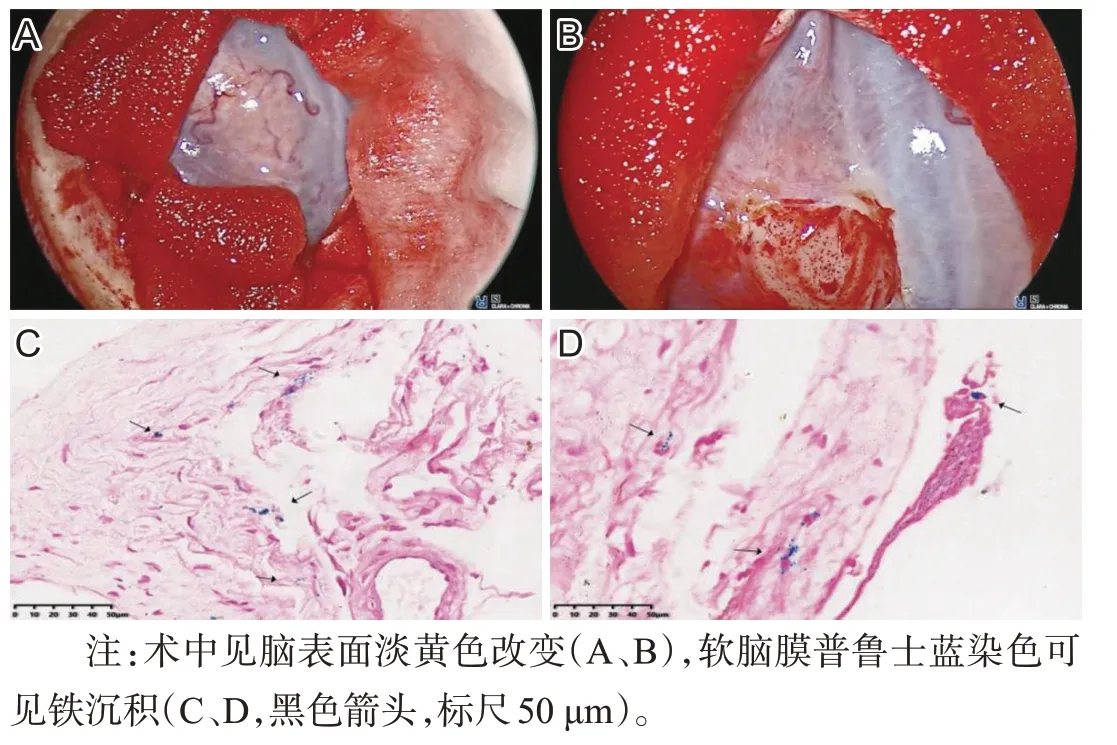
图3 患者脑活检
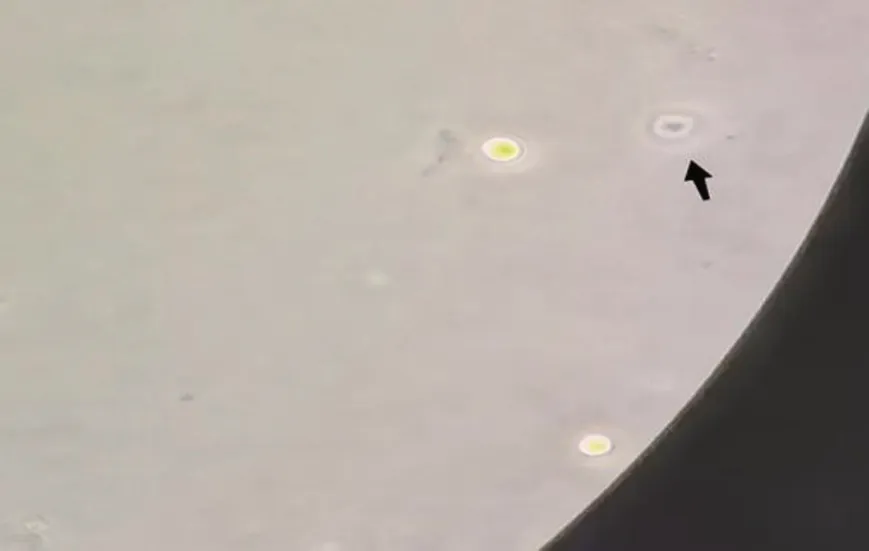
图4 脑脊液光镜下可见皱缩红细胞(黑色箭头,×400)
1.2 方法
以“中枢神经系统表面铁沉积”“中枢神经系统表面铁沉积症”“SSCNS”为检索词,搜索CNKI、维普、万方医学网上截至2022 年8 月国内发表的相关文献,对其中报道较为详细的病例临床资料进行分析。
1.3 统计学处理
采用Excel 2016 软件,对检索出的病例临床资料进行描述性统计。
2 结果
共检索出相关中文文献75篇,排除重复病例,其中临床资料较详尽的文献43 篇,共62 例患者(不含本病例)。男女比例为40∶22,就诊年龄19~78岁,平均年龄(49.26±12.34)岁,病程3周~16年不等。最常见的临床表现主要为共济失调(55例,88.71%)、听力下降(52例,83.87%)、锥体束征(40例,64.52%),其他临床症状还有头痛(17 例,27.42%)、头晕(17 例,27.42%)、二便障碍(14例,22.58%)、认知减退(13例,20.97%)、肢体感觉异常(12 例,19.35%)、视力下降(10 例,16.13%)、耳鸣(9例,14.52%)、癫痫(5例,8.06%)、震颤(4例,6.45%)、嗅觉减退(4 例,6.45%)、腰痛(4 例,6.45%)、颈痛(4 例,6.45%)、脑膜刺激征(3 例,4.84%)、性功能障碍(2 例,3.23%)、自主神经功能障碍(2例,3.23%)、三叉神经痛(1 例,1.61%)、运动性失语(1 例,1.61%)、面肌痉挛(1例,1.61%)。共有39例患者行腰椎穿刺术,其中1例多次穿刺失败,27例测量了颅内压(高颅压6例,低颅压5例,颅内压正常16例),35例描述了脑脊液外观(外观黄变或呈血性28例、外观正常7例),35例行脑脊液蛋白定量检测(脑脊液蛋白升高30例),6例脑脊液铁或铁蛋白升高,3例行脑脊液光镜检查(见皱缩红细胞2例,见散在破碎红细胞1例)。62例患者中,有61例影像学显示幕上及幕下神经系统表面铁沉积信号改变,另1例影像学仅描述幕上铁沉积(右侧额叶,病因不明),6例存在硬膜外积液。所有病例中,42例病因不明;12例可能的病因为:外伤或神经系统手术史4例,脑或脊髓血管畸形3例,中枢神经系统肿瘤2例,血小板减少症、神经梅毒、脑脊髓膜炎各1例;8例发现明确的病因分别为:腰髓室管膜瘤3 例,脑血管畸形、枕部局限性脑膜膨出、椎管内占位、胸髓海绵状血管瘤、腰椎外伤手术(各1例)。其中9 例行驱铁治疗(结局:好转3 例,无变化4例,加重2例),6例行手术治疗(结局:好转1例,部分好转且无加重3例,无变化1例,加重1例)。
3 讨论
SSCNS由Hamill首次报道,当时将其定义为:“脑、脊髓和脑膜黑变病”[2]。其发病机制尚不明确,现普遍认为是由于慢性反复蛛网膜下腔渗血导致铁离子及含铁血黄素随脑脊液播散沉积在软脑膜、脑、脊髓和颅神经表面而致病[6]。相关研究[7]揭示了病理过程大致如下:血液慢性反复渗入蛛网膜下腔并随脑脊液播散;红细胞溶解,血红蛋白溢出降解生成血红素;血红素接触暴露于脑脊液的神经组织,刺激Bergmann细胞及小胶质细胞产生血红素氧化酶-1(heme oxygenase-1,HO-1)和铁蛋白;HO-1 将血红素分解为二价铁离子和胆绿素,前者与铁蛋白结合生成含铁血黄素后沉积于中枢神经系统造成神经元坏死,而其中铁离子沉积造成的后果更为严重[8]。另亦有报道部分脑铁沉积与铜蓝蛋白(ceruloplasmin,CP)缺乏相关[9,10]。CP在经血脑屏障输出铁方面起着重要作用,脑内CP主要表达于星形胶质细胞、室管膜细胞和软脑膜细胞中,通过其铁氧化酶活性将二价铁氧化成三价铁,促进铁与转铁蛋白的结合并转运到利用铁的细胞中,且有助于载铁巨噬细胞有效释放铁。当CP缺乏时,在过量的铁被释放到蛛网膜下腔时,容易造成膜下铁沉积。铁沉积易受累部位主要为小脑、大脑沟回、外侧裂、额叶底部、脑干、脊髓、脊神经根及第Ⅰ、Ⅱ、Ⅷ对颅神经[8,11,12],这与本研究的病例所呈现铁沉积部位相符,究其原因,一是与上述结构的解剖构成有关,这些部位富集Bergmann细胞等胶质细胞,易诱发反应产生铁沉积;另一方面和脑脊液的动力学有关[7],如脑干、小脑蚓部和凸面的脑脊液流量大,且这些结构与脑脊液接触面积较多,更易致铁沉积。第Ⅷ颅神经的中枢与周围部分的交界点位于内耳道,接触脑脊液的富含胶质细胞的中枢部分较长,故在12对颅神经中最易受累,这也是国内外报道的病例中大多数患者以听力受损为主要临床表现的原因,本研究的病例亦是以双耳进行性感音性听力下降为首发临床症状。
SSCNS 根据受累的部位不同分为皮质型(cortical superficial siderosis,cSS)及iSS。cSS由Charidimou等[13]首次提出,其定义为影像学上显示含铁血黄素等沉积于大脑半球凸面皮质及幕上脑室系统表面所造成的特征性信号改变,且不累及幕下结构,好发于老年人,最常见的病因为脑淀粉样血管病,可表现为脑叶出血、“淀粉样发作”、慢性认知损害、癫痫等,其中“淀粉样发作”多见于局部铁沉积的cSS,认知损害常见于弥漫性铁沉积的cSS;而60 岁以下人群cSS 则可能与可逆性脑血管收缩综合征、原发性中枢神经系统血管炎、高灌注综合征、皮质静脉梗死等有关[14]。iSS的诊断标准则由Wilson等[15]定义为:脑干(包括中脑、脑桥、延髓)、小脑(包括小脑叶、蚓部和小脑脚)、脊髓或颅颈交界处这3个部位经MRI T2序列或其他对血液敏感的MRI序列(GRE/SWI)检查,在上述2 个及以上部位可见双侧对称性线样均匀低信号改变,且可合并存在幕上神经系统结构表面类似的铁沉积低信号。并分为以下两型:①iSS-1 型(或经典型iSS),没有经影像学证实的自发性或创伤性颅内出血,病因不明确,临床上具有典型三联征,病程缓慢进展;②iSS-2 型(或继发型iSS),经影像学证实和单次急性、自发性或创伤性颅内出血相关,出血部位周围含铁血黄素沉积大多较经典型明显,通常集中在第四脑室出口,且均无类似经典型的缓慢进展临床综合征。本文报道的病例依照Wilson的诊断标准,符合经典型iSS;总结的国内病例,除1例仅有右额叶铁沉积描述,其余均为符合Wilson定义的iSS。
早年Levy 等[16]总结了270 例SSCNS 病例资料,发现病因不明或特发性病例占35%,而具有明确出血来源的最常见病因为中枢神经系统肿瘤(21%),其他病因包括头背部外伤(13%)、血管畸形(9%)、神经系统手术史(7%)、臂丛神经损伤(6%)、淀粉样血管病(3%)等。Wilson等[15]在其研究报道的48例患者中,发现40例出血原因为硬膜异常;5例病因为中枢神经系统肿瘤及颅内动脉瘤;另3 例病因不明。当中25 例患者行脊柱MRI 检查发现硬脊膜外积液、硬脊膜扩张或缺损。Kumar 等[1,8,12]长期对SSCNS 相关病例进行研究,亦发现该病最常见病因为硬膜损伤,常导致腹侧纵向椎管内积液(ventral longitudinal intraspinal fluid collection,VLISFC),提示椎间盘突出或骨刺可能是导致硬膜受损原因,且可合并低颅压。笔者检索到的国内报道病例大部分病因不明(42/62),其余潜在或明确的出血病因与国外报道的常见病因基本一致,推测硬膜病变及低颅压参与SSCNS的发病。
既往该病确诊主要靠尸检,从1985年Gomori等[17]首次通过高场强MRI确诊1例SSCNS开始,MRI磁敏感序列检查逐渐成为诊断首选方式,Kumar[1]建议对怀疑SSCNS行全神经系统增强MRI检查,有助于发现潜在的脑脊液漏、肿瘤或血管畸形等病因。若发现脊髓硬膜外积液,则提示存在脑脊液漏,可进一步行脊髓造影寻找瘘口。由于经典型iSS通常不是由于大血管病变引起,故血管造影不作为常规检查手段,但在一些病因不明的患者中,这些检查仍起到一定辅助作用。脑脊液检查中皱缩或破碎红细胞、噬铁细胞、铁、铁蛋白、胆红素水平升高也有提示意义。但亦存在脑脊液检查正常,如本文检索到的病例中就有7 例脑脊液外观正常,考虑与间歇性渗血有关,故非渗血期腰穿脑脊液可能无阳性结果,需多次腰穿以提高阳性检出率。脑脊液检查还有助于判断硬膜缺损患者的手术修补效果,若脑脊液黄变消退、红细胞减少,则提示修补成功。
本文报道的病例具有典型的iSS 三联征,全中枢神经系统MRI扫描符合SSCNS影像学改变,但未发现肿瘤性占位性病变、血管畸形等。患者两次腰穿均无脑脊液流出,考虑可能是铁沉积致腰骶部蛛网膜黏连或低颅压所致。较既往国内报道的病例不同的是,笔者对该患者进行了软脑膜活检并行普鲁士蓝染色为国内首例。患者术区脑表面淡黄色改变,普鲁士蓝染色阳性,符合既往文献报道的铁沉积病理特征[7]。术中采集的脑脊液改变符合SSCNS 的脑脊液特点。结合患者既往多次外伤史、颈椎C5/6椎间盘突出压迫硬脊膜囊、颈胸段脊髓腹侧长节段纵向硬膜外积液,笔者推测患者可能存在硬脊膜损伤,为造成铁沉积的可能原因,但患者行全脊髓MRI水成像检查未发现明确的脑脊液瘘口,最终诊断为经典型iSS。由于未进一步行脊髓造影发掘病因,这是本研究的不足之处。
SSCNS 造成的神经功能缺损大多进展缓慢,但致残率较高,早诊断早治疗尤为重要。对早期发现明确病因的,如硬膜缺损、肿瘤、血管畸形等,可考虑硬膜修补、肿瘤切除等手术治疗。但大多SSCNS患者确诊时铁沉积已造成不可逆损害,手术疗效个体差异较大[18]。目前临床上报道较多的治疗方式为以去铁酮为代表的铁螯合治疗,但其疗效及安全性有待进一步商榷[19-22]。耳蜗植入可能对部分听力下降者有效[23],丁螺环酮及康复训练对部分共济失调的患者也有一定疗效,此外也有报道应用激素、抗氧化剂等治疗该病,但效果不明确。结合本病例和相关文献报道提示目前尚无明确有效的治疗方法,仍待进一步研究。
