猫角膜缘干细胞不同采集、分离与培养鉴定方法的对比研究
2023-07-31胥辉豪冯雪倩朴雪玲慎晓军郑小波林珈好金艺鹏林德贵
胥辉豪,冯雪倩,朴雪玲,慎晓军,郑小波,杨 恒,林珈好,金艺鹏,林德贵
(1.西南大学动物医学院,重庆 402460;2.西南大学发光分析与分子传感教育部重点实验室,重庆 400700;3.中国农业大学动物医学院,北京 100193)
角膜具有折射与透射性,同时保护眼内结构免受外界因素伤害等生理作用,对维持正常视力至关重要。角膜上皮层位于角膜最外层,是眼表的第一道生理组织屏障,也是维持角膜透明度的重要结构[1]。角膜缘干细胞(limbal stem cells, LSCs)是角膜上皮细胞的再生来源,各种病因造成的LSCs缺失将降低角膜上皮的自我更新能力,从而破坏角膜完整性或造成角膜溃疡经久不愈,进而致使角膜血管化、角膜结膜化、角膜瘢痕化、角膜组织坏死以及不同程度炎性反应,最终可能发展为角膜溶解和角膜穿孔等严重病理变化[2-3]。因此,功能正常的LSCs对于修复角膜损伤与维持角膜透明度至关重要[4]。
猫的角膜疾病不完全等同于犬或人类,兽医临床中某些特定的角膜疾病仅限于猫,例如坏死性角膜炎[5-6]、角膜上皮糜烂[7]等。随着伴侣猫的数量日益增多且角膜疾病高发,而常规的手术治疗手段存在潜在麻醉风险、技术材料要求高、术后并发症较多等局限性[5,7-10]。因此,针对猫角膜疾病治疗的研究应当另辟蹊径。近年来,LSCs移植技术治疗角膜疾病被认为具有巨大前景[11-12]。目前,人医临床上已尝试采用体外培养的自体或异体LSCs配合移植技术治疗角膜上皮经久不愈以及LSCs严重缺损所引发的各种角膜疾病,并已取得一定成效[13-14]。这为LSCs移植治疗猫角膜疾病提供了新思路以及理论依据,但目前兽医临床研究中尚未有针对猫角膜缘干细胞(feline limbal stem cells,FLSCs)体外培养的系统方法。因此,本研究通过比较不同分离与培养方法对FLSCs生长情况的影响,以期筛选出最适的分离、培养体系,为进一步研究猫相关角膜疾病的发病机制以及将其临床用于相关角膜疾病的治疗提供理论基础。
1 材料与方法
1.1 试验材料
健康雌性本地实验猫,4月龄,由西南大学实验动物房提供。异氟烷(河北九派制药有限公司),鼠尾胶原蛋白I型、三抗(青霉素-链霉素-两性霉素-B)、人重组EGF、人重组胰岛素(Solarbio公司),中性蛋白酶Ⅱ、0.25%胰蛋白酶/1 mmol·L-1EDTA溶液、胎牛血清、DMEM、F12、血清替代物(KSR)、非必需氨基酸、碱性成纤维细胞生长因子、白血病抑制因子(美国Gibco公司),抗小鼠ABCG2蛋白(Invitrogen公司),抗鼠波形蛋白单抗(GeneTex公司),FITC—羊抗小鼠IgG二抗(Proteintech公司)。角膜板层隧道刀、角膜侧切口刀(美国Sharpoint公司);角膜剪、显微镊(有齿/无齿):上海金钟公司;百级净化手术室(西南大学动物医学院),GS-2020手术显微镜(德国目乐公司),37 ℃、5%CO2恒温培养箱、离心机(美国Thermo Scientific公司),酶标仪(美国佰腾公司),荧光倒置相差显微镜(日本Olympus公司),4、-20、-80 ℃冰箱(中国青岛海尔公司)。
1.2 体外构建FLSCs生长三维环境
在冰浴条件下,将200 μL鼠尾胶原蛋白I型(5 mg·mL-1)加至1.5 mL灭菌离心管中,再往离心管中加入690 μL灭菌超纯水,混匀。然后加入12 μL 0.1 mol·L-1NaOH,立刻混匀。再加入100 μL DMEM培养基和F12培养基(3∶1)混合组成的基础培养基(BM培养液),混匀后,立即加到96孔细胞培养板中,每孔10 μL。然后将包被好的培养板在室温静置20 min,待胶凝固后,移至培养箱内。
1.3 猫角膜缘组织取材
所有手术操作均在百级净化手术室内进行。对试验猫进行吸入麻醉后,仰卧保定,剃除术眼周围毛发,使用碘伏充分消毒眼周皮肤。铺无菌手术洞巾,放置开睑器,使用聚维酮碘(900 mg·L-1)术野消毒液充分消毒眼表,无菌PBS液冲洗结膜囊3 次,在手术显微镜下(10×)取样。以头侧12:00方向角膜缘为取材点,在角膜缘处剪开球结膜,使用隧道刀分离角膜缘处上皮与前基质层,随后使用角膜剪获取角膜缘约1 mm×6 mm×0.2 mm的灰白色组织(利用显微镜自带刻度尺测量)(图1),装入含 D-Hanks液(含1%三抗)的EP管中,浸泡持续30 min。

A.分离结膜并制作角膜缘切口;B.分离角膜缘处上皮与基质层;C.获取角膜缘组织A. Separate conjunctiva and make limbal incision; B. Separation of epithelial and stromal layers at the limbus; C. Obtain limbal tissue图1 手术显微镜下采集猫角膜缘组织Fig.1 Collecting cat limbal tissue under operating microscope
1.4 原代FLSCs分离
原代FLSCs分离培养方法分为3组:A组采用组织贴壁法(T法),B组采用混合酶消化法(N法),C组采用混合酶消化法联合组织贴壁法(NT法)。A组在无菌条件下将角膜缘组织剪成0.2 mm3大小,直接贴附于预先用添加10%胎牛血清(FBS)、1%青霉素-链霉素-两性霉素-B的BM培养基湿润过的的25 mm2有孔细胞瓶中,于CO2细胞培养箱中37 ℃培养6 h后加入4 mL添加10% FBS、1%三抗的BM培养基,每2 d换液1次。待组织块周边爬出游离细胞后取出组织块。B组将角膜缘组织与2.0 units·mL-1的中性蛋白酶Ⅱ在37 ℃温育2 h,弃液,用PBS洗2~3次;用0.25%胰蛋白酶/1 mmol·L-1EDTA溶液37 ℃处理消化后细胞20 min,产生单细胞悬浮液,移除角膜缘组织,添加培养液终止酶活性,1 500 rpm离心10 min,弃上清;加入1 mL培养液轻吹混匀,转移至25 mm2细胞瓶中补培养液至5 mL进行培养,每2 d换液1次。C组使用B组酶消化角膜缘组织后,不移除角膜缘组织,加入添加10% FBS、1%三抗的BM培养基后培养,每2 d换液1次。每日使用倒置显微镜观察细胞形态和生长状态,并拍照记录。
1.5 角膜缘干细胞鉴定
对3种方法分离的角膜缘细胞进行细胞免疫荧光鉴定。取处于对数生长期的细胞制成细胞悬液,以3×105·mL-1的密度接种于24孔细胞培养板中,待细胞在孔中长满单层后,使用免疫荧光细胞化学法检测细胞中ABCG2标志蛋白的表达情况。
1.6 FLSCs培养分析
将分离的FLSCs以1×104个接种到鼠尾胶原蛋白I型凝胶包被的96孔细胞培养板。细胞在3种不同条件下培养: 对照组(BC组:BM+10%FBS+1%青霉素-链霉素-两性霉素-B);含血清培养组(DLM组:BM+10%FBS+1%青霉素-链霉素-两性霉素-B +20 ng·mL-1人重组EGF+10 μg·mL-1人重组胰岛素);无血清培养组(SCM组:BM+10%血清替代物(KSR)+1% 非必需氨基酸+10 ng·mL-1碱性成纤维细胞生长因子+10 ng·mL-1白血病抑制因子+1%青霉素-链霉素-两性霉素-B )。连续7 d内每24 h使用CCK-8法进行细胞计数,绘制生长曲线,分析FLSCs最适培养基。
1.7 细胞属性鉴定
使用筛选出的最佳分离FLSCs的方法和最适培养基进一步培养FLSCs,对其进行形态学观察、细胞增殖能力测定、以及细胞属性的鉴定。
1.8 数据统计分析
2 结 果
2.1 原代FLSCs分离方法对比结果
细胞形态学显示,3种分离方法均可分离出呈梭形的干细胞形态的细胞,但分离的效率存在差异(图2)。由图2可见,T法干细胞形态的细胞生长时间较长,第1天贴壁细胞极少,第10天细胞生长率明显低于N法和NT法,第10天后细胞生长速度加快,第17天细胞尚未长满单层。N法第1天贴壁的梭形细胞比T法多,但有其他形态的杂细胞混合生长,不易纯化分离,第7天后细胞生长速度加快,第17天后混合细胞长满单层。而NT法第1天贴壁的干细胞形态的细胞较其他两组多,细胞从角膜缘组织游出后,成岛屿状生长,其他形态的杂细胞较少,第5天后明显可见干细胞形态的细胞生长速度加快,第11天长满单层。对比3种分离方法,明显观察到NT法中具有干细胞形态的细胞数量多于其他两组,且其他形态的杂细胞较少;此外,NT法中干细胞形态的细胞分离速度最快,分离效果最好。
2.2 干细胞标记蛋白免疫荧光鉴定
三种消化法所分离的细胞中ABCG2标记蛋白均有表达,结果如图3所示,NT法细胞中ABCG2蛋白表达最强,而T法中表达最弱。表明3种分离方法均可成功分离出FLSCs,但NT法分离的FLSCs最多。结果表明,在手术显微镜下微创分离与采集的活体猫角膜缘组织非常适用于体外培养FLSCs。通过细胞形态学和干细胞标记蛋白鉴定显示,混合酶消化法联合组织贴壁法(NT法)最适于分离FLSCs。
2.3 不同培养基中FLSCs生长分析结果
根据方差分析结果所示(表1),与其他两组相比,DLM组在培养第3天时细胞增殖速度显著加快(P<0.05),从培养第4天起,DLM组细胞增殖速度与其他两组差异极显著(P<0.01)。与BC组相比,SCM组培养第4天时细胞增殖速度相对更快,差异显著(P<0.05),培养第5天时,差异极显著(P<0.01)。细胞生长曲线显示(图4),FLSCs在3种培养基中均可生长增殖,但增殖速度存在差异,DLM组增殖速度明显快于其他两组。由此可知,在本研究筛选的3种培养基中,DLM培养基是最适培养FLSCs的培养基,SCM培养基次之。
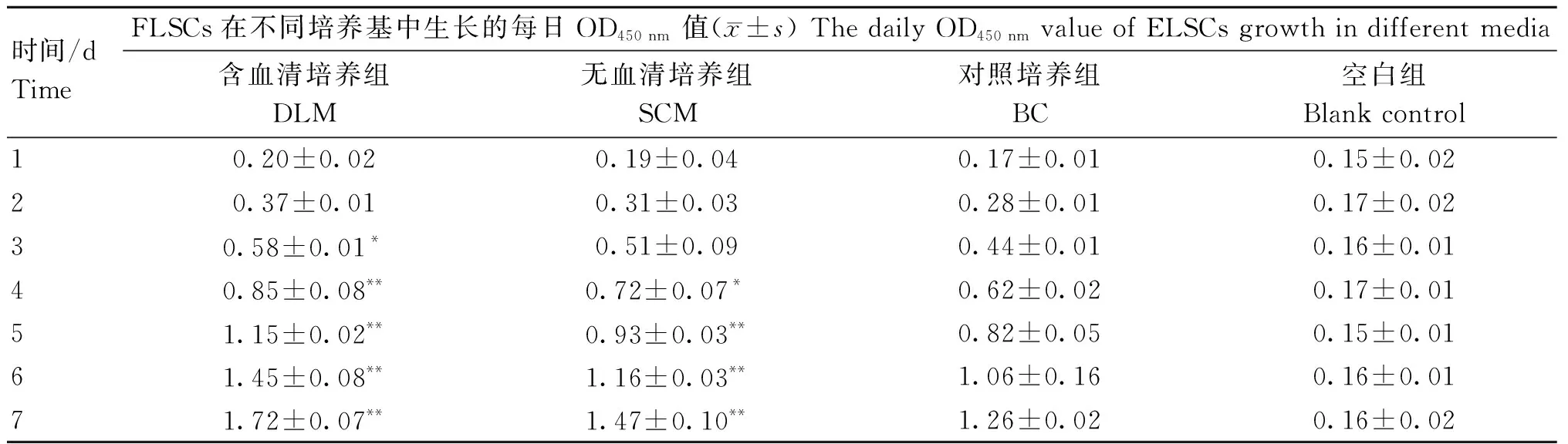
表1 FLSCs在不同培养基中生长的每日OD450 nm值Table 1 Daily OD450 nm values of FLSCs grown in different media
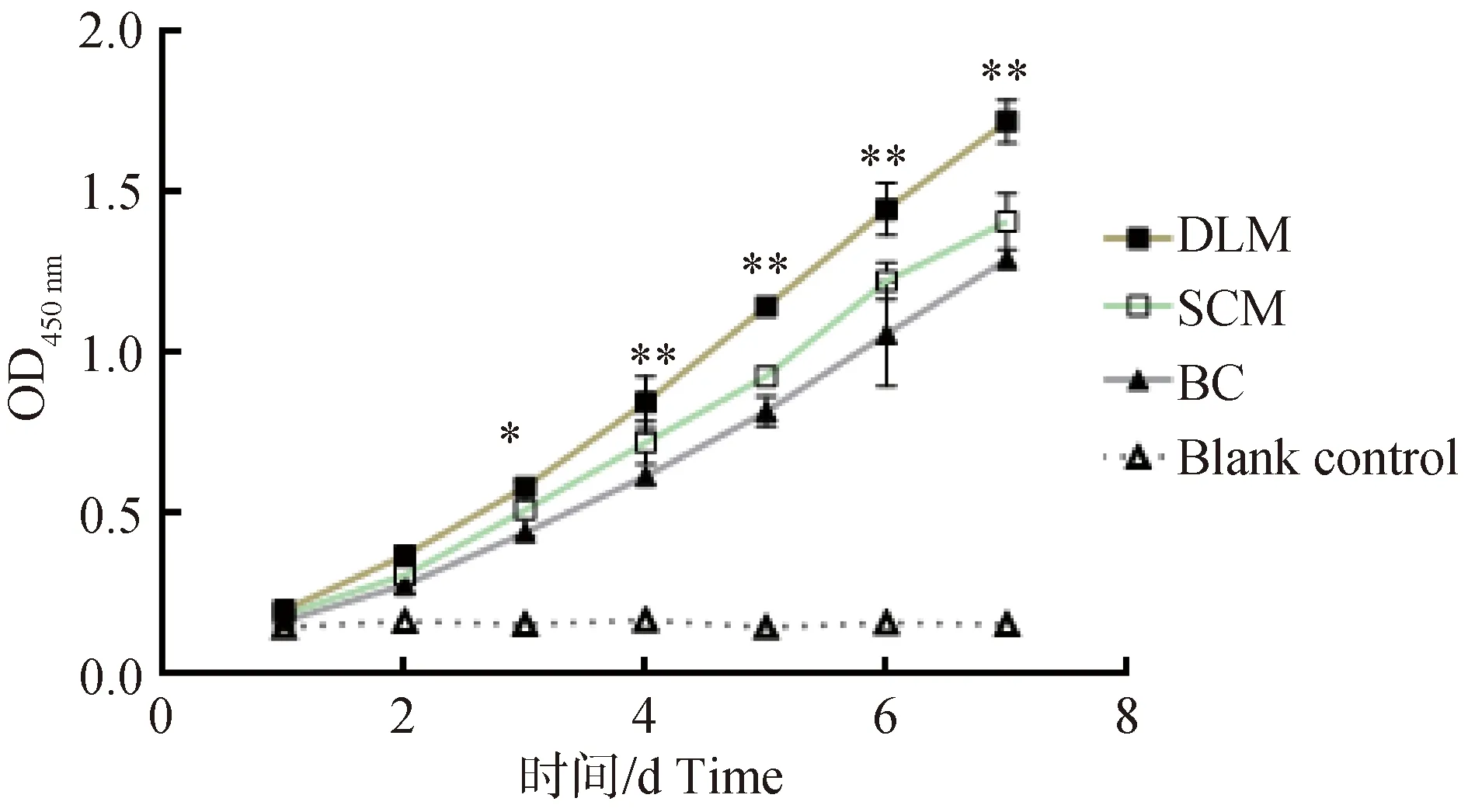
*. P<0.05; **. P<0.01图4 FLSCs在不同培养基中的生长曲线Fig.4 Growth curve of FLSCs in different culture media
2.4 细胞属性鉴定
2.4.1 FLSCs生长过程中形态学观察结果 如图5所示,倒置显微镜下可见细胞从组织块中游离出来,形成散在的单个细胞;72 h后,可见细胞开始聚集生长;120 h后,细胞数量明显增多,开始进入对数生长期,细胞间间隙变窄;216 h后,贴壁细胞达到80%左右汇合;288 h后,贴壁细胞基本汇合形成细胞单层,细胞间排列紧密。镜下可见凋亡细胞少,细胞形态清晰、呈梭形、胞质丰富、核呈圆形、细胞核位于细胞中央,传至7代细胞生长状态仍然稳定,细胞形态保持一致的长梭形,细胞核核质明显,边缘清晰。

A.接种培养板24 h后的FLSCs;B.接种培养板72 h后的FLSCs;C.接种培养板120 h后的FLSCs;D.接种培养板216 h后的FLSCs;E接种培养板288 h后的FLSCsA. FLSCs after inoculated on culture plate for 24 h; B. FLSCs after inoculated on culture plate for 72 h; C. FLSCs after inoculated on culture plate for 120 h; D. FLSCs after inoculated on culture plate for 216 h; E. FLSCs after inoculated on culture plate for 288 h图5 FLSCs生长状态观察(40×,标尺=50 μm)Fig.5 Observation of the growth status of FLSCs (40×, bar=50 μm)
2.4.2 FLSCs增殖生长曲线 FLSCs增殖情况见表2、表3、图6和表4。细胞生长曲线呈“S”型,经历了经典细胞生长曲线的迟缓期、对数生长期、平稳期和衰亡期4个生长时期,细胞在贴壁生长的前72小时处于迟缓期,第72~216小时处于对数生长期,第216~264小时则基本处于平稳期,第264小时开始细胞进入衰亡期。细胞群体倍增时间to=tlg2/1 g(Nt/No),其中,No为接种细胞数,Nt为时间t后的细胞数,由此计算FLSCs群体倍增时间为38.9 h,平均最大增殖浓度为5.66×105cells·mL-1。

表2 FLSCs生长曲线测定结果Table 2 Results of growth curve measurement of FLSCs
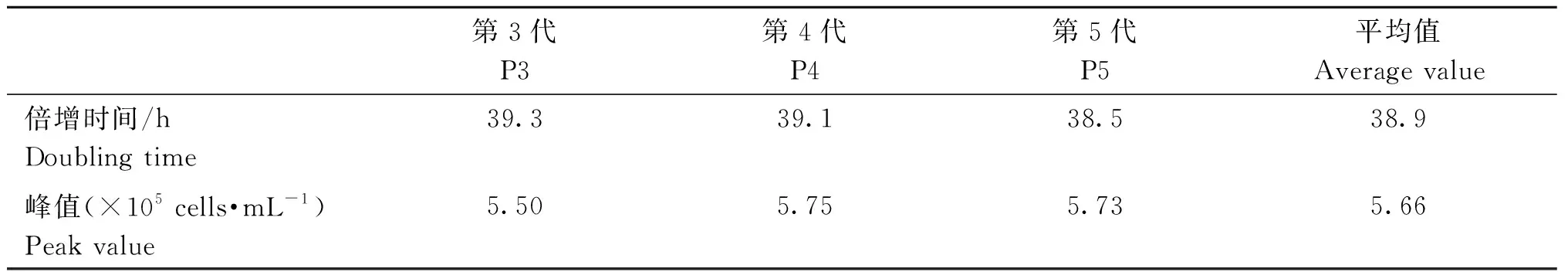
表3 FLSCs倍增时间测定结果Table 3 Measurement results of doubling time of FLSCs

表4 FLSCs生长曲线各时期的时间分布Table 4 Time distribution of feline corneal limbal stem cell growth curve in each period d

图6 第3代FLSCs生长曲线Fig.6 Growth curve of the third-generation FLSCs
2.4.3 波形蛋白、p63、CK3和CK12表达检测 本试验选取LSCs的阳性标志物p63、波形蛋白和上皮分化标记物CK3、CK12对培养第3、4、5代FLSCs进行定性分析。结果可见,细胞中波形蛋白和p63均呈强阳性表达,而上皮分化标记物CK3和CK12则不表达(图7)。
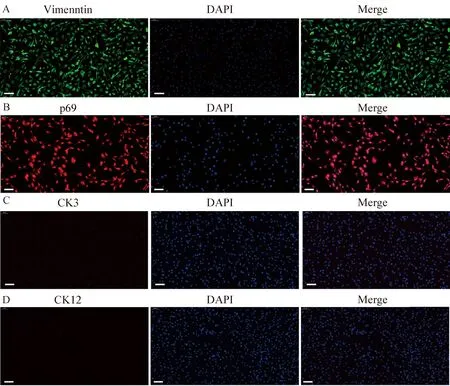
图7 免疫荧光技术检测波形蛋白 (A)、p63 (B)、CK3 (C)和CK12 (D)表达情况 (标尺=50 μm)Fig.7 Expression of vimentin (A), p63 (B), CK3 (C) and CK12 (D) detected by immunofluorescence technique (bar=50 μm)
3 讨 论
近年来,对干细胞的研究是再生医学最重要的进展之一。干细胞因具有免疫调节、抗炎、多向分化潜能、促进损伤修复等优点,被广泛用于各类疾病治疗研究中[15]。角膜盲作为高发的眼表疾病备受人们关注,而LSCs移植的临床应用为该类疾病的治疗提供了全新的思路。LSCs不仅能为角膜上皮的体外重建提供足够数量的种子细胞,且体外培养的LSCs还可失去部分抗原性,更利于临床移植。近年来,利用LSCs做为种子细胞体外构建角膜上皮的治疗方法已在人类眼科学中初见成效[16]。鉴于角膜疾病同样作为猫的高发眼科疾病,而传统的治疗方法存在效果不佳、费用昂贵等局限性,因此尝试研究LSCs移植治疗方法极具临床意义。
角膜缘上皮由三层细胞组成:浅表非角化分层鳞状细胞、与表层平行的中间翼状细胞和垂直于表层的基底细胞[17]。LSCs位于角膜缘POV区(palisades of vogt)。LSCs体外分离培养关键的第一步在于成功分离角膜缘基底层和角膜缘内皮层,并尽可能多地获取LSCs。角膜缘区域结构较为复杂,其中包括角膜、结膜、巩膜等组织,因此造成取样存在一定难度。为保证LSCs的高效分离及避免污染问题,本研究采取工作在百级净化手术室内完成,使用呼吸麻醉方式,利用眼科显微镜及眼科手术器械对活体试验猫进行角膜缘取材,这在最大程度上减少了细胞污染的可能性并可精准定位与分离组织。在分离角膜缘组织时,本研究保留了部分黑色素细胞层组织。有研究表明,角膜缘的黑色素细胞有助于细胞的增殖和保持未分化的状态[18]。本研究同时观察到,取样位点的缺损可在术后3~5 d内完全修复,这表明活体角膜缘取样对猫眼损伤极小,同时也提示猫自体角膜缘干细胞移植治疗具有潜在的可能性。
LSCs的体外培养主要分为组织块贴壁法和酶消化法。前者步骤简单、成功率高、污染小、可保持细胞原有形态与维持角膜缘干细胞的功能[19],但操作要求较高,细胞生长期较长;酶消化法虽可获得大量细胞,但操作繁琐、需要试剂多且昂贵,对细胞损伤较大。随着技术的进步,许多学者不断改进分离角膜缘干细胞的方法[20-21]。鉴于尚未有FLSCs的分离方法报道,因此本研究对比了组织块贴壁法、混合酶消化法以及混合酶消化法联合组织贴壁法分离FLSCs的效果,以筛选最适用于FLSCs的原代分离方法。结果表明,酶消化法联合组织贴壁法中干细胞形态的细胞分离速度最快,其他形态的细胞少,细胞增殖活性较高。采用显微手术分离角膜缘组织能更准确剥离角膜基质层和内皮层,从而使组织块贴壁法游离出杂细胞较少的FLSCs,但组织块间细胞连接紧密,FLSCs游离出组织所需时间较长,且若FLSCs起始分离基数较少则易出现生长抑制的情况,这将不利于细胞体外快速扩增。而混合酶消化法,首先通过中性蛋白酶DispaseⅡ对角膜缘上皮层与角膜缘基质层结构进行酶解,随后胰酶-EDTA消化FLSCs,两者配合,既减轻了对细胞膜的损伤,又分离了大量细胞,且尽可能地降低了杂细胞的含量,最终提高了FLSCs的分离效率,而角膜缘组织贴壁培养又增加短时间内FLSCs的增殖数量,使FLSCs更早进入对数生长期。
离体的LSCs在培养皿、培养板等二维环境中生长,常发生与细胞在体内时不同的组织结构改变、生物化学信息以及细胞之间相互作用的信号改变或丢失,从而无法反映出细胞在体时的正常功能[22]。相比之下,细胞在三维载体支架中的生长持续时间更长,也更能保持干细胞特性;同时三维载体培养可模拟体内的生长因子作用、电信号传输及细胞外基质介导的机械传导等,上述微环境在细胞分化及维持正常生理生化过程中均发挥极其重要的作用[23]。胶原凝胶是一种可使LSCs体外生长状态接近体内生长状态的安全、无病毒污染且可降解的三维细胞培养载体。鉴于此,本研究在细胞培养之前,选用对96孔细胞板包被鼠尾胶原蛋白I型凝胶以构建FLSCs生长的三维载体,在DMEM/F12(3∶1)培养基(BM培养基)基础上,对比了添加10%FBS、1%三抗的BM培养基(BC);添加10%FBS、1%三抗、20 ng·mL-1人重组EGF以及10 μg·mL-1人重组胰岛素的BM培养基(DLM);添加1%三抗、10%血清替代物(KSR)、1% 非必需氨基酸、10 ng·mL-1碱性成纤维细胞生长因子和10 ng·mL-1白血病抑制因子的无血清培养基(SCM)3种不同的完全培养基,结果显示,3种培养基均可培养FLSCs,但细胞在DLM中增殖速度最快,细胞峰值到达时间更短,10~11 d后长成细胞单层,而细胞在基础培养基BC中增殖速度最慢。本研究初步认为血清和细胞生长因子的叠加使用以及血清替代物和细胞生长因子比单纯使用血清对角膜缘干细胞促生长增殖的效果好,且血清和细胞生长因子的叠加使用对FLSCs的促生长效果更好。人重组EGF、人重组胰岛素、bFGF、LIF 4种细胞生长因子均可促进FLSCs增殖和保持干细胞特性。其机制可能是bFGF可调节细胞的生长、分裂、增殖、分化、形态结构及再生等特性;LIF可通过高效抑制干细胞的自发分化维持干细胞多潜能的表型;而bFGF与LIF配合可促进FLSCs增殖分裂且不分化。EGF通过广泛的生物学效应,促进细胞生长繁殖、加速细胞新陈代谢;人重组胰岛素是无血清哺乳动物细胞培养基中的普遍添加物质,其通过促进糖和氨基酸转运,提高合成代谢降低分解代谢,从而刺激细胞生长。血清和血清替代物与细胞生长因子之间如何相互作用促进FLSCs增殖的机制还有待进一步研究。
ABCG2作为ATP结合盒(ABC)转运蛋白的成员,在干细胞中广泛表达,研究发现其具有侧群表型[24],被认为是干细胞的通用标记[25]。ABCG2在角膜缘干细胞[26-27]、造血干细胞[28]、胚胎干细胞[29]、神经干细胞[30]等多种干细胞中广泛表达。因此,本研究首先使用ABCG2对分离的细胞进行了干细胞鉴定,结果显示,3种方法分离的干细胞形态的细胞ABCG2蛋白均为阳性表达,为后续研究奠定了基础。
p63是一种核转录因子,近几年,作为LSCs的阳性标志物对角膜缘上皮细胞及培养细胞进行鉴定[31-32]。研究发现,p63广泛表达于角膜缘的基底部,而在角膜缘表层上皮和角膜中央上皮层却未见表达,可作为LSCs的阳性标志物[33]。波形蛋白(vimentin)是间质细胞中最丰富的蛋白质[34]。波形蛋白表达于角膜缘上皮基底细胞中,其常与其他生物标志物用于识别LSCs[35]。本研究使用细胞免疫荧光检测FLSCs的波形蛋白和p63表达情况,结果表明,培养的细胞均呈阳性表达,表明本研究筛选与分离培养的细胞为FLSCs。
CK3和CK12是表达于细胞质的角蛋白,被认为是角膜上皮分化的标记物。Schermer等[36]早在1986年利用CK3对兔角膜缘部位细胞染色,发现CK3在角膜缘的基底细胞层中未见表达,而角膜中央部位则全层表达。CK12作为角膜上皮特异性标记物,除角膜缘基底细胞外,其存在于整个角膜上皮。因此CK和CK12被广泛认为是在角膜上皮细胞、角膜缘上基底层细胞中特异性表达,而不在角膜缘基底细胞中表达[27]。这些研究证明,CK3和CK12可作为LSCs的阴性标志物。本研究分离培养的的细胞中,CK3与CK12均为阴性表达,表明本研究所分离培养的细胞并非分化的角膜上皮细胞。4种标志物双向验证本研究分离培养的细胞为FLSCs。
4 结 论
本研究首次成功对FLSCs进行了采集、分离、体外培养与鉴定,并筛选出了最优的分离与培养体系,为进一步使用FLSCs治疗猫相关角膜疾病提供了坚实的理论基础,也为其他动物LSCs的分离、培养与鉴定提供了参考依据。
