2020—2022年湖北省生猪屠宰场伪狂犬病病毒的分离鉴定及遗传进化分析
2023-07-31陈宏建甘荣萱宋文博喻盛炜赵艳霞魏春燕
陈宏建,曹 艳,樊 杰,甘荣萱,宋文博,喻盛炜,杨 婷,赵艳霞,魏春燕,谢 锐,华 琳,彭 忠,3,吴 斌*
(1.华中农业大学动物医学院农业微生物学国家重点实验室,武汉 430070;2.生猪健康养殖协同创新中心,武汉 430070;3.湖北洪山实验室,武汉 430070)
猪伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起的一种可感染多种哺乳动物的病毒性传染病[1-3]。PRV唯一的自然宿主是猪[4],其最主要的危害是引起母猪繁殖障碍,育肥猪呼吸系统疾病,幼龄仔猪神经症状甚至死亡[5-6],且PRV会在耐过猪的神经系统中建立可重新激活的潜伏感染,严重影响了养猪业健康发展[7]。特别是自2017年以来在中国已经报道了26例人感染PRV的病例,并在1起急性人类脑炎病例中分离出1株PRV,说明PRV已经开始危害人类公共卫生安全,净化刻不容缓[8-10]。
PRV是属于α疱疹病毒亚科、水痘病毒属的双链DNA病毒,核苷酸全长约143 kb,含有70多个开放阅读框(ORF),可编码100多种蛋白质,因其基因组平均G+C含量高达74%,所以很难进行全基因组测序[11-12]。根据gC基因的差异,可将PRV分为基因Ⅰ型毒株和基因Ⅱ型毒株[13]。2011年以来,在免疫过Bartha-K61猪场再度暴发了变异PRV,与经典毒株相比,其拥有更强的传播能力和致病性,一些主要的毒力基因和抗原区域都发生了变异,因此很难通过疫苗免疫进行有效控制[14-16]。2017年至今已有5例在自然选择压力下疫苗毒与野毒发生基因重组的报道,说明对PRV变异情况进行长期监测至关重要[17-20]。
虽然gE基因缺失疫苗及配套的野毒鉴别诊断方法已经被广泛应用[21-22],但是近几年对中国PRV流行病学调查结果显示不同省份PRV抗体平均阳性率为29.52%(河南30.14%,河北46.27%,湖南23.55%,云南31.37%,黑龙江16.3%),病原平均阳性率为8.27%,提示PRV净化一直没有实现[23-27]。2018年ASFV在我国暴发以后,使中国养猪业布局重组,影响了生猪调运和屠宰加工分布,同时也影响了对猪场其他疫病的免疫和监测工作[28],因此在此情况下进行PRV流行情况监测非常困难。为解决此问题,本研究在2020—2022年湖北省不同地区的屠宰场分别采集血液和肺样品,进行PRV流行情况调查,同时对分离出的PRV进行全基因组测序和系统发育分析,以了解PRV流行分布和遗传变异规律。
1 材料与方法
1.1 样品采集与处理
2020—2022年,根据不同区域生猪养殖规模,从湖北省4个地理区域(鄂东:武汉市、鄂州市、黄冈市、咸宁市、黄石市;鄂北:襄阳市;鄂西:宜昌市;鄂中:孝感市、荆州市)不同规模的屠宰场按比例采集1 795份血液样品和2 081份肺样品(图1)。血液样品静置后收集血清用于PRV-gE抗体检测,肺组织样品研磨后于-80 ℃冻融3次,取上清保存。

图1 湖北省不同地理区域PRV检测样品采集Fig.1 Samples collection for PRV detection from different geographical regions in Hubei province.
1.2 血清学检测
血清样品恢复至室温后使用商品化ELISA试剂盒(IDEXX,Westbrook,ME,USA)对野毒感染产生的PRV-gE抗体进行检测。根据说明书进行试验操作和结果判定,检出的可疑值进行重复测定。
1.3 病原检测
使用商品化DNA/RNA提取试剂盒(Vazyme,Nanjing,China)提取组织上清液中的DNA。以此DNA为扩增模板,按照伪狂犬病诊断方法国家标准GB/T 18641—2018中规定的引物、体系和程序进行PCR扩增。凝胶电泳出现与预期条带(368 bp)大小相符的即为阳性。
1.4 病毒分离培养和全基因组测序
将“1.3”中检出的阳性样品上清通过0.22 μm滤器(EMD Millipore,Billerica,MA,USA),再接种到长满单层的PK-15细胞中。在37 ℃,5% CO2培养箱中孵育2 h后更换为含2%胎牛血清(Gibco,USA),0.1%青链霉素的DMEM(Gibco,USA)培养基。每日观察细胞状态,当感染48 h左右或有80%细胞出现病变(CPE)时收集细胞培养物。冻融3次后进行下一次传代培养。分离出的病毒进行空斑纯化,用Reed-Muench法测定病毒的TCID50,并用“1.3”的方法进行鉴定。
继续使用试剂盒提取纯化后病毒的基因组并将样品邮寄至武汉百易汇能生物科技有限公司进行全基因组测序。
1.5 遗传进化分析
从NCBI GenBank 下载来自全球不同物种的PRV参考序列(表1),分别整理参考毒株和本研究分离毒株的gB、gC、gE基因序列。使用MEGA X中的Cluster W进行序列对比,进行model text后选择最大似然法(ML)构建系统发育树(1 000 bootstrap replications)[29]。使用DNAstar中的Megalign对参考毒株和分离株gB、gC、gE基因推导的氨基酸序列进行同源性分析(Lasergene DNAStar)。

表1 本研究引用的PRV参考毒株序列Table 1 PRV strains referenced in this study
2 结 果
2.1 2020—2022年湖北省PRV血清学阳性率与病原检出率分析
本研究在湖北省4个地理区域的屠宰场都进行了采样,共计21次。根据每批屠宰数量、屠宰场自动化程度和猪来源将屠宰场分为了4个等级,不同等级的屠宰场设置不同的抽样比例(表2)。对屠宰场进行猪来源调查时发现除各别散养农户外,其余猪场都进行了PRV弱毒疫苗或灭活疫苗的免疫。

表2 屠宰场等级分类标准及抽样比例Table 2 The classification standard of grade and sampling proportion of pig slaughterhouses
在本研究收集的1 795份血清中,共检出PRV-gE抗体阳性104份,平均阳性检出率为5.79%。在收集的2 081份组织样品中,共检出PRV-gE病原阳性82份,平均阳性检出率为3.94%。对与PRV相关的季节、区域和屠宰场规模因素进行评估(图2)。结果发现在本研究中PRV的感染率出现了季节差异,抗体和病原都在春季检出率最高,分别为18.57%(57/307)和9.74%(37/380)。抗体和病原分别在夏季(2.67%,13/486)和秋季(2.11%,16/757)检出率最低,符合PRV的流行特征。湖北省不同区域的PRV感染率存在较大差异,湖北省东部的抗体检出率最高,达到了10.77%(84/780),在西部未检出抗体阳性。湖北省中部的病原检出率最高,为4.93%(28/568),北部的病原检出率最低,为1.54%(5/324)。从屠宰场规模看,A类小型屠宰场的PRV抗原和抗体检出率都显著高于其他3个类型,分别为16.28%(49/301)和6.01%(23/383)。抗体和病原分别在B类(2.64%,12/454)和D类(0.82%,5/613)屠宰场中检出率最低。
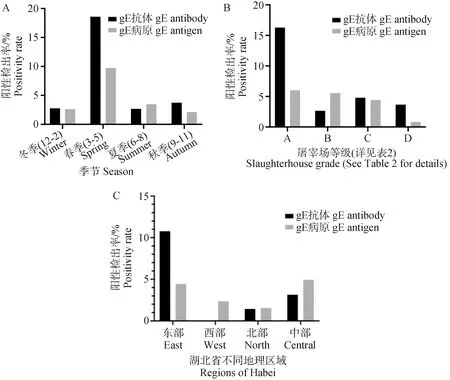
图2 不同季节(A)、屠宰场类型(B)和地理位置区域(C)的PRV-gE抗体及病原阳性检出率Fig.2 Positivity rate of PRV-gE detection in different seasons (A), slaughterhouse(B) and geographical regions (C)
2.2 PRV病毒分离
为进一步研究湖北省近2年PRV遗传变异情况,本研究对检出PRV病原阳性的组织样品进行病毒分离鉴定。结果成功分离到可在PK-15细胞上稳定传代的PRV毒株17株,分离率为20.7%(17/82)。根据采样地区和采样时间对毒株进行了命名。用Reed-Muench法测定这些毒株的TCID50为(106.39~107.55)·0.1 mL-1。提取病毒的基因组进行全基因组测序,结果显示,这些毒株的全基因组长度介于142 735~160 216 bp,GC含量为71%~73%,符合PRV的基因组结构特征(表3)。

表3 本研究分离的PRV毒株Table 3 PRV strains isolated in this study
2.3 系统发育与同源性分析
将本研究分离的17株PRV与NCBI下载的28株参考毒株的全基因组和gB、gC、gE基因进行遗传进化分析(图3)。结果显示,在4种系统发育树中,本研究分离的17株PRV均属于基因Ⅱ型变异株,与2012年以来国内分离的变异株处于同一演化分支。值得注意的是,HBXG-2020-1~5与HuB1/CHN2017(GenBank登录号:MK682670)在基因Ⅱ型毒株中位于一个独立的演化分支(图3)。

2.4 PRV gB、gC、gE基因分析
将本研究分离的17株PRV与NCBI下载的28株参考毒株的gB、gC、gE基因核苷酸序列推导为氨基酸序列,通过DNAStar中的Megalign软件进行同源性分析(表4)。

表4 PRV分离株的gB、gC和gE基因推导的氨基酸与其他毒株的同源性分析Table 4 Amino acids similarity analysis of the gB, gC and gE of PRV strains isolated in this study %
结果显示,本次分离的毒株gB、gC、gE基因都与国外分离的基因Ⅰ型毒株相似性最低,分别达到97.3%、92.8%和96.4%。与2012—2019年分离的基因Ⅱ型毒株相似性最高,最高值都达到了100%。其中,gC基因的差异性最大,这与该基因的多变性有关。值得注意的是,HBXG-2020毒株的gC基因与NIA3、Kaplan、Becker、Bartha-K61等国外早期分离株的同源性明显高于其他分离株。
3 讨 论
PR自从1947年首次在我国被报道以来,在我国经历了2个流行时期。20世纪80年代后期,我国通过使用匈牙利引进的Bartha-K61弱毒疫苗已经基本控制了PR的流行[30]。2011年底,在免疫过疫苗的猪群又暴发了PRV变异株导致的新一轮流行[13]。虽然我国一直在进行PR净化工作,但变异PRV至今仍在猪场中流行,因此应持续推进该病的净化根除工作。
本研究检测到湖北省PRV的感染抗体阳性率为5.79%,与之前学者的研究结果一致[23-27],说明湖北省存在PRV持续感染,但感染率少于其他省份。由于组织样品难以按比例采集,关于PRV病原阳性检出率的报道较少,Sun等[24]研究表明2012—2017我国平均PRV病原阳性率为8.27%,华中地区为10.9%,结合本研究的3.94%,可能由于健康屠宰肥猪的带毒率低于其他猪群的带毒率,也说明对ASFV防控加强猪场生物安全建设的措施对其他疫病的防控也有一定效果。
本研究结果显示PRV感染抗体和病原都在春季检出率最高,这与PRV的理化特性有关,符合PRV的流行规律。从地理区域看在湖北省东部地区总体检出率最高,西北部地区总体检出率较低。结合当地养殖规模,发现西北部地区主要是开展了PRV净化的规模化猪场及其提供阴性猪的辐射猪场;东部地区规模较小的养殖场偏多,存在较多生猪转运活动。从屠宰场规模看A类小型屠宰场总体检出率最高,可能与其关联的主要是小型养殖场和散户,PRV净化程度低和ASFV防控措施不到位等因素有关[31]。
为了掌握伪狂犬病病毒的致病机制和突变机制,近年来,对流行毒株基因组进行了深入研究。发现gB是PRV主要的免疫原性蛋白,能产生中和抗体[32],gC基因是公认的PRV基因分型靶标[13],gE基因是主要毒力基因[33],而且不同基因型的gB、gC、gE之间存在较大差异[34]。此外,潜伏感染是PRV净化的难点,它不是由单个基因决定,而是与多个因素相关,如即时早期基因IE180、早期基因EP0和潜伏的侵染相关转录本LAT等[35]。因此本研究对分离株进行了gB、gC、gE和全基因组的遗传进化分析。结果表明,湖北省主要流行的是基因Ⅱ型毒株,与2012年以来国内分离的毒株处于同一系统发育分支。值得注意的是,在所有的基因Ⅱ型毒株中,HBXG-2020-1~5与HuB1/CHN2017位于一个相对独立的遗传进化分支,而在我们之前的研究中,HuB1/CHN2017为Ⅰ型毒株和Ⅱ型毒株产生的重组毒[18]。值得一提的是,HBXG-2020-1~5所展现出的遗传进化特征与国内其他团队所报道的PRV重组毒株的一致[17]。而gC蛋白的氨基酸序列分析亦显示HBXG-2020的gC基因与Bartha-K61等早期国外分离株有很高的同源性。上述结果均提示HBXG-2020可能为重组病毒。在下一步研究中,作者将基于全基因组序列开展生物信息学分析予以确认。由于本研究受到新冠疫情和ASFV影响,采样时间和地点受到一定限制。因此结合各地防疫政策,生猪运输和养殖屠宰规模情况制定了采样计划,从而使数据更有代表性。
4 结 论
本研究调查了2020—2022年湖北省屠宰场肥猪中PRV抗体和病原的流行情况和遗传变异规律。结果表明在湖北省屠宰场辐射的猪场中PRV依然流行,但阳性率有所降低。遗传进化分析表明,本研究分离的17株PRV均属于基因型Ⅱ毒株。本研究有利于后续对湖北省PRV流行情况的评估,也提示要持续对PRV进行监测和新疫苗研发。
