芦丁对围产期湖羊瘤胃发酵、瘤胃菌群结构及抗氧化性能的影响
2023-07-31熊程坤张道亮丁红研王希春冯士彬汤继顺吴金节
熊程坤,张道亮,杨 悦,丁红研,赵 杰,李 玉,王希春,冯士彬,赵 畅,汤继顺,吴金节*
(1.安徽农业大学动物科技学院,合肥 230061;2.安徽省农业科学院畜牧兽医研究所,合肥 230031)
随着羊养殖业规模化的迅速发展,保障母羊健康,提高母羊繁殖效率是羊养殖业发展的重点。在母羊整个繁殖期中,围产期是非常重要的阶段。在围产期间,由于胎儿生长、泌乳启动和乳汁生产等诸多因素,母畜对能量的需求急剧增加,与此同时,母畜的采食量却急剧下降,不能满足机体对营养物质的需求,使母畜出现能量负平衡(negative energy balance, NEB),其诸多机能出现了变化,如瘤胃功能、营养的代谢和免疫力等[1]。除此之外,当围产期母畜处于NEB时,为维持自身及胎儿生长等生理需求,机体代谢增强,母畜体内生成大量活性氧(reactive oxygen species, ROS)和脂质过氧化物,而母畜机体抗氧化能力有限,过量的ROS和脂质过氧化物在体内蓄积,会令母畜处于氧化应激状态。因此,维持围产期母羊正常的瘤胃功能,提高免疫力,对于保障围产期母羊机体健康,实现母羊高效繁殖至关重要。
芦丁(rutin)是一种黄酮苷,广泛存在于植物中,也可被称为维生素P、芸香苷[2-3]。芦丁在动物生产应用中已成为一种潜在的绿色饲料添加剂[4]。现有研究表明,芦丁不仅在清除O2-·自由基中起到重要作用,通过干扰还原型烟酰胺嘌呤二核苷酸磷酸氧化酶4(Nox 4)和活性氧簇(ROS)敏感的NLRP3炎症小体来保护内皮功能障碍;抑制枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌的生长过程等[5-7]。朱安南等[8]发现,饲料中添加芦丁在增加蛋壳厚度的同时,提高了蛋清凝胶的胶性、回复性以及起泡性等特性。陈密等[9]发现,芦丁使草鱼粗蛋白含量增加,在降低肝丙二醛(MDA)含量的同时,提高了过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、胰蛋白酶(PRS)与肠道淀粉酶(AMS)的活性。此外,奶牛饲喂含有芦丁的饲粮能够降低瘤胃液中氨态氮(NH3-N)以及原虫蛋白浓度,提高挥发性脂肪酸(VFA)的含量与菌体蛋白的浓度,改善泌乳性能[10]。
目前,芦丁在羊围产期生产中的应用尚未报道,本试验旨在研究饲粮中添加芦丁对围产期湖羊瘤胃发酵、瘤胃菌群结构及抗氧化性能的影响,为芦丁在羊围产期生产中的应用提供试验依据。
1 材料与方法
1.1 试验设计及饲养管理
本试验于马鞍山市金农牧业有限公司进行。选择30只围产期相近、体重[(62.90±2.80) kg]相似的24月龄围产期湖羊,随机分为3组,每组10个重复,分2栏饲养。CON组饲喂基础饲粮,Ⅰ组与Ⅱ组分别在基础日粮中按照50 mg·kg-1BW和100 mg·kg-1BW添加芦丁。精料每日每只母羊300 g,完全采食完毕,粗料每日每只母羊2~2.5 kg,精料和粗料营养水平见表1。将芦丁与精料混匀后,于晨饲先喂,然后再喂粗料。预试期7 d,正式试验期56 d,为产前28 d至产后28 d。试验期间,自由采食、饮水。其他饲养管理按照养殖场规定进行。
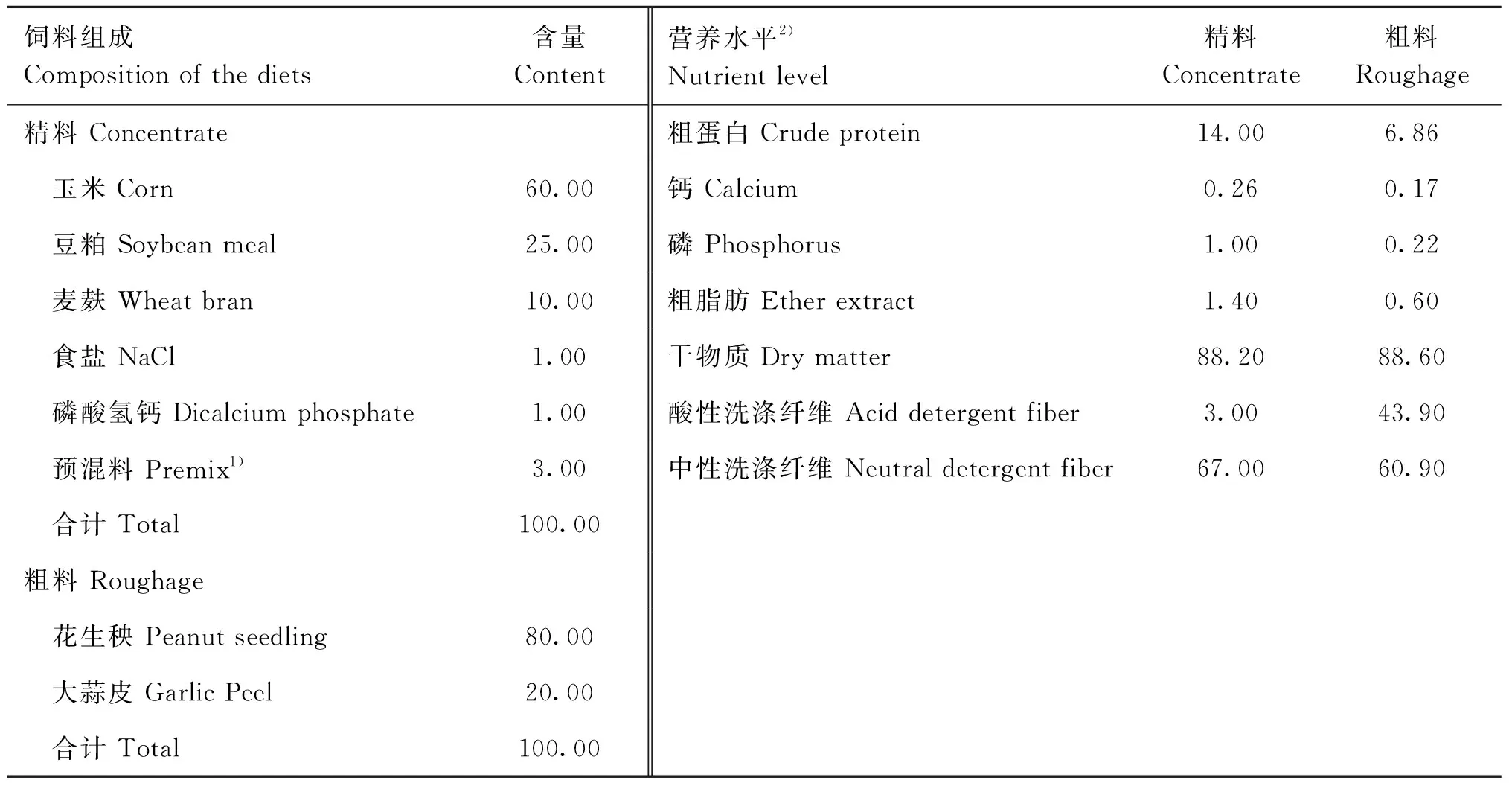
表1 饲料组成及营养水平Table 1 Composition and nutrient levels of the diet %
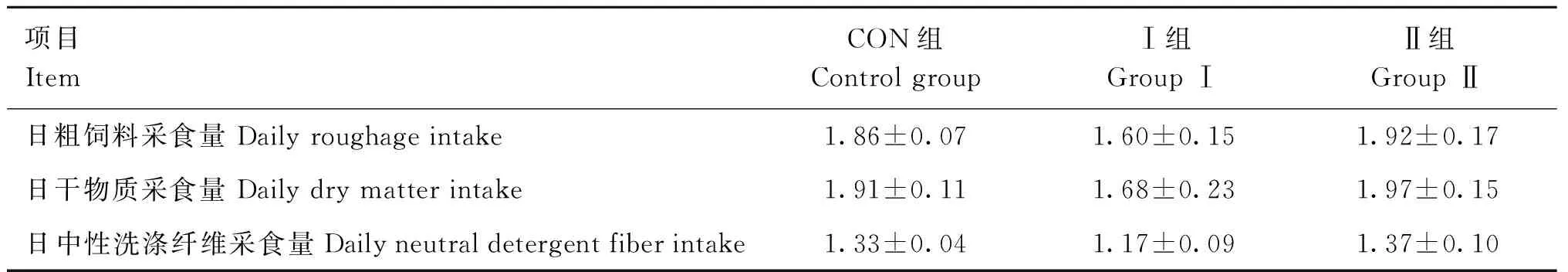
表2 芦丁对围产期湖羊采食量的影响Table 2 Effect of rutin on perinatal feed intake of Hu sheep kg·(d·只)-1
1.2 试验材料
试验所用芦丁购自青岛泰东制药有限公司,纯度≥95%;MDA含量、T-AOC、SOD、CAT和GSH-Px活性酶联免疫吸附试验(ELISA)试剂盒均购自上海酶联生物科技有限公司。
1.3 指标测定
1.3.1 平均采食量 每次饲喂前,统计各组当日饲喂粗料量和前日剩余粗料量,计算各组每只羊的日粗饲粮采食量。在饲粮营养水平测定后,依据干物质和中性洗涤纤维含量计算每只羊的日干物质采食量和日中性洗涤纤维采食量。
1.3.2 生长性能 正式试验期开始、结束及产羔后对围产期湖羊进行称重,计算围产期湖羊从生产日至正试期结束这一时期的总增重(TWG)、平均日增重(ADG)。产羔时统计产羔数量及羔羊体重。
1.3.3 瘤胃组织形态 于产后28 d晨饲前,每组随机选取5只羊进行屠宰采样。屠宰后立即分离出瘤胃,用灭菌剪刀剪开瘤胃,取2 cm2左右瘤胃背囊组织,放置于10%福尔马林溶液中保存。24 h后,通过石蜡包埋切片(8 μm)、染色、封片,使用数字切片扫描仪对瘤胃背囊组织切片进行扫描,使用CaseViewer软件测量瘤胃乳头的长度、宽度和瘤胃肌层的厚度。
1.3.4 抗氧化指标 瘤胃液过滤后按照3 000×g离心10 min,取出上清液在-20 ℃中储存。瘤胃液中的MDA含量、SOD、T-AOC、GSH-Px和CAT活性按照ELISA试剂盒说明书进行测定。
1.3.5 瘤胃发酵参数 随机选取3个位点抽取300 mL瘤胃液,置恒温盒内保存,混合均匀后取100 mL,立即用pH-200数显笔式酸度计直接测定瘤胃液的pH。
过滤瘤胃液后准确量取30 mL,添加10 mL 20%的偏磷酸,-20 ℃保存。通过苯酚-次氯酸钠比色法测定瘤胃液氨态氮(NH3-N)浓度[11]。
准确量取过滤后的瘤胃液40 mL,封盖,冷冻保存。用三氯醋酸(TCA)沉淀蛋白法测定瘤胃液微生物蛋白浓度[12]。
过滤后的瘤胃液量取40 mL,加入0.5 mL 3.6 mol·L-1的H2SO4溶液(现配现用),封盖,摇匀,-20 ℃保存。采用气相色谱法测定瘤胃液挥发性脂肪酸(VFA)浓度[13]。
1.3.6 瘤胃菌群结构 采集50 mL瘤胃液,用于瘤胃菌群的测定。将瘤胃液送至苏州帕诺米克生物医药科技有限公司进行基因组测序;利用Agilent Bioanalyzer进行数据质量检测,利用DADA2方法进行序列去噪,利用QIIME2软件进行菌群分类,并进行丰度估算。
1.4 数据处理与统计分析
试验所有数据均使用Excel软件进行初步整理,使用SPSS 19.0软件对整理后的试验数据进行单因素方差分析,Duncan’s法进行多重比较,数据以“平均值±标准误(Mean±SE)”的形式表现,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。
2 结 果
2.1 芦丁对围产期湖羊采食量的影响
各组围产期湖羊精料均完全采食完毕。如表1所示,各组围产期湖羊日粗饲料采食量无显著差异(P>0.05),日干物质采食量和日中性洗涤纤维采食量差异也均不显著(P>0.05)。饲粮中添加芦丁未显著性改变围产期湖羊的采食量。
2.2 芦丁对围产期湖羊生长性能的影响
如表3所示,试验开始时各组围产期湖羊体重无显著差异(P>0.05);在数值上,2个试验组的产后体重、末体重(final body weight, FBW)和ADG均高于CON组,但差异不显著(P>0.05)。各组围产期湖羊的产羔数量及羔羊体重无显著性变化(P>0.05)。饲粮中添加芦丁对围产期湖羊生长性能无显著性影响。
2.3 芦丁对围产期湖羊瘤胃组织形态的影响
如表4和图1所示,Ⅱ组瘤胃乳头长度较CON组显著增加(P<0.05),乳头宽度和肌层厚度较CON组无显著差异(P>0.05);相比于Ⅰ组,CON组和Ⅱ组各指标差异不显著(P>0.05)。

图1 不同芦丁添加量下围产期湖羊瘤胃乳头结构的显微变化(32×)Fig.1 Microscopic changes in the structure of rumen papillae in periparturient Hu sheep at different rutin addition levels(32×)

表4 芦丁对围产期湖羊瘤胃组织形态的影响Table 4 Effect of rutin on rumen histomorphology in perinatal Hu sheep μm
2.4 芦丁对围产期湖羊抗氧化性能的影响
由表5可知,与CON组相比,Ⅰ组围产期湖羊瘤胃液中GSH-Px和CAT活性升高(P<0.05),其他抗氧化指标无显著差异(P>0.05);与Ⅱ组相比,Ⅰ组瘤胃液中MDA含量显著降低(P<0.05),SOD、CAT活性和T-AOC水平均升高,且差异显著(P<0.05),GSH-Px活性极显著升高(P<0.01);CON组和Ⅰ组之间各抗氧化指标无显著差异(P>0.05)。

表5 芦丁对围产期湖羊抗氧化性能的影响Table 5 Effect of rutin on antioxidant performance of perinatal Hu sheep
2.5 芦丁对围产期湖羊瘤胃发酵的影响
从表6可知,与CON组相比,Ⅱ组围产期湖羊瘤胃液中NH3-N浓度显著降低(P<0.05),微生物蛋白浓度极显著升高(P<0.01),微生物蛋白中的原虫蛋白和菌体蛋白浓度均显著升高(P<0.05),瘤胃液中乙酸、丙酸、戊酸和TVFA浓度均显著升高(P<0.05);与Ⅰ组相比,Ⅱ组瘤胃液中微生物蛋白浓度显著升高(P<0.05),其中原虫蛋白浓度较高(P<0.05),细菌蛋白浓度无显著差异(P>0.05)。CON组与Ⅰ组之间各指标差异不显著(P>0.05)。
2.6 芦丁对围产期湖羊瘤胃菌群结构的影响
2.6.1 芦丁对围产期湖羊瘤胃细菌门水平结构分析 由表7和图2可知,CON组和Ⅰ组围产期湖羊瘤胃细菌第一优势菌门为厚壁菌门(Firmicutes),第二优势菌门为拟杆菌门(Bacteroidetes);Ⅱ组第一优势菌门为拟杆菌门,第二优势菌门为厚壁菌门。Ⅱ组厚壁菌门相对丰度显著低于CON组和Ⅰ组(P<0.05);Ⅱ组拟杆菌门相对丰度显著高于CON组和Ⅰ组(P<0.05);Ⅱ组螺旋体门(Spirochaetes)相对丰度显著低于CON组(P<0.05)。

图2 不同芦丁添加量下围产期湖羊瘤胃细菌在门水平上的分布图Fig.2 Distribution of rumen bacteria at the phylum level in perinatal Hu sheep with different rutin additions
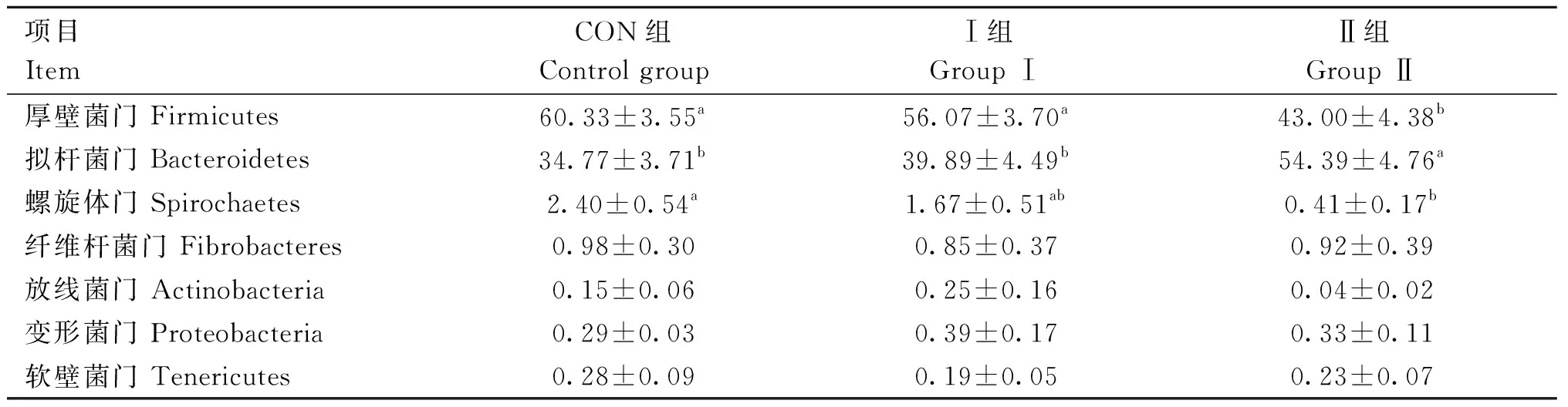
表7 芦丁对围产期湖羊瘤胃细菌门水平的影响Table 7 Effect of rutin on rumen bacterial phylum levels in perinatal Hu sheep %
2.6.2 芦丁对围产期湖羊瘤胃细菌属水平结构分析 由表8和图3可知,各组围产期湖羊瘤胃细菌的优势菌属为普雷沃菌属(Prevotella);Ⅱ组普雷沃菌属相对丰度极显著高于其他两组(P<0.01);Ⅰ组普雷沃菌属相对丰度显著高于CON组(P<0.05);Ⅱ组密螺旋体属(Treponema)相对丰度显著低于CON组(P<0.05);Ⅱ组解琥珀酸菌属(Succiniclasticum)相对丰度显著高于Ⅰ组(P<0.05)。
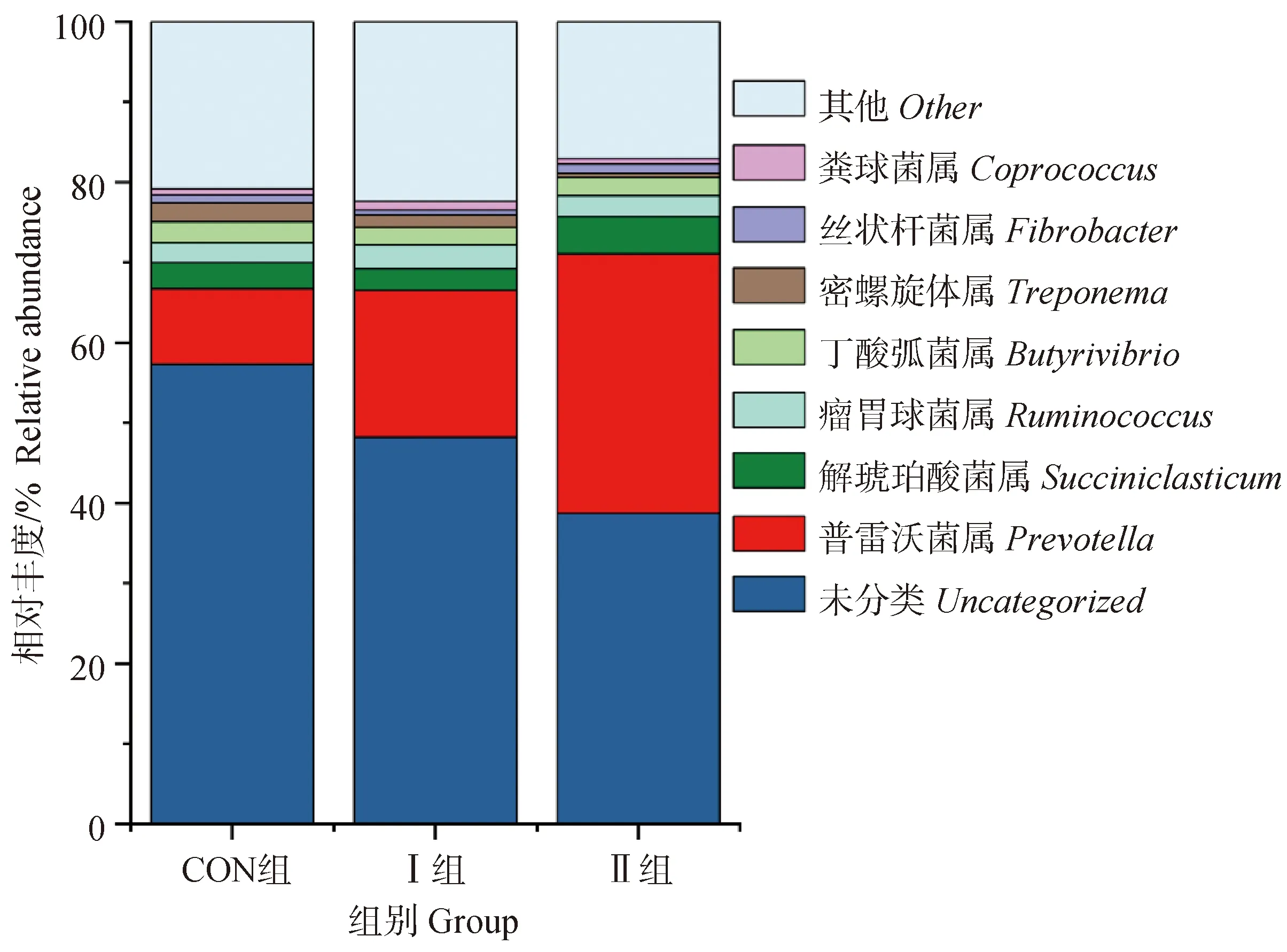
图3 不同芦丁添加量下围产期湖羊瘤胃细菌在属水平上的分布图Fig.3 Distribution of rumen bacteria at the genus level in perinatal Hu sheep with different rutin additions
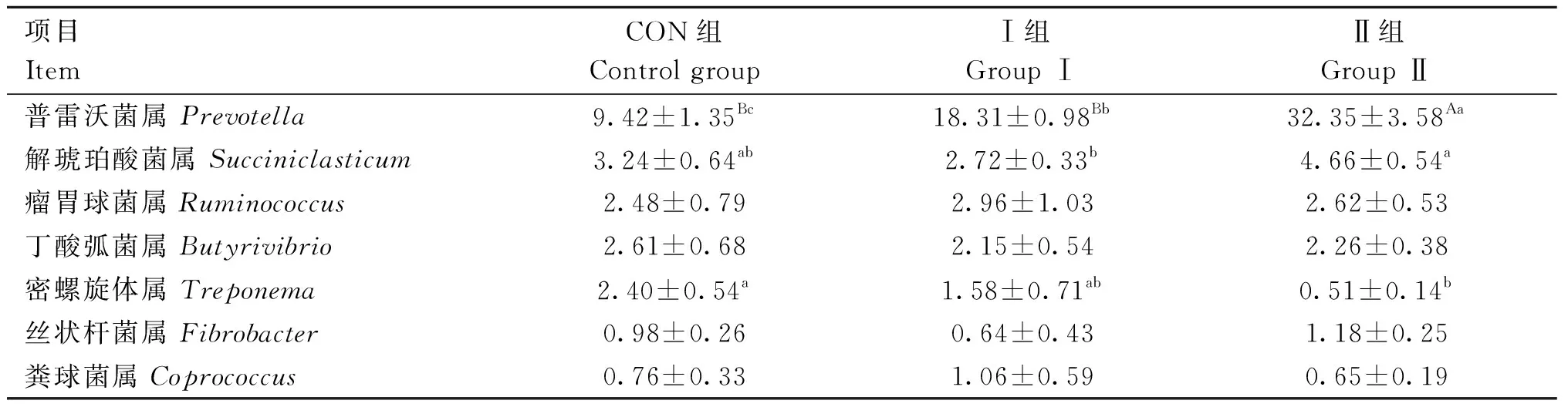
表8 芦丁对围产期湖羊瘤胃细菌属水平的影响Table 8 Effect of rutin on rumen bacterial genus levels in perinatal Hu sheep %
3 讨 论
3.1 芦丁对围产期湖羊采食量和生长性能的影响
母羊在围产期内对能量的需求增加,机体多机能发生变化,因此保障围产期母羊健康生长至关重要,也是保障围产期母羊高效繁殖的前提。研究表明,黄酮类物质不仅具有抗炎和抗氧化的能力,还能够改善消化[14]。杨仕群等[15]研究发现,竹叶黄酮能够促进蓝孔雀的消化吸收能力,提高饲料转化率,提高孔雀的生长性能。本试验条件下,Ⅰ组围产期湖羊采食量低于CON组和Ⅱ组,但各组围产期湖羊采食量和生长性能均无显著性差异,推测是个体差异引起的采食量变化。本试验结果表明,日粮中添加芦丁不影响围产期湖羊的采食量,能够维持围产期湖羊健康的生长性能。
3.2 芦丁对围产期湖羊瘤胃组织形态的影响
瘤胃发育程度可以通过瘤胃乳头的长度、宽度以及肌层厚度进行评估[16]。瘤胃乳头在瘤胃壁上致密分布,增大了瘤胃壁与内容物的接触面积,进而在营养物质的消化与吸收中发挥了促进作用。此外,瘤胃乳头有利于瘤胃上皮吸收养分及离子转运[17]。本试验结果表明,日粮中添加100 mg·kg-1BW芦丁能显著提高围产期湖羊瘤胃乳头长度,提示日粮中添加芦丁能够改善围产期湖羊瘤胃乳头形态。研究表明,芦丁可提高奶牛瘤胃乙酸和丙酸浓度[10]。沙葱黄酮类化合物可显著提高绵羊瘤胃VFA浓度[18]。有机酸能够刺激瘤胃乳头发育,尤其是VFA,乙酸、丙酸和丁酸对其刺激强度依次增强,这与VFA在瘤胃壁组织内的代谢保持一致[19]。以上结果表明日粮中添加芦丁对围产期湖羊瘤胃组织形态有改善作用。
3.3 芦丁对围产期湖羊抗氧化性能的影响
动物机体的健康与其抗氧化性能密切相关,当机体氧化还原状态失衡,将使细胞过度氧化,从而导致细胞代谢及功能障碍[20]。MDA是评价动物体内脂质氧化损伤程度的重要指标[21]。SOD是动物体内一种重要的抗氧化物金属酶,在氧化平衡系统上起着关键的作用,可以有效地清除机体内的超氧阴离子,避免细胞损伤[22]。机体内的自由基清除依赖于GSH-Px与SOD相互协调。SOD在清除氧离子链式反应中生成CAT,能够有效维持机体内的氧化平衡[23-24]。T-AOC能够综合反映机体的抗氧化能力[25]。越来越多的证据证实,源自蔬菜、水果和药用植物的黄酮类通过自由基清除活性影响细胞的生长、分化及其功能,对人们的健康、防病治病起着重要作用[26]。芦丁因其结构含有丰富的酚羟基,能够产生较稳定的苯氧自由基,进而中止链式反应。此外,机体内自由基结合活泼氢,清除机体内过多的ROS,这可能是其提高抗氧化功能,保护机体避免氧化损伤的重要原因之一[27-28]。本试验结果表明,饲粮中添加50 mg·kg-1BW的芦丁能够显著提高围产期湖羊瘤胃内GSH-Px和CAT活性,与此同时,在对围产期湖羊血清中抗氧化酶活性的研究中也发现,饲粮中添加50、100 mg·kg-1BW的芦丁能够降低围产期湖羊血清中过氧化氢(H2O2)和MDA水平,提高血清中CAT、GSH-Px、SOD和T-AOC活性[29]。提示饲粮中添加芦丁能够提高围产期湖羊瘤胃抗氧化性能。
3.4 芦丁对围产期湖羊瘤胃发酵的影响
大量研究表明,反刍动物体内最主要的消化器官是瘤胃,在整个生长过程中起到了积极作用[30]。瘤胃液pH是反应瘤胃内环境稳态及衡量瘤胃发酵的一个重要指标,当瘤胃液pH处于6.2~7.0时,能够维持瘤胃的正常发酵[31-32]。本试验结果表明,各组之间围产期湖羊的瘤胃液pH无显著差异,均在6.2~7.0内,能够为瘤胃微生物提供适宜的生长环境。Oskoueian等[33]研究表明,高达4.5%添加水平的黄酮也不会对瘤胃pH产生显著性影响,与本试验结果相似。反刍动物瘤胃内微生物能够产生VFA和微生物蛋白,机体所需能量部分来自于此[34]。包玲玲等[18]发现,沙葱黄酮可以显著降低绵羊瘤胃NH3-N的浓度。郭旭东[10]研究表明,芦丁可降低奶牛瘤胃中NH3-N的浓度,增加乙酸、丙酸和TVFA的浓度。本试验结果表明,饲粮中添加100 mg·kg-1BW芦丁能够降低围产期湖羊瘤胃液中NH3-N的浓度,提高微生物蛋白的浓度,可能是芦丁刺激瘤胃微生物菌群摄取NH3-N并合成蛋白质引起的;饲粮中添加100 mg·kg-1BW芦丁还能提高乙酸、丙酸、戊酸和TVFA的浓度,在后续的研究中可知添加100 mg·kg-1BW芦丁可促进围产期湖羊瘤胃内乙酸、丙酸生成菌的生长,有助于其对饲粮中碳水化合物的发酵与分解;并且芦丁并没有改变围产期湖羊的发酵类型,仍然是乙酸型发酵,甚至提高了乙酸的生成量。综上所述,饲粮中添加适量的芦丁能够改善围产期湖羊的瘤胃发酵状况。
3.5 芦丁对围产期湖羊瘤胃菌群结构的影响
瘤胃是反刍动物消化养分的重要器官,而瘤胃菌群在消化过程中扮演着重要角色。厚壁菌门和拟杆菌门是反刍动物瘤胃菌群的两大优势菌群[35]。纤维物质与非纤维物质经瘤胃降解后分别产生乙酸和丙酸,厚壁菌门和拟杆菌门分别在降解中发挥着重要作用[36]。拟杆菌门内含量最多的是普雷沃菌属,普雷沃菌属在降解蛋白质和纤维素等营养物质方面发挥着重要作用[37]。瘤胃球菌属、解琥珀酸菌属和密螺旋体属都属于厚壁菌门,均参与纤维素的降解[38]。本试验结果表明,饲粮中添加100 mg·kg-1BW芦丁能够显著增加围产期湖羊瘤胃内拟杆菌门相对丰度、普雷沃菌属相对丰度,与Ⅱ组瘤胃中微生物蛋白、乙酸和丙酸含量显著高于CON组的试验结果相吻合。与CON组相比,Ⅱ组瘤胃内参与纤维素降解和挥发性脂肪酸形成的厚壁菌门和密螺旋体属相对丰度显著降低,却并未阻碍Ⅱ组瘤胃内挥发性脂肪酸的形成,这可能是因为两组瘤胃厚壁菌门中瘤胃球菌属和解琥珀酸菌属等主要纤维素降解菌相对丰度并未发生显著性变化,以及普雷沃菌属相对丰度的增加,提高半纤维素被分解的效率,这与庞凯悦等[39]研究发现相似。与此同时,芦丁的添加水平改变了瘤胃优势菌的组成。现有研究结果表明,槲皮素不仅能够增加断奶仔猪粪便菌群普雷沃菌属数量[40],还能够抑制多种病原菌的生长[41]。可见槲皮素作为芦丁的主要代谢产物,在芦丁对瘤胃菌群结构的调节过程中起着关键作用。综上所述,饲粮中添加芦丁能够加快拟杆菌门细菌以及普雷沃菌属细菌的增殖并定植优势生态位,改善围产期湖羊瘤胃菌群结构。
4 结 论
饲粮中添加芦丁对围产期湖羊瘤胃组织形态有改善作用,能够提高围产期湖羊瘤胃的抗氧化性能,并改善围产期湖羊的瘤胃菌群结构和发酵功能。在本试验条件下,芦丁在围产期湖羊饲粮中的最适添加量为100 mg·kg-1BW。
