基于UPLC-MS/MS的林下三七不同部位生物碱类成分分析
2023-07-30张澳严星茹熊冰杰黄佑国何舒周发金王澍施蕊
张澳 严星茹 熊冰杰 黄佑国 何舒 周发金 王澍 施蕊

摘 要 为了挖掘林下三七地上部分的利用价值,给提高三七资源的综合利用率提供新思路,采用超高效液相色谱和串联质谱法分析了林下三七的果实、叶片、根三个部位的生物碱类成分。结果表明,林下三七果实、叶片和根共检测到53个生物碱类化合物,但各部位总含量不相同,果实>叶片>根;多元统计分析发现果实与根、叶片与根成分差异显著,分别有26个和24个差异化合物,果实中3-吲哚丙酸、甲氧基吲哚乙酸和油酰单乙醇胺的含量较高,叶片中3-羟基吡啶、N-甲基烟酰胺和5-羟基吲哚-3-乙醇的含量较高;筛选得到鉴别果实、叶片、根的生物碱类差异标志物,分别是油酰单乙醇胺、3-羟基吡啶和乙酰色胺。
关键词 林下三七;生物碱类成分;代谢组学;差异化合物;植株部位
中图分类号:S567.23+6 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.09.004
五加科人参属三七[Panax notoginseng (Burk) F. H. Chen]作为云药的代表闻名杏林,《本草纲目》誉之“金不换”“补血第一”,即具备散瘀止血、消肿止痛的功效[1]。近年来云南三七产量全国占比高达98%以上,正逐渐形成种植加工销售一体化的庞大产业体系[2]。国家中医药发展战略提出需要全面提升中药产业发展水平即实现产业转型升级[3],而三七产业转型升级过程发现了一个严重的门槛,三七产品开发深度和广度不足导致三七产值低、产业链短[4-6]。因此,为增加三七产值和延长三七产业链,提高三七资源的综合利用率是十分必要的。
现阶段,三七的研究领域主要集中于三七的传统入药部位根部及其皂苷类成分[7-8],有关三七不同部位和非皂苷类成分的研究较少。三七的果实和叶片作为其生长发育过程中的伴生产物,常常顺应自然凋落腐烂,实际是一种资源浪费。生物碱类成分是植物体内的一类次生代谢产物,根据化学结构可分为吡咯、吡啶、吲哚等十余种[9],具备丰富的生物活性,王腾飞等研究发现其具有抗癌、抗病毒、抗炎和抗菌等多种药理作用,在植物的适应性、抗逆性等方面也发挥着重要作用[10]。因此,为增加三七资源综合利用的多样性,可以从三七不同部位的生物碱类成分入手探尋新思路。
植物代谢组学,是一门采用液相-质谱联用、气相-质谱联用等多种手段全面、高通量对植物化合物进行定量、定性分析的新兴学科[11]。代谢组学方法正逐渐成为应用在药用植物的中药基原鉴别[12]、野生与栽培品的鉴别[13]、药用部位鉴别[14-15]、不同发育期的成分鉴定及不同产地药材的品质差异[16]等方面的有效手段。
本实验采用广泛靶向代谢组学方法对三七的果实、叶片、根的生物碱类成分进行分析,
通过主成分分析(PCA)结合正交偏最小二乘判别分析(OPLS-DA)的方法,筛选三七不同部位的差异化合物,探寻鉴别三七部位的生物碱类标志物,挖掘三七果实、叶片和根部的利用价值,以期为提高三七资源的综合利用率提供新思路。
1 材料与方法
1.1 实验材料
本实验样品林下三七采集于澜沧竹塘(N22.74°,E99.82°,H1 457.39 m),按不同部位分为果实、叶片、根,即三组样品,每组3次生物学重复,样品信息如表1所示。
仪器:超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC)和串联质谱仪(Tandem mass spectrometry,MS/MS);冻干机(Scientz-100F);研磨仪(MM 400, Retsch);离心机;涡旋仪,精密天平。
试剂:甲醇(色谱纯,Merck);乙腈(色谱纯,Merck);标准品(BioBioPha/Sigma-Aldrich);纯水。
1.2 实验方法
1.2.1 样品制备和提取
将林下三七完整植株鲜品真空冷冻干燥成干品,然后分拣成果实、叶片、根三部分,分部位放置研磨仪中研磨成粉末(30 Hz,1.5 min),分装编号成F(果实)、L(叶片)、R(根)备用。精密称定100 mg粉末浸泡于1.2 mL的70%甲醇提取液中,使用借助涡旋仪每30 min涡旋1次,每次30 s,共涡旋6次,然后充分混匀后,放置于4 ℃冰箱冷冻过夜。混合液用离心机离心(12 000 r·min-1)10 min,吸取上清液,用微孔滤膜(0.22 μm)过滤得到滤液,装入进样瓶进样分析。
1.2.2 超高效液相色谱和串联质谱法(UPLC-MS/MS)检测
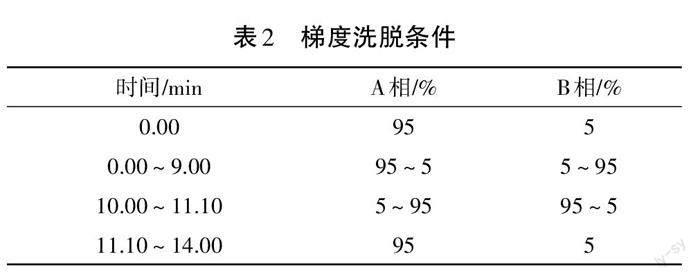
液相条件:采用Agilent SB-C18 1.8?m(2.1 mm×100 mm)的色谱柱进行色谱分离;设置柱温40 ℃,流速0.35 mL·min-1,进样量4 μL;流动相A为加入0.1%甲酸的超纯水,B相为加入0.1%甲酸的乙腈,梯度洗脱条件见表2。
质谱条件:采用三重四极杆线性离子阱质谱仪(Q TRAP)进行质谱分析,配备ESI Turbo离子喷雾接口;涡轮喷雾离子源操作参数设置源温度550 °C,离子喷雾电压(IS)5 500 V(正离子模式)/-4 500 V(负离子模式),离子源气体I(GSI)、气体II(GSII)和帘气(CUR)分别设置为50、60和25.0 psi,碰撞诱导电离参数高。
1.2.3 数据处理
采用UPLC-MS/MS方法获得质谱峰图,利用Analyst 1.6.3软件处理三七样品质谱数据,利用MultiaQuant软件对质谱峰进行积分校正,完成定性定量处理。对通过混合样本检测得到的总离子流图(TIC图)进行重叠展示分析,判断数据的重复性、可靠性和仪器的稳定性。处理后的数据归一化后采用多元统计分析中的主成分分析方法,对庞大复杂的数据进行“简化和降维”,建立PCA得分图,根据各样本组间、组内的分离趋势判断其差异程度。采用正交偏最小二乘法判别分析(OPLS-DA)弥补PCA方法的不足,在原始数据进行log2转换后进行中心化处理,利用R软件中的MetaboAnalystR包OPLSR.Anal函数进行分析,建立OPLS-DA正、负模型,得到OPLS-DA得分图、OPLS-DA S-plo图、VIP(投影中变量重要性)图和聚类热图,使组间区分最大化,筛选出差异化合物。结合PCA分析和OPLS-DA分析,采用VIP值和FC值(差异倍数值)组合的方法判断三七不同部位之间的差异情况,得到核心差异化合物和明确三七不同部位的开发利用价值[17]。
2 结果与分析
2.1 生物碱类化合物的定性定量分析
本实验采用三七的三个部位即果实、叶片、根,共选取9个样品进行代谢组学分析。
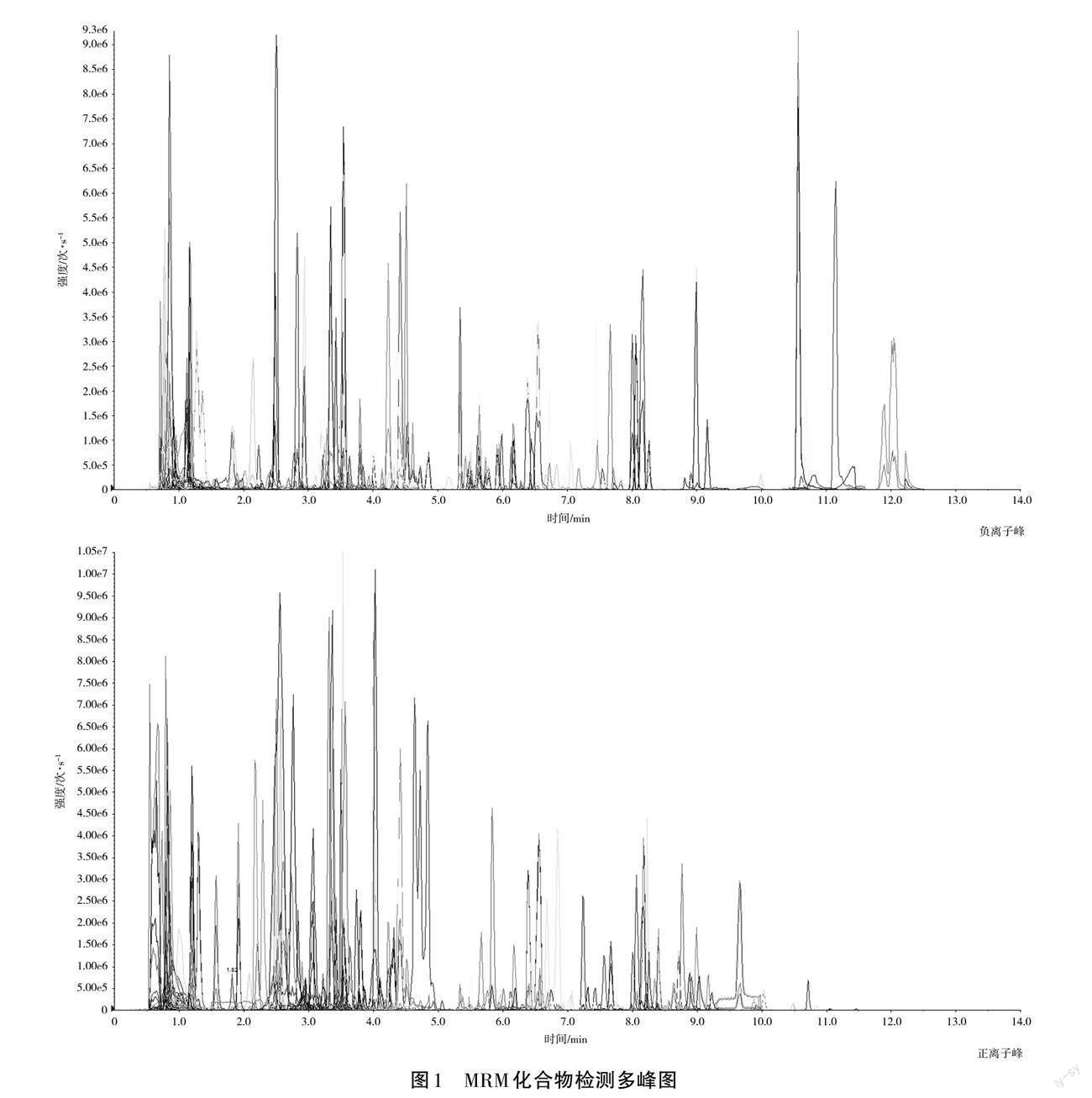
通过UPLC-MS/MS方法检测所得MRM化合物检测多峰图(见图1),峰积分校正处理后经标准品对照和数据库自查,结果表明一共检测到53个生物碱类化合物,经含量对比发现果实、叶片和根的生物碱总含量具有差异性,果实>叶片>根。后续通过多元统计分析方法对53个生物碱类化合物进行具体分析,找出果实、叶片和根的差异化合物。
2.2 主成分分析
对检测所得的化合物进行主成分分析,建立PCA得分图,每个点表示一个样品,同样的图形表示同一组样品,点与点之间的距离远近表示分离效果,距离越远分离效果越好,表示样品间差异性越大。
如图2所示,第一主成分的解释率为42.51%,第二主成分的解释率为24.51%,表明两个主成分能够基本反映检测样的主要特征信息;mix样本即质控样本,位于三个部位样本的中间且组内趋于同一点,说明数据重复性良好、可靠;F位于PC1的负半轴和PC2的正半轴,L位于PC1的正半轴和PC2的负半轴,R位于PC1的正半轴和PC2的正半轴,F、L、R三者间明显分离,说明果实、叶片和根之间的生物碱类成分差异明显。
2.3 OPLS-DA分析
正交偏最小二乘法判别分析方法可以与PCA方法互补,更全面地计算成分间的相关性,去除不相关的差异信息,使组间区分最大化筛选差异化合物。对三个部位作两两对比即FvsR(果实和根对比)、LvsR(叶片和根对比)、FvsL(果实和叶片对比),进行OPLS-DA分析区分不同部位的组间差异,结果再一次论证果实、叶片和根之间的生物碱类成分差异明显,与PCA分析所得结果一致。其中FvsL差异性比FvsR和LvsR较低,加之與传统药用部位根作对比更有意义,所以继而将重点分析FvsR和LvsR的差异化合物。
以VIP ≥ 1,FC(差异倍数值) ≥2和FC ≤ 0.5作为筛选标准明确不同部位间差异显著的化合物,FvsR筛选得到26个差异化合物,下调22个,上调4个;LvsR筛选得到24个差异化合物,下调15个,上调9个。如图3所示,正值(或空心圆)代表上调差异表达化合物,负值(或实心圆)代表下调差异表达化合物,上调表示该化合物在根中的相对含量较高,下调表示该化合物在根中的相对含量较低。果实和根对比中发现,上调最明显的物质是乙酰色胺(pmb0131),下调最明显的物质是油酰单乙醇胺(mws0983);叶片和根对比中发现,上调最明显的物质是乙酰色胺(pmb0131),下调最明显的物质是N-甲基烟酰胺(pma6298)。
2.4 差异化合物分析
多元统计分析筛选得到FvsR和LvsR组间差异明显,FvsR的下调物占比为84.6%,LvsR的下调物占比为62.5%,表明果实、叶片的生物碱类成分比根中更多,同时可以作为鉴别部位的一类标志物。下调表示该化合物在果实或叶片中的相对含量比根高,因此重点关注下调化合物,继而可以发现不同部位开发利用价值的多样性。
对比分析组间差异化合物中下调明显的前三个物质的相对含量,结果如表3和图4所示,相对于根而言,3-吲哚丙酸、甲氧基吲哚乙酸和油酰单乙醇胺在果实中相对含量更高,油酰单乙醇胺下调最明显,因为其在根中未检测出;3-羟基吡啶、N-甲基烟酰胺和5-羟基吲哚-3-乙醇在叶片中相对含量更高,3-羟基吡啶和N-甲基烟酰胺在根中未检测出;同时发现果实、叶片两者和根相比,两组的上调差异化合物中最明显的都是乙酰色胺,因为其只在根中检测出。
有关报道表明,三七果实和叶片中的3-吲哚丙酸、油酰单乙醇胺、3-羟基吡啶和N-甲基烟酰胺物质具有进一步研究的价值,可以应用于保健品、药品等产品开发。3-吲哚丙酸是一种强大的抗氧化剂,对治疗阿尔茨海默病有一定作用[18],也是一种肠道微生物群产生的代谢产物,是2型糖尿病(T2D)发展的潜在生物标志物,可通过保持β细胞功能来介导其保护作用[19]。油酰单乙醇胺可通过过氧化物酶体增殖物激活受体-α(PPAR-α)介导的机制调节脂质代谢,可以在肥胖症治疗中发挥作用[20]。3-羟基吡啶的衍生物是维生素B6的结构类似物,具有抗氧化作用等广泛的药理特性[21]。N-甲基烟酰胺是烟酰胺的化合物之一,可通过调节ADMA-DDAH轴改善内皮功能障碍并减轻动脉粥样硬化,也影响血管血栓形成[22]。而对甲氧基吲哚乙酸和5-羟基吲哚-3-乙醇有关药理作用的研究甚少,有待发掘空间大。甲氧基吲哚乙酸可以根据其化学式C11H11NO3,参考其同分异构体的化合物——5-甲氧基吲哚-3-乙酸,是一种褪黑素的代谢产物[23]。5-羟基吲哚-3-乙醇曾在哺乳动物中被发现,是5-羟色胺的化合物,可以作为一类急性酒精摄入的标志,可以借为参考[24]。根的特有物质乙酰色胺也具备利用价值,色胺是一种单胺生物碱,在大脑中的色胺作为神经调节剂或神经递质发挥作用,在植物中的色胺是影响植物生长和微生物群落代谢途径的原料,它曾被发现可能是植物生长调节剂吲哚-3-乙酸生物合成途径中的一种中间产物[25]。
3 讨论与结论
本研究在林下三七的果实、叶片和根中共检测出53个生物碱类化合物,从生物碱总含量多少看,
果实>叶片>根;从成分差异性看,果实和根对比有26个差异化合物,果实中3-吲哚丙酸、甲氧基吲哚乙酸和油酰单乙醇胺的含量较高,叶片和根对比有24个差异化合物,叶片中3-羟基吡啶、N-甲基烟酰胺和5-羟基吲哚-3-乙醇的含量较高;筛选得到果实特有物油酰单乙醇胺,叶片特有物3-羟基吡啶,根特有物乙酰色胺,可以作为鉴别这三个部位的生物碱类差异标志物。
与常用的高效液相色谱、超高效液相色谱、气相色谱-质谱联用等成分分析方法相比,本研究采用的超高效液相色谱和串联质谱法是一种更为快速、准确、可靠、直观的方法,为中药材成分检测、质量评价、部位鉴别等提供新思路[26]。三七的传统药用部位主要是根,本研究发现三七果实和叶片的生物碱总量高于根,与崔秀明等分析总结发现三七不同药用部位的药用成分含量具有差异性的结论一致[27],这说明三七不同部位的功效也可能不相同,揭示三七的果实和叶片这类地上部分也可能有利用价值。曲正义研究三七果实成分,发现三七果实成分含有抗肿瘤活性[28],孙璠和黄积武等分析三七叶片成分,发现三七叶片成分含有抗炎活性[29]和抗氧化活性[30],但发挥功效的具体物质及其作用机理尚未明确。本研究发现果实中含量较高的3-吲哚丙酸和油酰单乙醇胺有抗氧化、调节脂质代谢的作用,叶片中含量较高的3-羟基吡啶和N-甲基烟酰胺也有抗氧化、保护心血管的作用,结合前人的研究成果说明三七果实和叶片有巨大的开发利用潜力。
本研究从林下三七不同部位的生物碱类成分分析入手,旨在发现提高三七资源综合利用率的更多可能性,结果为三七不同部位鉴别提供了新的差异标志物,为三七果实和叶片的科学开发利用提供参考价值。针对性了解三七的生物碱类成分,能够为开发创新产品提供科学依据,促进三七资源开发利用多样性发展。
参考文献:
[1] 中华人民共和国药典2015年版.一部[S].2015:50.
[2] 刘立红,刘英,王芬,等.云南三七产业发展现状及发展建议[J].中国现代中药,2017,19(9):
1331-1335.
[3] 姜艺佼,张思文,姜庆丹,等.“健康中国”视域下2006—2020年中医药健康产业发展的研究热点与趋势分析[J].中国医药导报,2021,18(31):28-33.
[4] 詹鹏,韦美膛,徐波,等.基于产业链的我国三七产业发展现状与对策[J].北方园艺,2021(14):158-164.
[5] 李耿,陈洁,李振坤,等.三七专利数据分析与对产业发展启示[J].中国中药杂志,2020,45(5):
1011-1022.
[6] 周家明,张文斌,赵爱,等.文山三七产品加工现状和发展趋势分析[J].中国药业,2010,19(24):72-73.
[7] 夏鹏国,张顺仓,梁宗锁,等.三七化学成分的研究历程和概况[J].中草药,2014,45(17):2564-2570.
[8] 唐卿雁,陈庚,卢迎春,等.HPLC同时测定三七不同部位4种皂苷含量[J].热带农业科学,2018,38(9):91-95.
[9] 黄玉香,谭何新,于剑,等.药用植物生物碱次生代谢工程研究进展[J].中草药,2016,47(23):
4271-4281.
[10] 王腾飞,李信瑜,任佳俐,等.拟康定乌头中二萜生物碱成分的研究[J].华西药学杂志,2021,36(2):122-128.
[11] 馮敏,张文智,张雯霞,等.植物代谢组学技术在中药资源研究中的应用[J].药物评价研究,2020,43(4):785-789.
[12] DELFIN J C, WATANABE M, TOHGE T. Understanding the function and regulation of plant secondary metabolism through metabolomics approaches[J]. Theoretical and Experimental Plant Physiology, 2019, 31: 127-138.
[13] LIN H Q, ZHU H L, TAN J, et al. Non-targeted metabolomic analysis of methanolic extracts of wild-simulated and field-grown American ginseng[J]. Molecules, 2019, 24(6): 1053.
[14] WANG C, ZHANG N, WANG Z, et al. Nontargeted metabolomic analysis of four different parts of Platycodon grandiflorum grown in northeast China[J]. Molecules, 2017, 22(8): 1280.
[15] DAN M, SU M, GAO X, et al. Metabolite profiling of Panax notoginseng using UPLC-ESI-MS[J]. Phytochemistry, 2008, 69(11): 2237-2244.
[16] ZHU H, LIN H, TAN J, et al. UPLC-QTOF/MS-bsed anontargeted metabolomic analysis of mountain-and garden-cultivated Ginseng of different ages in Northeast China[J]. Molecules, 2019, 24(1): 33.
[17] 何静娟,范燕萍.观赏植物花色相关的类胡萝卜素组成及代谢调控研究进展[J].园艺学报,2022,49(5):1162-1172.
[18] WIKOFF W R, ANFORA A T, LIU J, et al. Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites[J]. Proceedings of the national academy of sciences, 2009, 106(10): 3698-3703.
[19] DE M V D, PAANANEN J, LINDSTR?M J, et al. Indolepropionic acid and novel lipid metabolites are associated with a lower risk of type 2 diabetes in the Finnish Diabetes Prevention Study[J]. Scientific reports, 2017, 7(1): 46337.
[20] CHEN L, LI L, CHEN J, et al. Oleoylethanolamide, an endogenous PPAR-α ligand, attenuates liver fibrosis targeting hepatic stellate cells[J]. Oncotarget, 2015, 6(40): 42530.
[21] LUKYANOVA L D, GERMANOVA E L, TSYBINA T A, et al. Energotropic effect of succinate-containing derivatives of 3-hydroxypyridine[J]. Bulletin of experimental biology and medicine, 2009, 148: 587-591.
[22] MOGIELNICKI A, KRAMKOWSKI K, PIETRZAK L, et al. N-methylnicotinamide inhibits arterial[J]. Journal of Physiology and Pharmacology, 2007, 58(3): 515-527.
[23] KVEDER S, MCISAAC W M. The metabolism of melatonin (N-acetyl-5-methoxytryptamine) and
5-methoxytryptamine[J]. Journal of Biological
Chemistry, 1961, 236(12): 3214-3220.
[24] BECK O, HELANDER A. 5-Hydroxytryptophol as a marker for recent alcohol intake[J]. Addiction, 2003, 98: 63-72.
[25] JONES R S G. Tryptamine: a neuromodulator or neurotransmitter in mammalian brain?[J]. Progress in neurobiology, 1982, 19(1-2): 117-139.
[26] 鐘贵,王元忠,张霁,等.人参属植物代谢组学研究进展[J].时珍国医国药,2013,24(9):2234-2237.
[27] 崔秀明,徐洛珊,王强,等.三七中三七素的含量测定[J].中国药学杂志,2005,40(13):1017-101.
[28] 曲正义.三七果化学成分及抗肿瘤活性研究[D].北京:中国农业科学院,2021.
[29] 孙璠.三七叶化学成分及其体外抗炎活性的研究[D].天津:天津中医药大学,2020.
[30] 黄积武,李创军,杨敬芝,等.三七叶的化学成分及其抗氧化活性研究[J].中草药,2017,48(21):
4381-4386.
(责任编辑:丁志祥)
