护巢饮调节PI3K/Akt/Nrf2/HO-1通路对早发性卵巢功能不全大鼠氧化应激的影响
2023-07-30马红霞史艳馨
李 昕,马红霞,史艳馨
(乌鲁木齐市中医医院,新疆 乌鲁木齐 830000)
早发性卵巢功能不全为临床中常见的妇科疾病,以继发性不孕、闭经为主要临床特征,严重影响患者的生活质量[1]。该病发病机制尚不明确,临床治疗手段有限。磷脂酰肌醇3-激酶/蛋白激酶B/核因子E2相关因子2/血红素加氧酶-1(PI3K/Akt/Nrf2/HO-1)通路是近年来发现的与早发性卵巢功能不全相关的重要信号通路,Chen等[2]研究表明调节Nrf2/HO-1通路能够促进小鼠卵巢功能损伤恢复,Dou等[3]研究表明调节PI3K/Akt通路能够促进大鼠卵巢组织损伤恢复,由此可见调节PI3K/Akt/Nrf2/HO-1通路可能是治疗早发性卵巢功能不全的关键途径。护巢饮是基于中医学理论基础组成的中药制剂,前期研究表明护巢饮能够显著调节早发性卵巢功能不全患者激素水平,改善患者倦怠乏力、腰膝酸软等症状[4],但其作用机制尚不清楚。本实验基于PI3K/Akt/Nrf2/HO-1通路,探讨了护巢饮对于早发性卵巢功能不全大鼠的干预作用及机制,为该方药的临床应用提供理论依据。
1 实验材料与方法
1.1实验动物 SD雌性大鼠72只,6~8周龄,体重200~220 g,购于新疆医科大学实验动物中心,实验动物许可证号:SCXK(新)2018-0002。动物房温度20~25 ℃,自由饮食水,自然光照,12 h/12 h昼夜交替,相对湿度40%~70%。
1.2设备及仪器 3-18KS离心机(德国Sigma公司);E-Gel Imager凝胶成像仪(赛默飞世尔科技有限公司);DM IRB荧光倒置显微镜(德国Leica公司);DYY-16D电泳仪(北京六一生物科技有限公司);S700石蜡切片机(深圳市瑞沃德生命科技有限公司);MY-10组织匀浆器(上海研卉生物科技有限公司);T100梯度PCR仪(美国Bio-Rad公司)。
1.3药品与试剂 护巢饮由黄芪(批号:191011)30 g、鹿角(批号:190806)12 g、当归(批号:190929)10 g、炒白术(批号:191023)10 g、龟板(批号:191014)12 g、制远志(批号:190815)10 g、山药(批号:190527)15 g、熟地黄(批号:191014)15 g组成,中药饮片购自北京同仁堂有限责任公司,将中药饮片置于1 500 mL蒸馏水中浸泡4 h,沸水煎煮1 h,过滤,留取滤液,将药材残渣置于1 000 mL蒸馏水再次煎煮40 min,过滤,合并2次滤液,蒸发浓缩,制成生药含量为20 g/kg的护巢饮;雷公藤多苷(货号:JKBw1779,纯度>98%)购自上海经科化学科技有限公司;戊酸雌二醇(批号:364164)购自拜耳医药保健有限公司;促卵泡激素(FSH,货号:EK-R37070)、促黄体生成素(LH,货号:EK-R37064)、雌二醇(E2,货号:CSB-E12755r-1)购自上海恒斐生物科技有限公司;抗缪勒管激素(AMH,货号:CSB-E11162r)购自武汉华美生物工程有限公司;抑制素B(INH-B,货号:FY-A014510)购自上海富雨生物科技有限公司;过氧化氢酶(CAT,货号:EK-R37399)购自上海酶研生物科技有限公司;活性氧(ROS,货号:KMERa011724)购自温州科淼生物科技有限公司;超氧化物歧化酶(SOD,货号:BC0170)、丙二醛(MDA,货号:BC0020)、RNA提取试剂盒(货号R1200)、反转录试剂盒(货号:RP1100)、PCR试剂盒(货号:SR1110)购自北京索莱宝科技有限公司;Nrf2兔多克隆抗体(货号:ab92946)、HO-1(货号:ab189491)、GAPDH(货号:ab181602)兔单克隆抗体购自艾博抗贸易有限公司;p-PI3K(货号:AF5905)、PI3K(货号:AF7742)、p-Akt(货号:AF1546)、Akt(货号:AF1789) 兔单克隆抗体和辣根过氧化酶标记山羊抗兔二抗(货号:A0208)购自碧云天生物科技有限公司。
1.4实验方法 从72只大鼠中随机取12只作为正常组,其余大鼠参照文献[5],给予雷公藤多苷40 mg/kg灌胃,1次/d,连续10周,同时每日对大鼠进行阴道涂片,记录大鼠动情周期,所有大鼠动情周期破坏则视为卵巢功能不全造模成功。将造模成功大鼠随机分为模型组、护巢饮低剂量组、护巢饮中剂量组、护巢饮高剂量组及戊酸雌二醇组,每组12只。护巢饮低、中、高剂量组大鼠分别给予5 g/kg、10 g/kg、20g/kg的护巢饮灌胃,戊酸雌二醇组大鼠给予0.1 mg/kg的戊酸雌二醇灌胃,均1次/d,连续15 d。
1.5检测指标及方法
1.5.1血清FSH、E2、AMH、INH-B、LH水平 大鼠眼眶静脉丛取血,在4 ℃条件下静置1 h,4 ℃下6 000 r/min离心10 min,取上清液,使用ELISA试剂盒测定FSH、E2、AMH、INH-B、LH水平。
1.5.2卵巢湿重、卵巢指数、子宫湿重及子宫指数大鼠称重后,颈椎脱臼处死,分离卵巢及子宫,称重,计算卵巢指数及子宫指数。卵巢指数=卵巢重量/体重,子宫指数=子宫重量/体重。
1.5.3卵巢组织中ROS、CAT、SOD、MDA含量 将卵巢组织置于组织匀浆器,加入4 ℃预冷的蒸馏水,在冰盒上研磨匀浆,4 ℃条件下,3 500 r/min离心15 min,取上清液,使用ELISA试剂盒测定ROS、CAT、SOD、MDA含量。
1.5.4卵巢组织病理学形态 取大鼠卵巢组织,4%甲醛中固定24 h,石蜡包埋后使用石蜡切片机制成5 μm切片,常规HE染色,在显微镜下观察。
1.5.5卵巢组织中Nrf2、HO-1 mRNA表达情况取卵巢组织,使用试剂盒提取卵巢组织总RNA,反转录为cDNA,使用相应试剂盒进行检测。引物序列:Nrf2正向引物为5’-AATGTGTCCTTCCCA-3’,反向引物为 5’-GAGGCAGCAAGAGAGAT-3’;HO-1正向引物为5’-ACGCAGGCAAGCAAGACTACA-3’,反向引物为 5’-CATTCTCAAGATGGCAGATC-3’;GAPDH正向引物为5’-ATGTATCCGTTGTGGATCTGAC-3’,反向引物为5’-CCTGCTTCACCACCTTCTTG-3’。采用20 μL反应体系:DNA模板2 μL,正反向引物各1 μL,PCR Master Mix 10 μL,使用蒸馏水补充至20 μL,反应程序为 95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共计30个循环,72 ℃最终延伸10 min。结果以GAPDH为内参,采用2-△△ct法计算相对表达量。
1.5.6卵巢组织中p-PI3K、p-Akt、Nrf2及HO-1蛋白表达情况 取卵巢组织,使用组织蛋白液裂解并研磨匀浆后4 ℃静置2 h,置于离心机,4 ℃ 12 000 r/min离心10 min,取上清液,进行凝胶电泳分离,使用牛血清白蛋白室温封闭1 h,4 ℃条件下分别使用p-PI3K、p-Akt、PI3K、Akt、Nrf2、HO-1、GAPDH兔抗体(1∶500),4 ℃孵育过夜,TBST溶液清洗3次,5 min/次,辣根过氧化物酶标记山羊抗兔二抗(1∶1 000)室温孵育2 h,TBST溶液再次清洗3次,滴加ECL显影液,用凝胶成像仪成像拍照,使用Image J 12.0,以GAPDH为内参,计算p-PI3K/PI3K、p-Akt/ Akt、Nrf2及HO-1相对表达量。
1.6统计学方法 数据采用SPSS 26.0软件进行处理,所有计量资料数据符合正态分布,以均数±标准差的形式表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1各组大鼠血清FSH、E2、AMH、INH-B、LH水平比较 与正常组比较,模型组大鼠血清FSH、LH水平均明显升高(P均<0.05),血清E2、AMH、INH-B水平均明显降低(P均<0.05);与模型组比较,护巢饮各组及戊酸雌二醇组大鼠血清FSH、LH水平均明显降低(P均<0.05),血清E2、AMH、INH-B水平均明显升高(P均<0.05);且随着护巢饮剂量的增加,大鼠血清FSH、LH水平逐渐降低,血清E2、AMH、INH-B水平逐渐升高,各剂量组间比较差异均有统计学意义(P均<0.05)。见表1。

表1 正常组和卵巢功能不全各组大鼠血清FSH、E2、AMH、INH-B、LH水平比较
2.2各组大鼠卵巢湿重、卵巢指数、子宫湿重及子宫指数比较 模型组大鼠卵巢湿重、卵巢指数、子宫湿重及子宫指数均明显低于正常组(P均<0.05);护巢饮各组及戊酸雌二醇组大鼠卵巢湿重、卵巢指数、子宫湿重及子宫指数均明显高于模型组(P均<0.05);且随着护巢饮剂量的增加,大鼠卵巢湿重、卵巢指数、子宫湿重及子宫指数逐渐升高,各剂量组间比较差异均有统计学意义(P均<0.05)。见表2。

表2 正常组和卵巢功能不全各组大鼠卵巢湿重、卵巢指数、子宫湿重及子宫指数比较
2.3各组大鼠卵巢组织中ROS、CAT、SOD及MDA含量比较 与正常组比较,模型组大鼠卵巢组织中ROS、MDA含量均明显升高(P均<0.05),CAT、SOD含量均明显降低(P均<0.05);与模型组比较,护巢饮各组及戊酸雌二醇组大鼠卵巢组织中ROS、MDA含量均明显降低(P均<0.05),CAT、SOD含量均明显升高(P均<0.05);且随着护巢饮剂量的增加,大鼠卵巢组织中ROS、MDA含量逐渐降低,CAT、SOD含量逐渐升高,各剂量组间比较差异均有统计学意义(P均<0.05)。见表3。

表3 正常组和卵巢功能不全各组大鼠卵巢组织中ROS、CAT、SOD及MDA含量比较
2.4各组大鼠卵巢组织病理形态 正常组大鼠卵巢组织未见异常,模型组卵泡颗粒细胞排列杂乱、不整齐,护巢饮各组及戊酸雌二醇组卵巢颗粒细胞排列较整齐,见图1。与正常组比较,模型组大鼠初级卵泡、窦前卵泡、窦状卵泡数量均明显减少(P均<0.05),闭锁卵泡数量明显增多(P<0.05);与模型组比较,护巢饮各组及戊酸雌二醇组大鼠初级卵泡、窦前卵泡、窦状卵泡数量均明显增多(P均<0.05),闭锁卵泡数量均明显减少(P均<0.05);且随着护巢饮剂量的增加,大鼠初级卵泡、窦前卵泡、窦状卵泡数量均逐渐增多,闭锁卵泡数量逐渐减少,各剂量组间比较差异均有统计学意义(P均<0.05)。见表4。
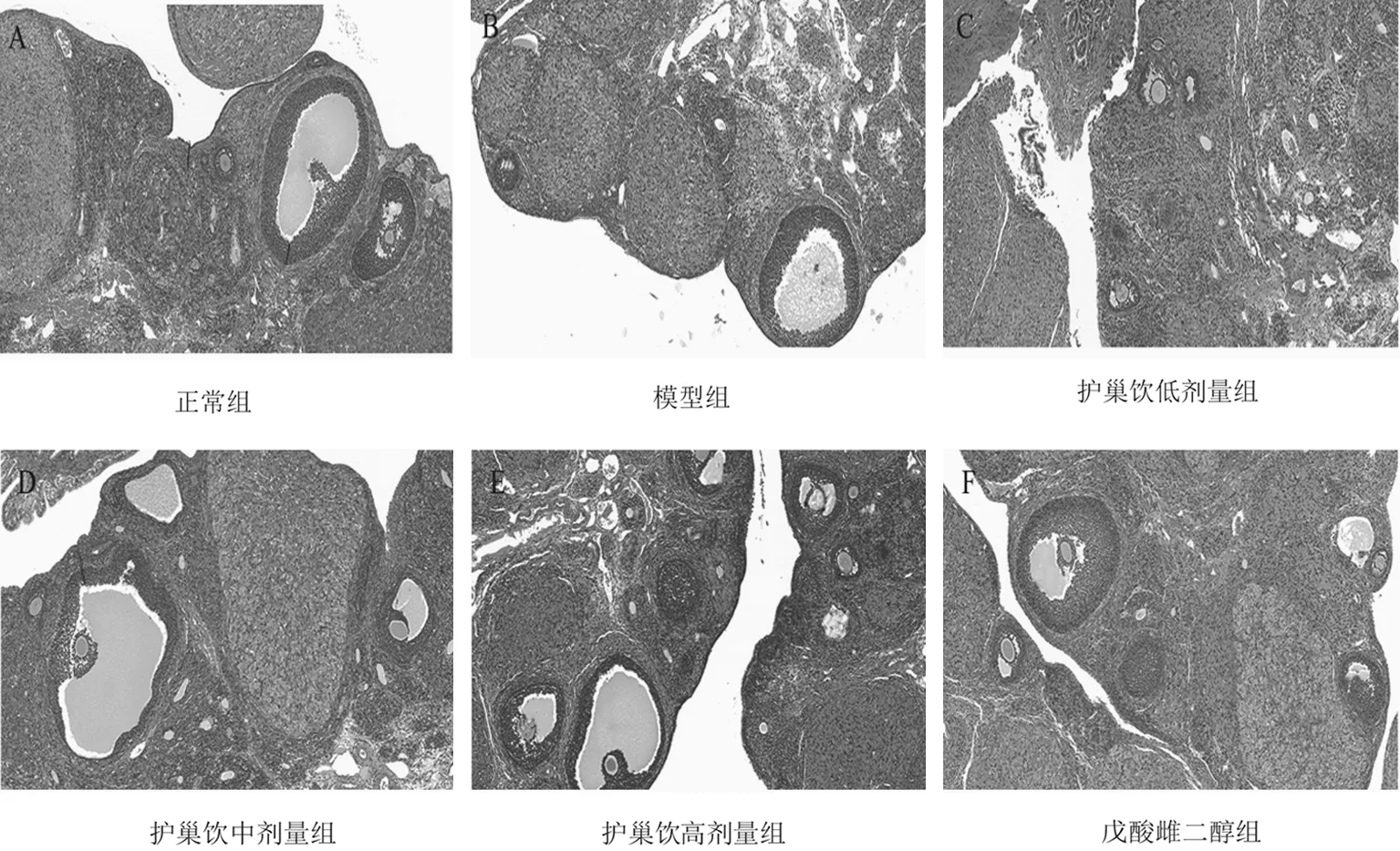
图1 正常组和卵巢功能不全各组大鼠卵巢组织病理学形态(HE染色,×100)
表4 正常组和卵巢功能不全各组大鼠初级卵泡、窦前卵泡、窦状卵泡及闭锁卵泡数量比较个)
2.5各组大鼠卵巢组织中Nrf2、HO-1 mRNA表达量比较 模型组大鼠卵巢组织中Nrf2、HO-1 mRNA表达量均明显低于正常组(P均<0.05);护巢饮各组及戊酸雌二醇组大鼠卵巢组织中Nrf2、HO-1 mRNA表达量均明显高于模型组(P均<0.05);且随着护巢饮剂量的增加,大鼠卵巢组织中Nrf2、HO-1 mRNA表达量均逐渐升高,各剂量组间比较差异均有统计学意义(P均<0.05)。见表5。

表5 正常组和卵巢功能不全各组大鼠卵巢组织中Nrf2、HO-1 mRNA相对表达量比较
2.6各组大鼠卵巢组织中p-PI3K、p-Akt、Nrf2及HO-1蛋白表达情况比较 模型组大鼠卵巢组织中p-PI3K、p-Akt、Nrf2及HO-1蛋白表达量均明显低于正常组(P均<0.05);护巢饮各组及戊酸雌二醇组大鼠卵巢组织中p-PI3K、p-Akt、Nrf2及HO-1蛋白表达量均明显高于模型组(P均<0.05);且随着护巢饮剂量的增加,大鼠卵巢组织中p-PI3K、p-Akt、Nrf2及HO-1蛋白表达量均逐渐升高,各剂量组间比较差异均有统计学意义(P均<0.05)。见图2。

图2 正常组和卵巢功能不全各组大鼠卵巢组织中p-PI3K、p-Akt、Nrf2及HO-1蛋白表达情况
3 讨 论
早发性卵巢功能不全目前以补充雌激素,预防雌激素降低的并发症治疗为主[6]。戊酸雌二醇是一种长效的雌激素制剂,是早发性卵巢功能不全治疗中的常用药物,故本实验用其作为阳性对照药物。
中医学认为,早发性卵巢功能不全是以肾气不足,肾水亏虚,冲任血虚而致心血无源,加之脾胃失调,肾精难充,致使经水早断,卵巢早衰。同时,由于女子平素多忧思郁结,而致肝郁血瘀,血行不畅,气血虚弱,致使脏器失于温养,卵巢功能衰退。护巢饮具有温中补脾、行血补气之功效,方中熟地黄补血滋阴;炒白术健脾益气、燥湿利水;龟板滋阴潜阳、补肾调经;山药固肾健脾、补精益气;黄芪益卫固表、健脾补肾;鹿角温阳补肾、行血消肿;当归活血化瘀、调经止痛;远志交通心肾;诸药共用,起补脾益肾、温中补气、活血化瘀、行血止痛之功效。
血清FSH、E2、LH水平是反映体内激素水平的常用指标,早发性卵巢功能不全患者表现为血清FSH及LH水平显著升高,而E2水平显著降低[7],激素分泌异常影响卵巢分泌功能及生殖功能[8]。AMH是反映卵巢功能的重要指标,血清AMH水平降低则提示卵巢功能减退,卵子储备减少[9]。INH-B是由窦状卵泡细胞的颗粒细胞合成的参与卵泡发育等生殖功能的重要物质。逯芳芳等[10]研究发现,早发性卵巢功能不全患者AMH、INH-B、E2水平降低,上调AMH、INH-B、E2水平可显著改善早发性卵巢功能不全患者卵巢储备功能,提高妊娠率;顾燕频等[11]研究证实,升高大鼠AMH、INH-B、E2水平可促进早发性卵巢功能不全大鼠卵巢功能恢复。本实验结果表明,早发性卵巢功能不全大鼠血清FSH、LH水平明显升高,E2、AMH、INH-B水平明显降低;不同剂量的护巢饮干预后,大鼠血清FSH、LH水平明显降低,E2、AMH、INH-B水平明显升高。提示护巢饮能够调节早发性卵巢功能不全大鼠激素水平,促进卵巢功能的恢复。
ROS、CAT、SOD、MDA水平可反映机体氧化应激状态,ROS、MDA水平升高及CAT、SOD水平降低提示组织氧化损伤,与卵巢损伤密切相关,上调CAT、SOD水平及下调ROS水平能够减轻卵巢氧化应激损伤,促进卵巢功能的恢复[12-13]。本实验结果表明,护巢饮各组大鼠卵巢组织中ROS、MDA含量明显降低,CAT、SOD含量及卵巢湿重、卵巢指数、子宫湿重及子宫指数明显升高,卵巢组织病理改变减轻。提示护巢饮能够显著抑制早发性卵巢功能不全大鼠卵巢组织氧化损伤,修复卵巢组织病理改变,促进卵巢及子宫组织功能的恢复。
PI3K/Akt/Nrf2/HO-1通路是与早发性卵巢功能不全发生及进展密切相关的重要信号通路。王文静等[14]研究证实,早发性卵巢功能不全大鼠卵巢组织中PI3K及Akt蛋白磷酸化水平显著降低,而提高卵巢组织p-PI3K及p-Akt水平能够显著调节大鼠动情周期,抑制颗粒细胞凋亡。张慧等[15]研究发现,早发性卵巢功能不全患者FSH、LH及凋亡相关蛋白水平异常与p-PI3K、p-Akt水平降低有关,上调p-PI3K及p-Akt水平能够显著改善患者临床症状,减少颗粒细胞凋亡。马蔚蓉等[16]研究表明,早发性卵巢功能不全小鼠卵巢颗粒细胞中HO-1、p-PI3K及p-Akt表达水平明显降低,而上调HO-1、p-PI3K及p-Akt表达水平能够显著抑制卵巢组织氧化损伤,抑制颗粒细胞凋亡,恢复卵巢功能。本实验结果表明,卵巢功能不全大鼠卵巢组织中Nrf2及HO-1、p-PI3K、p-Akt表达量显著降低,护巢饮干预可显著上调大鼠卵巢组织中Nrf2及HO-1、p-PI3K、p-Akt表达量,提示护巢饮能够显著调节早发性卵巢功能不全大鼠PI3K/Akt/Nrf2/HO-1通路。
综上所述,护巢饮能够调节早发性卵巢功能不全大鼠激素水平,抑制卵巢组织氧化损伤及病理改变,促进卵巢功能的恢复,其机制可能与调节PI3K/Akt/Nrf2/HO-1通路有关。
利益冲突:所有作者均声明不存在利益冲突。
