纳米Ni颗粒改性质子导体燃料电池研究
2023-07-29周晓亮刘立敏陈晗钰
王 宙,周晓亮,2,刘立敏,陈晗钰,绳 阳
(1.西南石油大学化学化工学院,成都 610500; 2.天府永兴实验室,成都 610213)
引 言
质子传导陶瓷燃料电池相比于传统基于氧离子传导的固体氧化物燃料电池有着明显的优势:在中低温(450~700 ℃)环境下有着更高的离子电导率和更低的活化能[1-2]。更低的工作温度意味着可以在很大程度上减少电池工作的能耗,降低使用成本,加速商业化应用[3]。此外,由于质子导体燃料电池的水在阴极一侧产生,因而不会干扰阳极中的燃料。因此,相比于传统的氧离子导体燃料电池,质子传导陶瓷燃料电池有着更高的效率[4]。
目前,质子导体燃料电池的性能普遍不佳,难以满足实际使用要求[5]。对于这一问题研究者们通常认为是电极极化电阻对电池的消耗过大,特别是在低温条件下离子传输速度慢、反应速率下降所造成的。为了解决这一问题,混合离子导体(MIECs)和三相导体氧化物(TCOs)材料迅速发展[6]。相比之下,电池另一侧的阳极材料很少受到关注,可能是因为研究人员普遍认为“镍-电解质”复合材料就是最佳的阳极材料,认为它们具有足够的活性,能够在中低温的条件下运行。作为阳极支撑型的质子导体燃料电池首选材料,镍-电解质复合材料在高温下需要具有足够的稳定性、较高的导电性和足够的氢氧催化活性以及兼容性。
近来,有报道称在氧离子导电固体材料氧化物燃料电池中,钙钛矿材料结合少量的纳米颗粒可以显著提高固体氧化物燃料电池电极的电化学活性[7-8]。过渡元素(Fe、Co、Ni)的掺杂能够在还原气氛下部分释放为金属颗粒,这些金属颗粒不仅促进氢气的分解,还可以提高阳极的导电性。如Yang 等[9]制备了一种新型Co-Fe 金属合金颗粒复合阳极,该电极具有良好的导电性和优异的耐硫性、抗结焦性。Neagu 等[10]通过控制非化学计量比在钛酸锶基钙钛矿表面制备了镍的金属颗粒,与不含镍金属颗粒的电极相比,其稳定性和抗结焦性能得到较大提升。SrTi0.3Fe0.7O3-δ基阳极表面制备Ni-Fe 合金颗粒后[11-12],除了对氢气的分解能力显著增强外,阳极的极化电阻也有一定幅度的降低。合金颗粒的出现不仅能够分解氢气、降低阳极极化电阻,在固体氧化物电解槽中表现同样出色,如Liu等[13]将Co-Fe 合金颗粒嵌入到钙钛矿骨架中,新合成的阳极电解二氧化碳的能力明显提升。因此,阳极一侧存在金属颗粒的情况下,固体氧化物燃料电池或电解池的性能都有明显的提升。尽管这一类的报道基本都是基于氧离子导体氧化物,但是已经体现出了应用于质子导体燃料电池的潜力。如Duan 等[14]发现在复合阳极中,镍的金属颗粒附着在BaZr0.8Y0.2O3-δ(BZY) 似乎有利于其活性的提高。
基于此,为了提高质子燃料电池在中低温条件下的使用性能,提出一种制备含镍金属颗粒阳极的简易方法,并分析比较单电池微观形貌、电化学阻抗谱以及放电功率曲线,通过阻抗谱分析了解燃料电池反应的电化学过程,从而为质子燃料电池的中低温应用方面提供一种可行的优化策略。
1 实验部分
1.1 实验试剂与材料
无水柠檬酸(AR,成都科隆试剂有限公司)、氨水(AR,成都科隆试剂有限公司)、Ba(NO3)(2AR,成都科隆试剂有限公司)、Ce(NO3)3·6H2O、(AR,上海麦克林试剂有限公司)、Y(NO3)3·6H2O(AR,上海麦克林试剂有限公司)、Zr(NO3)4·5H2O(AR,上海阿拉丁试剂有限公司)、浓硝酸(AR,成都科隆试剂有限公司)、NiO(GR,上海阿拉丁试剂有限公司)、淀粉(AR,上海国药试剂有限公司)、三乙醇胺(AR,上海国药试剂有限公司)、邻苯二甲酸丁苄酯(AR,上海国药试剂有限公司)、聚乙二醇-400(AR,上海国药试剂有限公司)、无水乙醇(AR,成都科隆试剂有限公司)、聚乙烯吡咯烷酮(PVP)(AR,上海国药试剂有限公司)。
1.2 粉体材料的制备
采用BaZr0.1Ce0.7Y0.2O3-(δBZCY)作为电解质材料;混合一定比例的NiO和淀粉得到多孔阳极;阴极则采用混合离子导体的Ba0.5Sr0.5Co0.8Fe0.2O3-δ(BSCF)。阳极支撑的半电池使用干压-共烧法制备。
使用改进的溶胶-凝胶法[15]合成制备电池所需要的原料。以合成电解质粉体为例:按化学计量比折算质量后准确称取Ba(NO3)2、Ce(NO3)3·6H2O、Y(NO3)3·6H2O、Zr(NO3)4·5H2O 并依次溶于稀硝酸中,加热溶解。硝酸盐溶解完毕后加入无水柠檬酸作为络合剂,溶液中的无水柠檬酸与金属离子的摩尔比为2∶1。之后缓慢滴加氨水,调节混合液的pH 值约为7。在搅拌下通过加热使溶液水分蒸发,在300 ℃下灰化1 h 得到黑色的前驱体。收集前驱体并充分研磨后转移至高温炉中,最后在1000 ℃下煅烧3 h 后得到所需粉体。 阴极粉体Ba0.5Sr0.5Co0.8Fe0.2O3-(δBSCF)使用对应的硝酸盐,并采用同样的工序制备。
1.3 单电池制备
阳极浆料中组分按照NiO∶BZCY∶淀粉=3∶2∶1的质量比混合。按比例称取后转移至玛瑙球磨罐后再加入适量无水乙醇。浆料经过300 r/min 球磨2 h 后,在80 ℃下干燥并过筛得NiO-BZCY 阳极粉体。阴极按照BSCF∶BZCY=7∶3 的质量比进行混合,加入三乙醇胺、邻苯二甲酸丁苄酯和聚乙二醇-400,加入适量无水乙醇于研钵中研磨约2 h 直至浆料中无肉眼可见颗粒物,得到BSCF-BZCY 阴极复合浆料。
为了避免电解质与阳极出现断层影响电池内部连接,实验中用到的NiO-BZCY|BZCY 半电池片通过3 层共压制备而成。具体步骤如下:1)将0.35 g 阳极粉体放入直径为13 mm 的不锈钢模具中,在100 MPa 压力下保持1 min;2)按照1∶1 的比例混合BZCY∶NiO,球磨烘干过筛后得到阳极功能层粉体(AFL),称取适量的功能层粉体平铺在阳极层上,用力按压,使粉体具有一定的强度不至于从模具中脱出;3)将BZCY 粉末尽可能均匀地覆盖在阳极功能层上,并在400 MPa 保持10 min 得到3 层半电池组装体;4)将3层半电池组装体在1400 ℃煅烧5 h 得到烧结成型的阳极/功能层/电解质3 层半电池。
阴极浆料使用丝网印刷的方式均匀涂敷在半电池的电解质一侧上,阴极有效面积约为0.20 cm2,并将制备完成的全电池片在1000 ℃煅烧3 h 得到最终的全电池。在单电池阳极分别浸渍50、100、150 μL 与200 μL 硝酸镍溶液,溶液的浓度为0.1 mol/L,并添加5wt% 的PVP 提高溶液的浸润性。
最后银浆涂敷电极表面作为集流体,连接银丝并在750 ℃下固化,外接银丝到电化学工作站测试相关电化学性能;将电池片用552 陶瓷胶密封于氧化铝刚玉管上,以3 ℃/min 的升温速率升温至700 ℃,通入氢气(~3% H2O)保持1 h 确保阳极被充分还原以便进行后续测试。
1.4 材料的表征
在室温条件下,采用Panaco 粉末衍射仪(X’pertPRO MPD 型,Netherlands公司),Kα射线源为Cu靶(λ= 1.5418 Å),测试温度为室温,扫描范围20~90°,扫描速度为7.3 (°)/min,表征粉体的晶相结构。使用JEM-2100 Plus型扫描电镜(EVOMA15,蔡司公司)表征单电池阳极的微观形貌。
1.5 电化学测试
使用电化学工作站(型号为V13819,Ivium 公司)在600~700 ℃范围内对电池的电化学性能进行测试。燃料气体中约含有3%的水分;正极一侧直接暴露在空气中,以环境中的氧气作为氧化剂。电化学阻抗谱(Electrochemical Impedance Spectroscopy,EIS)是在100 kHz ~ 0.1 Hz 频率范围内的开路条件(Open Circuit Voltage,OCV)下测量的,交流电压振幅为5 mV。采用弛豫时间分布分析法(DRT)研究单电池电极的极化过程。研究中通过Fuoss 和Kirkwood函数模型获得各单电池的阻抗谱相应的弛豫时间分布图。
2 结果与讨论
2.1 材料的物相表征
对合成的粉体进行物相表征,结果如图1所示。从图1(a)可以看出,用溶胶-凝胶法合成的BSCF 和BZCY 粉体均未见杂峰,均表现为单一钙钛矿结构。混合粉体在1000 ℃处理5 h后测试,图中可见,在混合粉体的XRD 谱图中,除了BSCF 和BZCY 的钙钛矿相以外,并未观察到其他杂峰。这都表明BSCF和BZCY 的混合物在高温下具有较高的化学稳定性和良好的化学相容性,不会在反应过程中发生结构相变。值得注意的是,BZCY 粉体的相于2θ为24°、34°处观察到微弱的衍射峰,这可能是球磨过程中混入少量ZrO2所致(图1(b))。
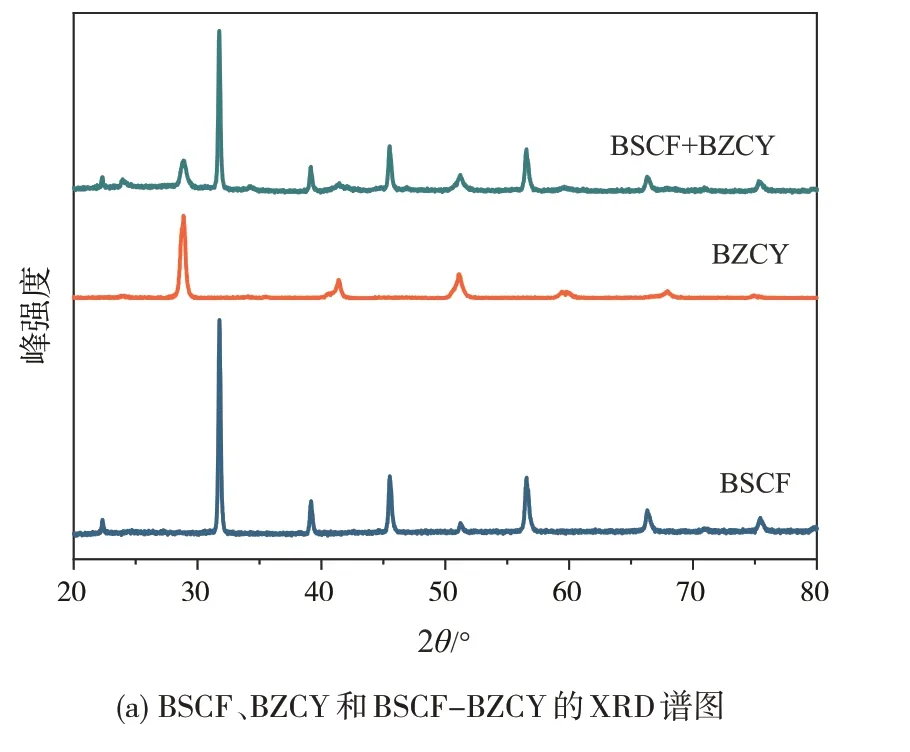
图1 XRD分析谱图
2.2 阳极的微观结构表征
不同单电池的微观形貌如图2 所示。图2(a)所示为不含功能层单电池横截面微观形貌,图中可以很清晰地看到电解质与阳极之间存在大量的缝隙,甚至有部分断开。图2(b)所示为不含功能层单电池的致密电解质膜,图中可见电解质致密,电解质与阳极连接时会影响导电,最终影响电化学性能。图2(c)所示为添加功能层后的单电池横截面微观形貌。电池由阳极支撑层、阳极功能层、电解质和阴极组成的四层结构组成;其致密的电解质膜(图2(d))与阴极和阳极功能层接触良好。由于在压制半电池的过程中添加了功能层,在电解质与阳极多孔层之间形成了一个中间连接,功能层的孔隙率介于电解质与多孔阳极之间,相当于从致密电解质到多孔阳极层的孔隙缓慢增加,能使阳极和电解质的连接更加紧密。相比于致密电解质膜和多孔阳极,阳极功能层中存在的部分空隙来自氧化镍还原后体积缩小。

图2 不同单电池的微观形貌
图2(e)和图2(f)所示为浸渍硝酸镍溶液的单电池阳极还原后的微观形貌,其中图2(e)所示单电池阳极浸渍量为150 μL,图2(f) 所示单电池阳极浸渍量为200 μL。图2(e)中能明显看到有大量细小的颗粒附着在阳极表面,说明浸润的硝酸镍溶液能够在还原气氛中生长金属颗粒在阳极表面。生长出的金属颗粒相较于原NiO能够提供更多的催化位点以及更大的催化接触面积。而单电池阳极浸渍量为200 μL 时明显引入了过多的金属颗粒,在氢气气氛还原过后,大量的金属镍聚集在一起发生团聚现象。浸渍形成的大团聚物相互连接并覆盖在原有的催化位点上,相比于颗粒,催化接触面积减少。
2.3 电化学性能分析
表1 列出了不同共压方式单电池的电化学性能。可以看出,单电池有功能层的条件下,无论是在欧姆阻抗还是在极化阻抗上都显著减小。这表明欧姆阻抗不仅限于电解质或电极本身的导电性能,还受制于相互之间的连接状况。
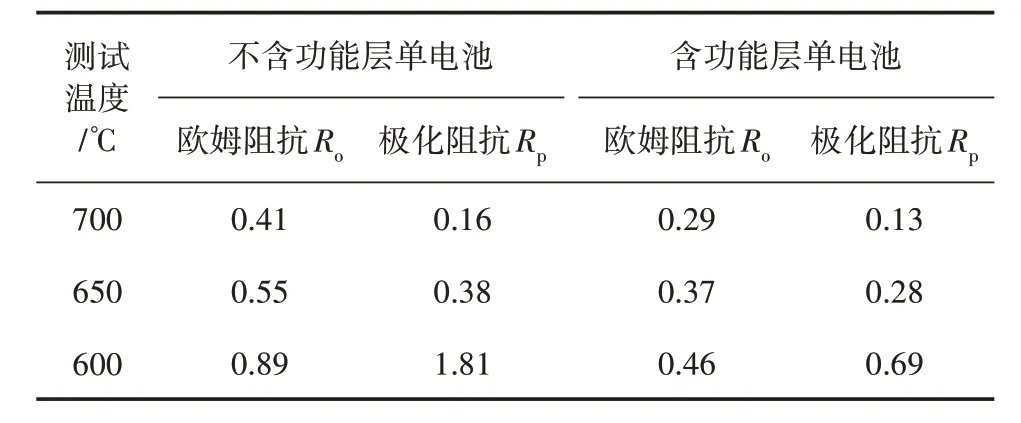
表1 不同共压方式单电池电化学性能 Ω·cm2
不同浸渍量、不同温度下单电池的电化学性能如图3所示。从图3(a)可以看出,不同浸渍量单电池在600~700 ℃条件下的欧姆阻抗变化情况。其中,浸渍量由少变多时,欧姆阻抗先减少后增大,呈现出一定的变化规律。当浸渍量为150 μL,运行温度为700 ℃时,单电池的欧姆阻抗达到最低(0.21 Ω·cm2),而相同条件下未浸渍改性单电池的欧姆阻抗为0.29 Ω·cm2。与此同时,浸渍硝酸镍溶液后单电池的极化阻抗的变化规律如图3(b)所示,图中可见,单电池浸渍硝酸镍溶液达到150 μL 时极化阻抗降低至0.10 Ω·cm2左右。而浸渍量达到200 μL 时,电池的性能开始出现明显的衰减,这是由于单电池浸渍太多硝酸镍溶液还原后形成了大量的纳米镍颗粒并团聚在一起,团聚后的金属颗粒会覆盖原有的催化剂,与氢气的接触面积明显减少,催化效果不佳导致单电池性能下降。这一结果与前文的扫描电镜结果相符。
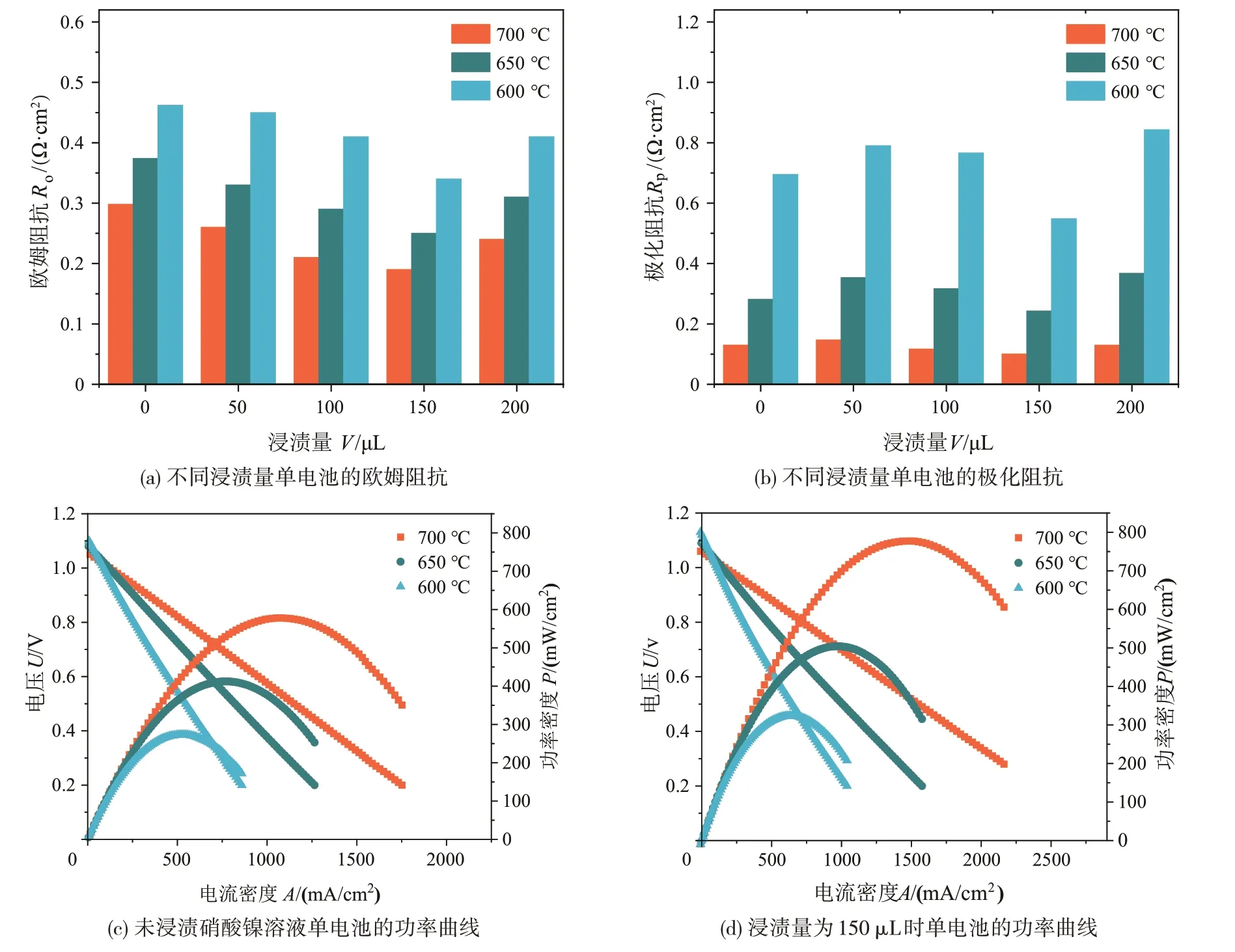
图3 单电池的电化学性能
图3(c)和图3(d)所示分别为未浸渍硝酸镍溶液和浸渍150 μL 硝酸镍溶液时单电池的放电功率曲线,能够看出浸渍改性后的单电池的功率密度明显提升,在较低温度下也有一定的改善。单电池浸渍硝酸镍溶液后,700 ℃时最大功率密度由未浸渍条件下的572.16 mW/cm2提升至777.89 mW/cm2,提升幅度超过30%。
改性前后单电池在700 ℃的阻抗分析如图4 所示,图中很明显地观察到电池的欧姆阻抗有很明显的下降,而极化阻抗则没有明显变化。表2 给出了部分相似电解质厚度的单电池在700 ℃时的欧姆阻抗,可以看出,本文使用的复合阳极能够有效地降低单电池的欧姆阻抗。
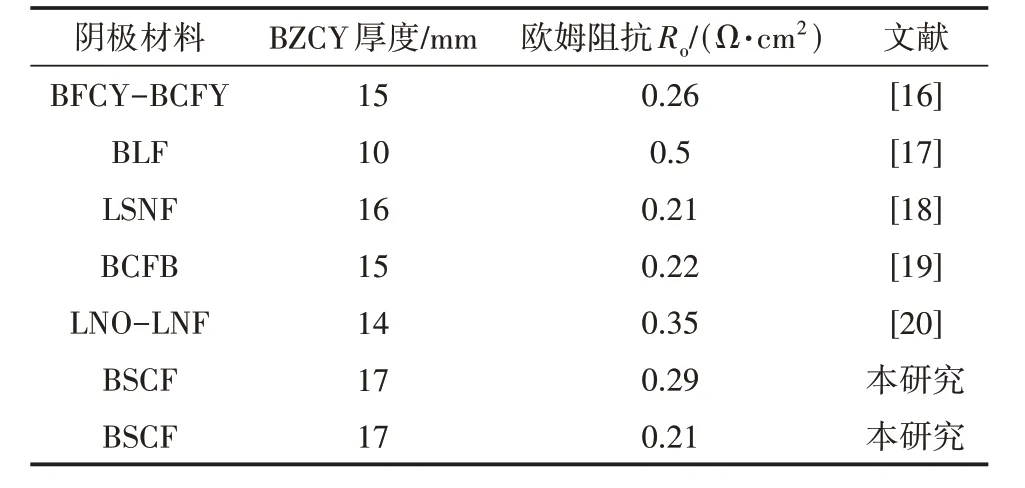
表2 相似厚度单电池在700 ℃时的欧姆阻抗
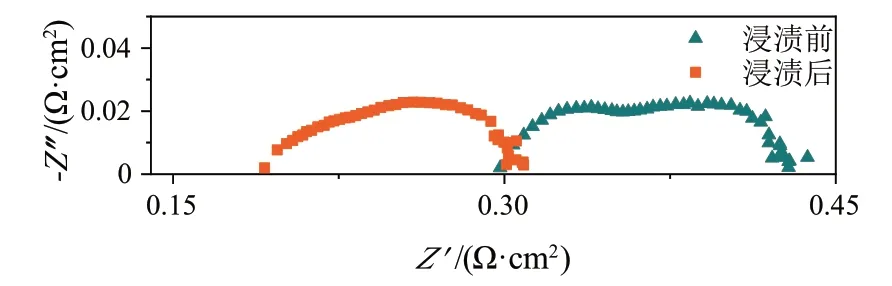
图4 改性前后单电池在700 ℃的阻抗对比
为了更直观地了解改性后单电池的电化学性能,可以通过高分辨率弛豫时间(DRT)分析方法分离阻抗谱[21]获得更加具体的对比数据,结果如图5所示。在DRT 分析谱图中,P1 表示质子扩散、并进入到电解质中;P2 表示质子的形成;P3 表示氧的吸附和解离;P4 表示氧在三相界面中的扩散;P5 表示气体在多孔阳极内扩散;曲线和横轴包围的区域面积表示材料在该段频率下的阻抗大小。从图5中可以看出,浸渍硝酸镍溶液后,变化最明显处位于P5阶段,即浸渍生成的纳米镍颗粒加快了单电池阳极处的气体扩散过程,加速了阳极一侧气体的吸附与解离,使得质子能更快的结合到电解质的晶格中[22],这表明改性后的阳极更容易吸附氢气参与反应,使得反应更容易进行。而电池阻抗谱反应的是整个过程的阻抗变化,所以改性后阳极的欧姆阻抗和极化阻抗均有不同程度的下降;而欧姆阻抗在总电阻中占比较大,所以在改性后下降较为明显。
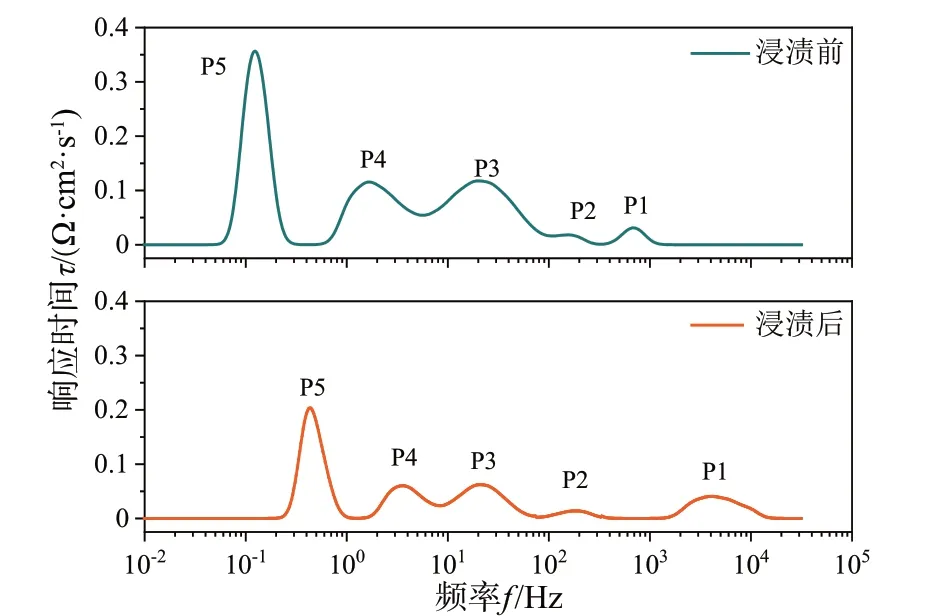
图5 改性前后单电池700 ℃阻抗谱DRT分析谱图
3 结束语
本文通过添加功能层的方法解决了阳极与电解质的连接问题,同时向单电池的阳极浸渍硝酸镍溶液成功制备了含有镍金属颗粒的新型复合电极。结果表明,功能层的存在能有效地改善阳极与电解质的连接;浸渍硝酸镍溶液后制备的新型阳极能够有效降低单电池的欧姆电阻。通过浸渍生长纳米镍颗粒能加快阳极一侧的气体吸附与解离,使反应更快地进行。浸渍后的单电池在700 ℃、湿润氢气条件下,欧姆电阻从0.29 Ω·cm2下降至0.21 Ω·cm2,最大功率密度从 572.16 mW/cm2提升至777.89 mW/cm2,提升幅度超过30%。过渡金属Ni的引入能够提高电极的催化活性,在降低电池欧姆电阻方面较为明显,这为优化质子导体燃料电池提供了新的思路与策略。
