磷酸铵镁沉淀法回收污泥浓缩液中磷的实验研究*
2023-07-27刘明源
袁 鹰,曹 健,刘明源
(泰州职业技术学院,江苏 泰州 225300)
生活污水、农业废水和工业废水中含有大量的氮磷[1],污水中的氮磷常采用生物厌氧和好氧相结合的方式进行处理,但由于氮磷在污水中含量较高,一般的生化处理效果有限,会导致氮磷超标排放;再则厌氧和好氧生物法处理磷并没有将磷去除,磷只是随聚磷菌进入生物污泥中,在一定条件下可能会再释放进入污泥浓缩液中而导致含磷量达到十至几十毫克每升甚至高达100 毫克每升以上[2];氮磷是一种营养元素,对于污废水中的氮磷当作一种污染物质处理其实也是一种资源的浪费,因此,可以转变一种思路,将污泥浓缩液中的氮磷进行回收,变废为宝。MgNH4PO4·6H2O(MAP)是由Mg2+、NH++44-N、PO34-按照等量关系反应生成的一种沉淀,是一种良好的缓释磷肥[3],可以实现对氮磷同步去除或是回收。因此,笔者以污泥浓缩液为研究对象,研究MgNH4PO4·6H2O 沉淀形成过程中影响磷回收的因素,探讨磷回收率高且磷酸铵镁纯度较高的控制条件。
1 实验部分
1.1 实验试剂
(1)废水水质 水样来自泰州市某污水处理厂生物处理污泥浓缩池上清液,通过采样分析,废水水质如下:SS=56mg·L-1,=46.7mg·L-1,17.3mg·L-1=1.04mmol·L-1,=3.08mmol·L-1,pH 值为7.26。
(2)实验试剂 KH2PO(4AR 南京化学试剂股份有限公司);抗坏血酸(上海晶抗生物工程有限公司)、(NH4)2MoO4(南京化学试剂股份有限公司)、酒石酸锑钾(湖北威尔曼化学科技有限公司)、CaCO3(湖北齐飞医药化工有限公司)、MgO(南通理漫化工有限公司)、HNO3(南京化学试剂股份有限公司)、NH4Cl(上海晶抗生物工程有限公司)、NaOH(南京化学试剂股份有限公司)、KI(南京化学试剂股份有限公司)、HgCl2(南京化学试剂股份有限公司)、酒石酸钾钠(安徽艾博生物科技有限公司),以上均为分析纯。
1.2 实验仪器
ML204 型电子分析天平(北京联合科仪科技有限公司);Agilent 8453 型紫外可见分光光度计(安捷伦科技有限公司);雷磁pH-3C 型pH 计(上海仪电科学仪器有限公司);TAS990 型原子吸收分光光度计(北京普析通用仪器有限责任公司)。
1.3 实验方法
(1)磷酸盐的测定 HJ670-2013《水质 磷酸盐和总磷的测定 连续流动-钼酸铵分光光度法》试样中的磷酸盐在酸性介质中、锑盐存在下,与(NH4)2MoO4反应生成磷钼杂多酸,该化合物立即被抗坏血酸还原生成蓝色络合物,于波长880nm 处测量吸光度[4]。
(2)Mg2+和Ca2+的测定 GB11905-89《水质 钙和镁的测定原子吸收分光光度法》将试液喷入火焰中,使镁原子化,在火焰中形成的基态原子对特征谱线产生选择性吸收,由测得的样品吸光度和校准溶液的吸光度进行比较,确定样品中被测元素的浓度,选用422.7nm 共振线的吸收测定Ca2+,用285.2nm共振线的吸收测定Mg2+。
(3)NH++44-N 的测定 HJ535-2009《水质 氨氮的测定 纳氏试剂分光光度法》以游离态的NH3或NH++44等形式存在的NH++44-N 与钠氏试剂反应生成淡红棕色络合物,该络合物的吸光度与NH++44-N 含量成正比,于波长420nm 处测量吸光度[5]。
2 结果与分析
移取一定量污水,调节污水pH 值,以一定的速度搅拌,反应一段时间后,静置30min,测定上清液磷酸盐含量,计算磷的回收率。
2.1 pH 值的影响
磷酸铵镁(MgNH4PO4·6H2O)是一种碱性盐,在酸性溶液中溶解,碱性溶液可促进其沉淀生成[6],所以用磷酸铵镁沉淀法回收磷一定要在碱性溶液中进行。污泥浓缩池上清液中含有Ca2+、Mg2+、NH++44-N、PO34-,pH 值过高会有Mg(OH)2沉淀或Mg(3PO4)2生成,导致MgNH4PO4·6H2O 不纯,影响其肥效;pH 值过高,如pH 值大于10,会使污水中NH++44-N 转变成NH3从水体中溢出。因此,pH 值需控制在碱性条件下但不宜过高,选择pH 值为7~10。为探讨pH 值对MgNH4PO4·6H2O 沉淀的影响及找出最佳pH 值,本实验对pH 值为8.0、8.5、9.0、9.5、10.0 进行实验研究,结果见图1。
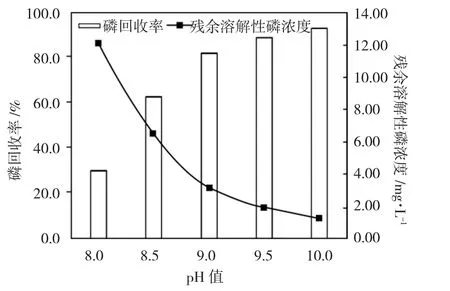
图1 pH 值对磷回收率及残余溶解性磷浓度的影响Fig.1 Influence of pH on phosphorus recovery and residual dissolved phosphorus concentration
由图1 可见,随着pH 值的增加,磷回收率增加,当pH 值为10.0 时,磷的回收率超过90%,水体中残余溶解性磷含量仅为1.20mg·L-1,因此,pH 值在8.0~10.0 范围内是越高越好。
为探讨最佳pH 值,继续测定不同pH 值时污泥上清液中剩余离子浓度。结果见图2。

图2 污泥上清液中剩余离子浓度与pH 值的关系Fig.2 Relationship between residual ion concentration in sludge supernatant and pH
由图2 可见,随着pH 值的增大,剩余NH++44浓度变化不大,Ca2+和PO34-有一定程度降低,说明沉淀中含有除MgNH4PO·46H2O 以外的沉淀物。根据废水水质中NH++44-N、Mg2+、Ca2+、PO34-浓度及MgNH4PO·46H2O、Mg(OH)2、Mg(3PO)42、Ca(3PO)42、CaHPO4的 溶 度 积 可知[7],上述各物质的离子积均大于溶度积,均会有沉淀生成,这意味着MgNH4PO4·6H2O 中会有副产物Mg(OH)2、Mg(3PO)42、Ca(3PO)42、CaHPO4等,这会影响其纯度。
Mg2++NH++44+PO34-+6H2O=MgNH4PO4·6H2O↓,理论上Mg2+、NH++44、PO34-参与反应的摩尔比为1∶1∶1[8],现分析不同pH 值下消耗的Ca2+、NH++44、PO34-的量,结果见图3。
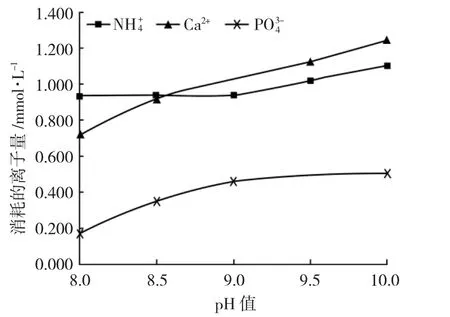
图3 反应中消耗的离子量与pH 值的关系Fig.3 Relationship between amount of ions consumed in the reaction and pH
由图3 可见,随着pH 值的升高,Ca2+、NH++44、PO34-的消耗量在不断增加,NH++44的消耗量远大于PO34-的消耗量,这是因为pH 值的升高使NH++44生成NH3从水体中溢出,无法生成MgNH4PO·46H2O 沉淀。Ca2+的消耗量大于PO34-的消耗量,说明随着pH 值增加,可能会有Ca2+转化为Ca(3PO4)2或者其他难溶的磷酸盐的产物,MgNH4PO·46H2O 纯度降低。
pH 值增加磷回收率不断增加,但副反应会增加,MgNH4PO4·6H2O 纯度降低;实际工程运行过程中,pH 值过高会增加药剂成本,同时还会对废水的后续处理产生影响,综上所述,pH 值不宜过高,故选择pH 值为9。
2.2 搅拌速度的影响
搅拌有利于沉淀反应中沉淀物质的生成,搅拌速度小,物质混合不均匀,只会形成较小的悬浮絮凝物,不利于沉淀产生。搅拌速度过大又会使形成的沉淀絮体体系被打破,影响物质沉淀,因此,在MgNH4PO4·6H2O 沉淀反应中需考察搅拌速度对沉淀反应及磷回收率的影响。设定溶液pH 值为9,反应时间为20min,探讨搅拌速度为0、10、40、60、80r·min-1对磷回收率的影响。
由图4 可见,随搅拌速度增加,磷回收率也逐步增加。搅拌速度达到40r·min-1后磷回收率没有明显的增加,残余溶解性磷浓度也没有明显的变化,说明搅拌速度宜选择40~80r·min-1。

图4 搅拌速度对磷回收率及残余溶解性磷浓度的影响Fig.4 Influence of mixing speed on phosphorus recovery and residual dissolved phosphorus concentration
实验操作中观察到,当搅拌速度为40r·min-1时,能生成较大絮凝体,且分布均匀,静置后絮凝体能快速沉降至底部,上清液中无悬浮物,沉淀效果好;当搅拌速度为60 和80r·min-1时,静置后絮凝体能迅速沉于底部,但絮凝体较小且形状不一致,可能是随着搅拌速度的加快,会对已形成的晶体有一定干扰,对沉降有不良影响。
结合图4 和沉淀现象,同时考虑减小废水处理成本,搅拌速度选为40r·min-1较为合理。
由图5 可见,随着搅拌速度的增加,NH++44、PO34-的消耗量逐步增加,Ca2+的消耗量几乎不发生变化,可以推测出没有Ca2+副反应物生成,MgNH4PO4·6H2O纯度高。所以在40r·min-1搅拌强度下,有较高的磷回收率,MgNH4PO4·6H2O 纯度较高,沉降效果良好,同时还降低了能耗。
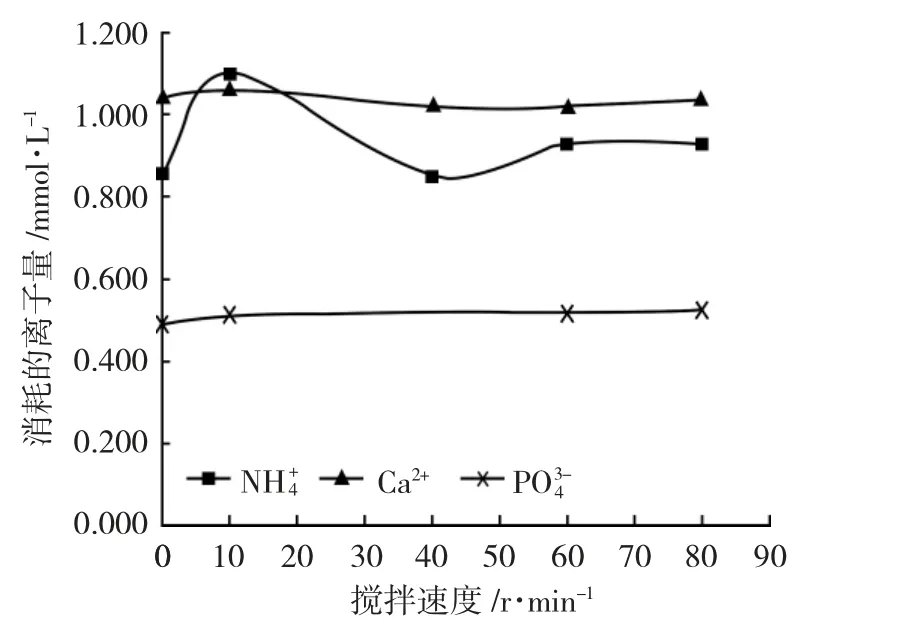
图5 反应中消耗的离子量与搅拌速度的关系Fig.5 Relationship between amount of ions consumed in the reaction and stirring intensity
2.3 反应时间的影响
在pH 值为9,搅拌速度40r·min-1,考察反应时间为10、15、20、25、30min 对沉淀效果的影响。结果见图6~8。

图6 反应时间对磷回收率及残余溶解性磷浓度的影响Fig.6 Influence of reaction time on phosphorus recovery and residual dissolved phosphorus concentration
由图6 可见,磷回收率随着反应时间延长而增加,20min 时达到90.7%,之后回收率不升反降,这可能是MgNH4PO4·6H2O 结晶体系稳定时间有限,随着反应时间的增加,MgNH4PO4·6H2O 结晶体系沉降性能下降,上清液中磷酸盐含量增加。
由图7 可见,随着反应时间增加,污泥上清液中NH++44含量下降,PO34-含量开始时降低,20min 后不降反升,Ca2+含量基本维持稳定,说明MgNH4PO·46H2O稳定性在反应20min 时较好且纯度较高,不含Ca2+的其他副产物。
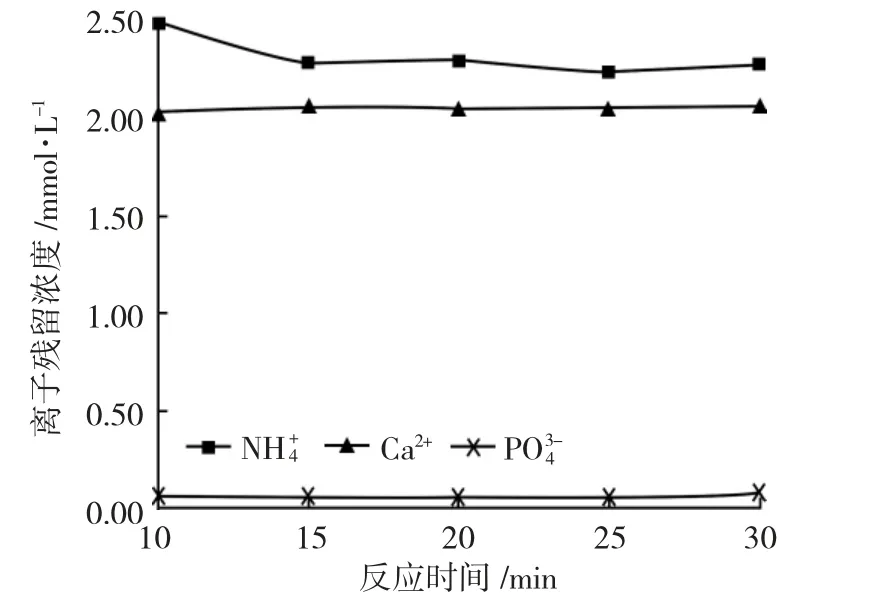
图7 污泥上清液中剩余离子浓度和反应时间关系Fig.7 Relationship between residual ion concentration in sludge supernatant and reaction time
由图8 可见,NH++44和PO34-的消耗量到20min 时最大,之后降低,Ca2+消耗量基本稳定,也说明了反应20min 较好。同时依据实验现象,随着反应时间加长,絮凝体不断增大,到20min 时,絮凝体形状不一致,且分布均匀,静置后能迅速沉降,说明沉降效果良好,因此,20min 反应时间较为合理。
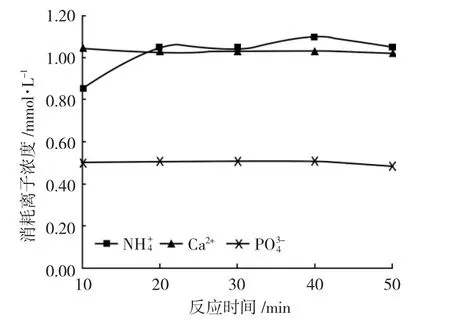
图8 反应中消耗的离子量与反应时间的关系Fig.8 Relationship between amount of ions consumed in the reaction and reaction time
3 结论
以污泥浓缩液为实验对象,研究MgNH4PO·46H2O沉淀形成过程中影响磷回收的因素,探讨磷回收率高且MgNH4PO·46H2O 纯度较高的控制条件。
磷回收率随着pH 值的增加而增加,当pH 值为9 时,磷回收率较高,副产物较少,MgNH4PO4·6H2O纯度较高;搅拌强度增加到40r·min-1时,磷回收率高,上清液残余磷浓度也较低,继续增加搅拌强度,磷回收率反而下降;MgNH4PO4·6H2O 沉淀反应很快,反应10min 时,磷回收率即接近90%,到20min时,磷回收率最大。因此,较好的控制条件为pH 值为9、搅拌速度为40r·min-1、反应时间为20min 时,此时回收率可达到90%以上,MgNH4PO4·6H2O 纯度也较高,废水处理成本也相对合理。
