培美曲塞联合紫杉醇、顺铂化疗方案对晚期肺癌肿瘤标志物水平的影响
2023-07-27李祥,陈娟,张超
李 祥,陈 娟,张 超
1.北京市门头沟区医院呼吸与危重症医学科,北京 102300;2.首都医科大学门头沟教学医院呼吸与危重症医学科,北京 102300;3.北京中医药大学中药学院,北京 100102
非小细胞肺癌占肺癌的绝大多数,在发病初期无明显症状,或是伴随咳嗽和发热等与其他常见病相似的症状,很难及时确诊,被发现时多已是晚期[1]。临床上常使用紫杉醇联合顺铂(paclitaxel and cisplatin,TP)化疗方案治疗晚期肺癌,效果明显[2]。有研究报道,在顺铂治疗的基础上联合应用培美曲塞,可以缓解晚期肺癌的不良反应[3]。本研究探讨培美曲塞联合TP化疗方案治疗晚期肺癌对血清细胞角蛋白19片段抗原21-1(chemotherapy on serum cyto-keratin fragment antigen 21-1,CYFRA21-1)、糖类抗原125(carbohydrate antigen 125,CA125)和癌胚抗原(carcino-embryonic antigen,CEA)水平,不良反应及无进展生存期(progression-free survival,PFS)的影响,旨在为临床寻找更合适的晚期肺癌治疗方案。
1 资料与方法
1.1 一般资料
选取北京市门头沟区医院收治的112例晚期肺癌患者,随机分为治疗组与对照组,每组56例。纳入标准:①经病理学确诊为晚期肺癌;②预计生存期>4个月。排除标准:①合并免疫缺陷、心肝肾功能障碍、其他恶性肿瘤和肺部疾病者;②精神类疾病患者;③对本研究使用的药物过敏者。其中对照组男36例,女20例;年龄31~72岁,平均(49.32±8.82) 岁;病程2~14个月,平均(7.64±2.26) 个月;有吸烟史32例;肿瘤分期:Ⅲ期19例,Ⅳ期37例。治疗组男41例,女15例;年龄30~72岁,平均(49.69±8.77) 岁;病程3~15个月,平均(7.76±2.34) 个月;有吸烟史29例;肿瘤分期:Ⅲ期13例,Ⅳ期43例。2组患者基础资料比较差异无统计学意义(P>0.05)。本研究经学院伦理委员会批准,所有患者或家属知情并签署知情同意书。
1.2 治疗方法
2组患者于化疗前7 d至化疗结束后21 d口服亚叶酸钙(山西泰盛制药有限公司),400 μg·d-1,同时肌肉注射维生素B12注射液(湖北天药药业股份有限公司),每次1 000 μg,每21 d注射1次;给药前1天、当天、次日口服醋酸地塞米松片(浙江仙琚制药股份有限公司),9 mg·d-1。对照组给予TP方案治疗,化疗第1天,将紫杉醇注射液(泰素,百时美施贵宝公司)13 mg·m-2溶于500 mL生理盐水中,静脉滴注3 h;第1~3天,顺铂注射液(云南个旧生物药业有限公司)30 mg·m-2,静脉滴注。治疗组在对照组治疗的基础上联用培美曲塞治疗,化疗第1天,给予培美曲塞二钠注射液(力比泰,美国礼来公司),500 mg·m-2·d-1,静脉滴注。2组以21 d为1个周期,均治疗4个周期。
1.3 观察指标
于治疗后评估患者的临床疗效[4]:进展,肿瘤体积增大或有新病灶产生;稳定,肿瘤体积缩小,但未达到原体积的1/2;部分缓解,肿瘤体积缩小1/2以上,1个月无变化;完全缓解,肿瘤彻底消失。总有效率=[(部分缓解的例数+完全缓解的例数)/总例数]×100%。
于治疗前、后采集患者的静脉血,分离血清,使用全自动化学发光免疫分析仪(贝克曼库尔特有限公司)测定肿瘤标志物的水平[血清细胞角蛋白19片段抗原21-1(cytokeratin fragment antigen 21-1,CYFRA21-1)、糖类抗原125(carbohydrate antigen 125,CA125)和癌胚抗原(carcino-embryonic antigen,CEA)]的水平。
于治疗前,治疗2、4周期后使用数字分级评分法[5](numerical rating scale,NRS)评估癌痛,分数范围为0~10分,分数越高,表明癌痛越剧烈。
记录治疗期间血常规、肝功能、胃肠道反应、脱发等不良反应的发生情况,以评价治疗的安全性。
于治疗后对2组患者通过电话和上门的方式随访1年,统计患者的1年生存率和PFS。
1.4 统计学方法
2 结果
2.1 临床疗效的比较
治疗后,治疗组的总有效率为60.71%,高于对照组的总有效率(37.50%)(P<0.05)。结果见表1。
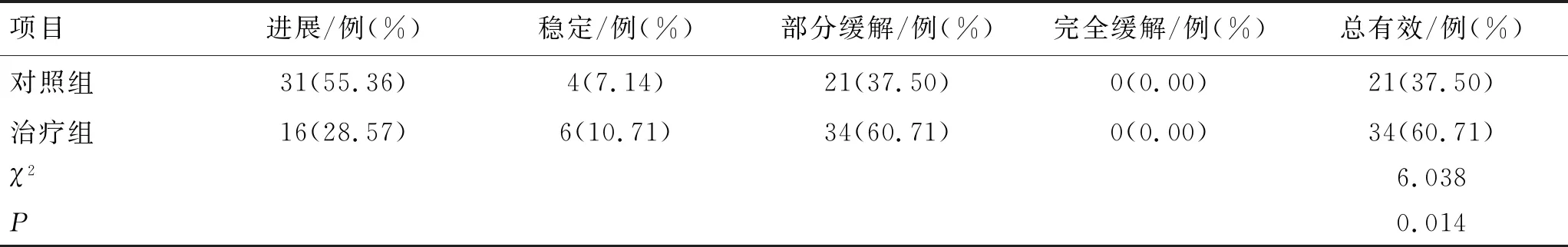
表1 2组临床疗效的比较 (n=56)
2.2 肿瘤标志物指标的比较
治疗后,2组CYFRA21-1、CA125和CEA的水平均低于治疗前,且治疗组CYFRA21-1、CA125和CEA的水平均低于对照组。结果见表2。
2.3 NRS评分的比较
治疗2、4周期后,2组的NRS评分均低于治疗前,且治疗组的NRS评分低于对照组(P<0.05)。结果见表3。

表3 2组NRS评分的比较
2.4 不良反应发生情况的比较
治疗期间治疗组发生恶心呕吐、白细胞减少和脱发的例数少于对照组(P<0.05),发生肾功能损伤例数比较差异无统计学意义(P>0.05)。结果见表4。

表4 2组不良反应发生情况的比较 (n=56)
2.5 1年生存情况的比较
治疗后,治疗组的1年生存率和PFS分别为87.50%、(6.18±0.27) 个月,高于对照组的67.86%和(5.26±0.35) 个月(P<0.05)。
3 讨论
有学者认为,肺癌的形成与遗传、日常活动和环境有关,此外,部分慢性呼吸道疾病也能诱发肺癌[6]。早期肺癌在临床上多使用手术治疗,可有效降低复发[7]。但是早期肺癌不容易被发现,患者常错过最佳治疗时机,使肺癌发展为晚期[8]。对于晚期肺癌,手术不容易彻底消除病灶,病灶有可能转移,导致肿瘤复发,大部分晚期患者采用化疗方案治疗[9]。紫杉醇具有抑制癌细胞有丝分裂过程的作用,可与微管蛋白结合,使癌细胞稳定停留在M和G2期,从而抑制癌细胞的增殖、分化[10]。顺铂可干扰癌细胞DNA功能,阻止DNA复制,与紫杉醇联合使用,能提升疗效[11]。但是紫杉醇与顺铂联用作为标准的TP化疗方案,在抑制癌细胞的同时,不能特异性识别正常细胞,会破坏正常细胞的功能,影响预后效果[12]。有研究报道[13],TP方案会减少白细胞数量,增加神经毒性,引发消化道反应和骨髓抑制。培美曲塞作为抗叶酸制剂,分子结构中包括吡咯嘧啶基团,具有抑制肿瘤增殖、分化的作用[14]。在细胞内,其可阻断叶酸正常代谢需要的原料,减少细胞复制[15]。因此,本研究探讨培美曲塞联合TP化疗方案在治疗晚期肺癌中的临床疗效。
肿瘤标志物在正常人体中的含量极低,常存在于癌症患者的细胞组织、体液和排泄物中,因此可以被用于预测癌症的发展情况[16]。有研究报道,在晚期肺癌患者中,血清CYFRA21-1、CA125和CEA等肿瘤标志物的水平会升高,且分期越晚,水平越高[17]。彭东旭等[18]研究结果表明,在顺铂的基础上联用培美曲塞治疗,可以降低肿瘤标志物的水平,与本研究结果一致。治疗后,治疗组的临床疗效和肿瘤标志物水平优于对照组,表明在TP化疗方案的基础上联用培美曲塞治疗可以提高临床疗效,延缓晚期肺癌的进展。培美曲塞通过搭乘叶酸受体蛋白或叶酸的载体,跨膜到达细胞内,进入细胞后,叶酰多谷氨酸合成酶将其转化为多谷氨酸,可减弱核苷酸合成过程中必需酶的活性,从而使肿瘤细胞停留在S期,抑制肿瘤细胞的增殖。结果显示,治疗后,治疗组的NRS评分低于对照组,表明培美曲塞联合TP化疗方案治疗可以缓解患者的疼痛症状。培美曲塞可以减弱中枢神经对疼痛的敏感度,进而减轻患者的疼痛反应。张旭宇等[19]研究发现,与标准TP方案相比,培美曲塞联合顺铂可以减少不良反应。治疗期间治疗组发生恶心呕吐、白细胞减少和脱发的例数少于对照组,表明培美曲塞联合TP化疗方案治疗可以改善不良反应。治疗后,治疗组1年生存情况优于对照组,表明在TP化疗方案的基础上联用培美曲塞治疗可以延长患者的生存期。邱培等[20]研究亦发现,培美曲塞联合其他药物,可以提高患者的生存率。培美曲塞具有靶向性,可直接定位并作用于病变区域,从而提升疗效,改善患者的生存情况。
综上所述,培美曲塞联合TP化疗方案治疗晚期肺癌可以有效提高临床治疗效果,延缓癌症进展,减轻癌痛和不良反应,延长患者的生存期。TP方案的不良反应主要来自顺铂,与培美曲塞联用可以减少不良反应,可能是由于培美曲塞恰好抑制了顺铂的某些作用,但关于其具体作用机制,还需进一步研究。
