缩宫素对流产大鼠子宫出血凝血功能的影响
2023-07-27王蔷薇张凤莲
王蔷薇,张凤莲,李 辉
1.河南黄河科技学院附属医院妇产科,郑州 450000;2.南阳市中心医院妇产科,南阳 473000
米非司酮配伍米索前列醇是药物流产的常用药物,其效果显著,妊娠7周内完全流产率超过90%[1]。但部分患者存在流产后子宫异常出血问题,易诱发月经紊乱、贫血等并发症,甚至造成突发性大出血[2]。缩宫素是孕妇分娩过程中常用的催产药物,可刺激子宫平滑肌收缩、促进子宫颈扩张,且具有催乳及降低血压的作用,近年来研究发现,其可用于治疗药物流产后的子宫出血,可增强子宫收缩、促进月经复潮,但其作用机制尚不明确[3]。本研究通过建立流产大鼠子宫出血模型,探讨缩宫素对其凝血功能的影响及其可能的机制。
1 仪器与材料
1.1 仪器
C2000血凝分析仪(深圳迈瑞生物医疗电子股份有限公司);Gemini XPS酶标仪(美国Molecular Devices公司);BX43显微镜(日本Olympus公司)。
1.2 试药
缩宫素(规格为10 U·mL-1,南京新百药业有限公司);米非司酮片(规格为25 mg、0.2 mg,上海新华联制药有限公司);孕酮酶联免疫吸附试验(enzyme linked immunosorbent assy,ELISA)试剂盒、雌二醇ELISA试剂盒及免疫组织化学染色试剂盒,均购自上海抚生实业有限公司;兔抗大鼠CD31、血管内皮细胞生长因子(vascularendothelial growth factor,VEGF)及基质金属蛋白酶-9(matrix metallo-proteinase-9,MMP-9)一抗均购自美国R&D公司。
1.3 动物
75只SPF级SD大鼠[雄性:25只,8周龄,体质量为(300±15) g;未孕雌性:50只,8周龄,体质量为(240±10) g],均购自上海市计划生育科学研究所实验动物经营部,生产许可证号为SCXK(沪)2018-0006。
2 方法
2.1 模型建立
建立流产大鼠子宫出血模型[4],将处于发情期的大鼠按雌雄比例2∶1合笼,次日早晨进行阴道液涂片检查,观察到有阴栓或精子即为受孕成功,记为受孕第1日,第7日9:00,灌胃米非司酮(11.4 mg·kg-1),10 h后灌胃米索前列醇(125 μg·kg-1),阴道内塞入大小合适的消毒棉球,次日8:00取出,观察棉球有血迹即为建模成功,将棉球置于离心管冷藏保存并更换新棉球,每日8:00、18:00取出保存,持续7 d。
2.2 分组及干预
75只大鼠合笼交配,共得孕鼠45只,36只孕鼠全部成功建立流产子宫出血模型,随机分为流产组及缩宫素低剂量、中剂量和高剂量组,各9只,剩余9只孕鼠造模同时灌胃等量生理盐水,设为正常组。造模后次日,根据《药理试验中动物间和动物与人体间的等效剂量换算》进行换算,缩宫素低剂量、中剂量、高剂量组皮下注射缩宫素(剂量分别为1、2、4 u·kg-1);正常组、流产组皮下注射等量生理盐水。每日1次,干预7 d[5-6]。
2.3 组织取材
末次干预次日,腹腔注射戊巴比妥钠麻醉大鼠,采集腹主动脉血,取微量冷藏,用于测定出血量,部分加入抗凝剂冷藏,用于检测凝血指标,剩余血液以3 000 r·min-1离心5 min(离心半径为8 cm)获取血清,冷藏,用于检测性激素;采血后脊椎脱臼处死大鼠,冰上开腹取得完整子宫,切取部分子宫及子宫内膜组织,经40 g·L-1多聚甲醛固定,脱水、透明、浸蜡及包埋,切成4 μm厚度,分别用于HE染色及免疫组织化学染色;另取部分子宫内膜组织投入液氮中保存,用于相关蛋白的检测。
2.4 子宫出血量检测
取冷藏腹主动脉血0.02 mL,滴入50 g·L-1氢氧化钠溶液4 mL中溶解;将收集7 d出血棉球投入50 g·L-1氢氧化钠溶液,浸泡、搓洗出全部血液,用分光光度计检测动脉血溶解液与血棉球浸出液在546 nm波长处的吸光度值,计算子宫出血量。子宫出血量(mL)=(腹主动脉血体积×血棉球溶解50 g·L-1氢氧化钠溶液体积×血棉球浸出液吸光度值)/(腹主动脉血溶解50 g·L-1氢氧化钠溶液体积×腹主动脉血溶解液吸光度值)。
2.5 凝血功能指标检测
取通过抗凝剂冷藏保存的腹主动脉血,用血凝分析仪检测各组血液凝血功能指标:凝血酶时间(thrombin time, TT)、凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)。
2.6 血清孕酮、雌二醇水平检测
取冷藏的腹主动脉血清,用ELISA法测定血清孕酮、雌二醇的质量浓度,按照试剂盒说明书操作,用酶标仪测定546 nm波长处的吸光度值,绘制标准曲线,计算血清孕酮、雌二醇的质量浓度。
2.7 子宫内膜微血管密度检测
取子宫内膜组织切片,二甲苯脱蜡,用免疫组织化学法观察子宫内膜微血管新生情况,浸入30 g·L-1过氧化氢溶液静置10 min,取出,滴入抗原修复液,微波高温修复抗原,自然冷却至40 ℃,蒸馏水冲洗,加入胎牛血清封闭30 min,弃血清,加入兔抗大鼠CD31一抗(1∶500),4 ℃冷藏过夜,加入二抗(1∶2 000),室温孵育2 h,PBS清洗,DAB显色,苏木精复染,常规脱水后滴加中性树脂封片,随机选取5个不相邻血管密集区视野,将棕褐色内皮细胞或细胞群记录为1个血管,记录视野内血管总数,计算微血管密度(microvessel density,MVD)。
2.8 HE染色观察子宫组织病理变化
取子宫组织切片,二甲苯脱蜡,梯度乙醇水化,经常规苏木素-伊红染色,脱水、透明,中性树脂封片,置于光学显微镜下观察子宫组织的病理改变。
2.9 免疫印迹法检测子宫内膜组织VEGF、MMP-9蛋白表达
取用液氮保存的子宫内膜组织,用眼科剪剪碎,充分研磨并匀浆,用RIPA裂解液裂解细胞,注入离心管内,冰上以10 000 r·min-1离心10 min(离心半径为12 cm),取上清经BCA试剂盒定量蛋白。取微量蛋白样本,加入上样缓冲液混匀,水浴加热变性蛋白,电压80 V行凝胶电泳分离,湿法转膜,加入50 g·L-1脱脂牛奶封闭2 h,TBST清洗,混合兔抗大鼠VEGF、MMP-9一抗(1∶500),4 ℃冷藏过夜,加入二抗(1∶2 000),室温孵育2 h,ECL发光,暗盒显影,用成像分析仪扫描并分析蛋白条带的灰度值,VEGF或MMP-9蛋白相对表达量=VEGF或MMP-9蛋白条带的灰度值/内参GAPDH条带的灰度值。
2.10 统计学方法
3 结果
3.1 子宫出血量比较
与流产组比较,缩宫素低剂量组子宫出血量减少(P<0.05);与缩宫素低剂量组比较,缩宫素中剂量组子宫出血量减少(P<0.05);与缩宫素中剂量组比较,缩宫素高剂量组子宫出血量减少(P<0.05)。见表1。
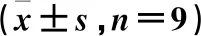
表1 各组大鼠子宫出血量的比较
3.2 凝血功能指标比较
与正常组比较,流产组TT、PT及APTT延长(P<0.05);与流产组比较,缩宫素低剂量组TT、PT及APTT缩短(P<0.05);与缩宫素低剂量组比较,缩宫素中剂量组TT、PT及APTT缩短(P<0.05);与缩宫素中剂量组比较,缩宫素高剂量组TT、PT及APTT缩短(P<0.05)。见表2。

表2 各组大鼠凝血功能指标的比较
3.3 性激素指标比较
与正常组比较,流产组血清孕酮、雌二醇水平降低(P<0.05);与流产组比较,缩宫素低剂量组血清孕酮、雌二醇水平升高(P<0.05);与缩宫素低剂量组比较,缩宫素中剂量组血清孕酮、雌二醇水平升高(P<0.05);与缩宫素中剂量组比较,缩宫素高剂量组血清孕酮、雌二醇水平升高(P<0.05)。见表3。
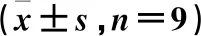
表3 各组大鼠血清性激素指标的比较
3.4 子宫内膜MVD比较
与正常组比较,流产组子宫内膜MVD降低(P<0.05);与流产组比较,缩宫素低剂量组子宫内膜MVD升高(P<0.05);与缩宫素低剂量组比较,缩宫素中剂量组子宫内膜MVD升高(P<0.05);与缩宫素中剂量组比较,缩宫素高剂量组子宫内膜MVD升高(P<0.05)。见表4、图1。
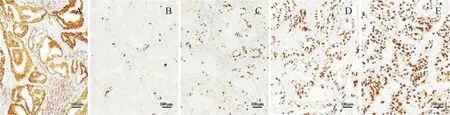
注:A.正常组;B.流产组;C.缩宫素低剂量组;D.缩宫素中剂量组;E.缩宫素高剂量组。

表4 各组大鼠子宫内膜MVD的比较
3.5 子宫组织病理变化
HE染色结果显示,正常组子宫内膜厚度、形态正常;流产组子宫内膜、平滑肌厚度减小,结构破坏严重,子宫内膜大面积脱落,宫腔扩张;缩宫素低剂量、中剂量、高剂量组内膜结构基本完整,内膜修复情况良好,宫腔扩张基本恢复,平滑肌增厚,随缩宫素剂量的增加病理改善愈加显著。见图2。

注:A.正常组;B.流产组;C.缩宫素低剂量组;D.缩宫素中剂量组;E.缩宫素高剂量组。
3.6 子宫内膜VEGF、MMP-9蛋白的表达量比较
与正常组比较,流产组子宫内膜VEGF、MMP-9蛋白的表达量升高(P<0.05);与流产组比较,缩宫素低剂量组子宫内膜VEGF、MMP-9蛋白的表达量降低(P<0.05);与缩宫素低剂量组比较,缩宫素中剂量组子宫内膜VEGF、MMP-9蛋白的表达量降低(P<0.05);与缩宫素中剂量组比较,缩宫素高剂量组子宫内膜VEGF、MMP-9蛋白的表达量降低(P<0.05)。见表5、图3。

表5 各组大鼠子宫内膜VEGF、MMP-9蛋白表达量的比较
4 讨论
药物流产是依靠米非司酮孕激素受体拮抗剂的特性,竞争性结合位于子宫内膜及宫颈体的孕激素受体结合位点,致使滋养细胞死亡、胚胎发育停滞,再通过米索前列醇的促宫颈胶原降解作用,使宫颈软化、子宫收缩,刺激妊娠物排出[7]。药物流产后,由于子宫收缩不良,淤血及妊娠残留物未完全排出,大量病菌繁殖导致宫腔感染,促进血栓脱落,诱发出血,同时米非司酮具有抗凝血特性,将进一步延长出血时间,阻碍子宫内膜血管新生[8-9]。因此,恢复正常凝血功能、促进子宫内膜修复是治疗药物流产后子宫出血的关键。
雌二醇是机体分泌的天然性激素,可刺激子宫内膜生长,修复破损内膜,抑制宫颈黏液分泌,提升子宫对缩宫素的敏感性,促进淤血及残留物排出[10-11]。孕酮可抑制促性腺激素分泌,降低雌激素水平,促进内膜组织蜕膜萎缩并促进其排出[12]。CD31是血管内皮细胞标志物之一,可准确反映组织器官MVD,而子宫内膜MVD是评价子宫内膜修复情况的重要指标之一[13]。缩宫素是由垂体后叶分泌的一种环状多肽类激素,经神经垂体缓慢释放,可舒缓压力、增加组织供氧,可与子宫平滑肌内的受体结合,激活钙离子泵,促使肌浆网释放钙,从而促进子宫节律性收缩,封闭子宫肌层血管,抑制子宫出血[14]。WHITEHOUSE K等[15]研究发现,预防性注射缩宫素可降低在扩张和排空期间子宫的失血量及失血频率,提示其可作为抑制子宫出血的备选药物。本研究结果显示,与流产组比较,缩宫素低剂量、中剂量和高剂量组子宫出血量减少,TT、PT、APTT缩短,血清孕酮、雌二醇水平、子宫内膜MVD升高,表明缩宫素可抑制子宫出血、增强凝血功能、改善性激素水平和促进子宫内膜生长。
VEGF是机体调控血管生成的重要调控分子之一,可与血管内皮细胞促有丝分裂受体结合,促进内皮细胞增殖,当子宫受损后,VEGF参与子宫内膜血管修复而表达增加,但过度表达将导致血管过度扩张、血管通透性提升,加重子宫出血,对子宫内膜恢复造成不利影响[16]。MMP-9是细胞外基质及基底膜降解蛋白酶,参与多种出血类疾病的发生和发展,正常状态下受孕酮限制其处于低表达状态[17]。流产后机体孕酮水平降低,MMP-9在VEGF的刺激下大量合成、分泌,血管基底膜被大量降解,血管基本结构受创且脆性增加,炎症反应进一步加重,子宫内膜修复困难,子宫出血量增加[18-19]。赵永新等[20]研究发现,抑制VEGF、MMP-9表达可治疗围绝经期子宫肌瘤并发的异常子宫出血,提示二者可能作为治疗子宫出血的有效靶点。本研究结果显示,与正常组比较,流产组子宫组织VEGF、MMP-9蛋白的表达量升高,经缩宫素干预后二者表达量降低,且表现为剂量依赖,表明VEGF、MMP-9在流产子宫出血中异常高表达,缩宫素可能通过降低二者表达治疗药物流产后子宫出血。
综上所述,缩宫素可抑制子宫出血、提升凝血功能、改善性激素水平、促进子宫内膜生长,推测其作用机制可能与抑制VEGF、MMP-9的表达有关。
