当归多糖对多囊卵巢综合征大鼠氧化应激状态改善的机制
2023-07-27钮红丽翟一阳马志宾周晓景
钮红丽,翟一阳,王 莉,马志宾,周晓景
1.河南大学附属南阳市第一人民医院生殖中心,南阳 473000;2.洛阳市中心医院生殖医学科,洛阳 471000
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是临床常见的内分泌紊乱疾病[1]。PCOS易引发胰岛素抵抗、血脂代谢紊乱、糖尿病等疾病[2]。目前PCOS临床治疗多以服用激素类药物为主,存在服用周期长、毒性和不良反应多等缺点[3]。当归多糖(Angelicasinensispolysaccharide, ASP)具有抗氧自由基损伤、抗炎、降糖、降脂、补血、活血等药理作用[4]。研究表明ASP可通过减轻氧化应激反应缓解PCOS患者的症状[5]。本研究通过建立PCOS大鼠模型,探讨ASP对PCOS大鼠氧化应激状态的改善作用及可能的作用机制,旨在为ASP药物的开发及PCOS的临床治疗提供参考依据。
1 仪器与材料
1.1 仪器
BX53全自动显微镜扫描系统(日本Olympus公司);组织切片机(RM2235,德国LEICA公司);垂直电泳仪(Bio-rad1658001,美国Bio-Rad公司)。
1.2 试药
当归多糖(质量分数≥98%,货号为Y11898,西安金萃坊植物技术开发有限公司);来曲唑片(国药准字H203428,海南锦瑞制药有限公司);二甲双胍(常州制药厂有限公司);雌二醇(estradiol, E2)、促黄体生成素(luteinizing hormone, LH)、睾酮(testosterone, T)、促卵泡生成素(follicle stimulating hormone, FSH)、酶联免疫吸附试验(enzyme linked immunosorbent assy,ELISA)试剂盒均购自北京雅安达生物科技有限公司;丙二醛(malondialdehyde, MDA)、超氧化物岐化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)ELISA试剂盒均购自南京建成生物工程研究所;抗β-actin兔多克隆抗体、兔抗核因子E2相关因子2(nuclearfactor erythroidderived 2-like 2,Nrf2)、血红素加氧酶1(heme oxygenase-1,HO-1)单克隆抗体、辣根过氧化物酶标记二抗均购自北京百奥莱博科技有限公司。
1.3 实验动物
60只7周龄SPF级雌性SD大鼠,合格证号为SCXK(京)2016-0011,购自北京维通利华实验动物技术有限公司。体质量约为(210±20) g,清洁级饲养,环境温度为(23 ℃±2 ℃),环境相对湿度为55%~65%,环境光暗周期为昼12 h、夜12 h,通风良好,所有大鼠共同进行7 d的适应性饲养,期间提供充足的饮水和普通饲料,饲养环境符合实验动物环境设施要求。
2 方法
2.1 PCOS大鼠模型的建立
7 d适应性饲养后,随机选取48只大鼠每天上午同一时间灌胃给药0.5 mg·kg-1来曲唑溶液建立PCOS模型[6],连续给药21 d。造模第11天开始同一时间进行阴道细胞涂片,对比动情周期变化。大鼠动情周期平均为5 d,不在此范围则视为动情周期紊乱,模型组大鼠动情周期全部无规律则视为建模成功[7]。
2.2 分组与给药
将造模成功的大鼠随机分为模型组、ASP低剂量组、ASP高剂量组和西药组,各12只;其余大鼠作为对照组(12只)。参照文献中的方法[8-9],ASP低剂量和高剂量组分别灌胃给药50、200 mg·kg-1ASP(用生理盐水配制),西药组灌胃给药200 mg·kg-1二甲双胍溶液,对照组及模型组给予等量生理盐水,各组给药每日1次,连续给药28 d。
2.3 标本采集
末次给药后,所有大鼠禁食、不禁水,24 h后腹腔注射戊巴比妥钠麻醉,摘取眼球取血,静置30 min,4 ℃下以3 000 r·min-1高速离心15 min,离心半径为12 cm,分离血清,-20 ℃保存。采血完毕,断头法处死大鼠。开腹采集双侧卵巢组织,分离表面脂肪与肌肉组织,称取卵巢的质量并测量卵巢的长度、宽度、厚度,计算卵巢体积(卵巢体积=0.52×卵巢长度×卵巢宽度×卵巢厚度,单位为mm3),一侧卵巢组织于4 g·mL-1多聚甲醛液中固定24 h备用,另一侧卵巢组织于-80 ℃保存,备用。
2.4 血清性激素水平测定
取出ELISA试剂盒,试剂盒放至室温后按照试剂盒说明书配制洗涤剂、显色剂、稀释剂、对照品等。按照E2、FSH、LH及AMH试剂盒说明书操作,取出试剂盒中的96孔板,每孔加入工作稀释剂50 μL,将不同质量浓度的对照品稀释液50 μL加入各微孔中,孵育120 min,用400 μL洗涤剂清洗微孔。将酶标测试抗体100 μL加入各微孔中,室温覆膜孵育120 min,用400 μL洗涤剂清洗微孔。加入显色剂100 μL,室温避光孵育30 min。将终止液100 μL加入各微孔中,终止反应。用酶标仪在412 nm波长处测量各孔的吸光度(A)值。以对照品质量浓度和A值建立标准曲线,根据标准曲线计算样本的质量浓度。
2.5 血清氧化应激因子水平测定
将ELISA试剂盒平衡温度至室温后开始检测,按照试剂盒说明书操作,用96孔板合理规划空白组、样品组、标准组,先于各微孔中加入基液20 μL,于各测定组微孔中加入待测样品5 μL,对照品微孔中加入不同质量浓度对照品稀释液5 μL,用移液枪反复吹打混匀,37 ℃恒温孵育30 min,洗涤剂清洗微孔。再将显色液20 μL加入各微孔中,37 ℃恒温水浴箱孵育20 min,用洗涤剂清洗微孔。将终止液50 μL加入各微孔中,待反应完全后用酶标仪在510 nm处测定A值,根据对照品质量浓度及其A值导出标准曲线,结合待测样品A值结果计算样品的质量浓度并做好记录。
2.6 HE染色观察
取出已固定的卵巢组织,用梯度体积分数乙醇溶液脱水,二甲苯∶乙醇(1∶1)透明60 min,透明后浸入石蜡中,再把组织放入装有石蜡的包埋盒中,于冷却台上进行冷却,待石蜡完全凝固,用切片机切成厚5 μm的薄片,贴于处理后的载玻片上,置于37 ℃恒温箱中过夜,将切片再次用二甲苯、梯度体积分数乙醇溶液进行脱蜡复水。滴加苏木精染色液浸染3 min,流水冲洗4 min去除多余染剂,吸取伊红乙醇溶液复染30 s,流水冲洗4 min,脱水透明,吸取中性树胶滴于组织处,平整按压盖玻片以避免气泡产生,封存固定,最后将切片置于光学显微镜下,观察卵巢组织的病理变化并拍照。
2.7 Nrf2、HO-1 mRNA的表达水平
取出冷冻备用的卵巢组织,解冻后剪碎,置于EP管中,加入TRIzoL 500 μL,反应后移入研磨管内充分研磨,匀浆液裂解后在4 ℃以12 000 r·min-1高速离心10 min,吸取上清液,加入氯仿,离心后加入异丙醇,得到的沉淀即为粗纯度RNA,将质量浓度测定合格的RNA样品定容至统一质量浓度。用反转录试剂盒逆转录得到cDNA。构建PCR反应体系,Mix Ex Taq 10 μL,上、下游引物各1 μL,cDNA 1 μL,RNase free-ddH2O 7 μL。引物序列:Nrf2上游(5′-TACCGTAGGTCAGCACCAGA-3′),下游(5′-GTTTGGGAATGTGGGCAACC-3′);HO-1上游(5′-CAGATCACATGCCTTTGCCG-3′),下游(5′-TGGTTCTGCTTTGGGGTGTT-3′);β-actin上游(5′-GTGACGTTGACATCCGTAAAGA-3′),下游(5′-GCCGGACTCATCGTACTCC-3′)。循环参数:95 ℃变性反应15 s,60 ℃持续退火15 s,72 ℃ 30 s进行延伸,40个循环。分析模式为定量分析,生成扩增曲线和熔解曲线,用2-△△CT法计算目的基因相对于内参的表达量。
2.8 Western blotting检测Nrf2、HO-1蛋白的表达水平
取适量卵巢组织剪碎,用细胞裂解液提取总蛋白,在4 ℃以12 000 r·min-1离心15 min,离心半径为12 cm,取上清液用BCA法检测总蛋白质量浓度,加入3×蛋白上样缓冲液,沸水加热5 min使蛋白完全变性,冷却制成加样液。配制好预制胶,拔出梳子加至电泳槽,将Marker和待测蛋白样品100 μL加入上样孔中,恒压150 V电泳60 min即停止。于220 mA、45 min内转至浸泡好的PDVF膜,再浸入脱脂奶粉于摇床上封闭2 h,将目的蛋白一抗按1∶1 000稀释,加入稀释一抗,4 ℃过夜,TBST漂洗3次。再加入1∶2 000稀释二抗,孵育2 h,回收二抗,TBST漂洗3次。滴加ECL发光液,放入发光成像仪中显影曝光,观察条带的灰度值,并计算目的蛋白的表达量。
2.9 统计学方法
3 结果
3.1 血清性激素水平比较
与对照组比较,模型组大鼠血清E2和FSH水平降低,T和LH水平升高(P<0.05)。与模型组比较,3个给药组大鼠血清E2和FSH水平升高,T和LH水平下降(P<0.05)。与ASP低剂量组比较,ASP高剂量组和西药组大鼠血清E2和FSH水平升高,T和LH水平下降(P<0.05)。ASP高剂量组血清E2、FSH、T和LH水平与西药组比较,差异无统计学意义(P>0.05)。见表1。
3.2 血清氧化应激水平比较
与对照组比较,模型组大鼠血清MDA水平升高,GSH-Px和SOD水平降低(P<0.05)。与模型组比较,3个给药组大鼠血清MDA水平降低,GSH-Px和SOD水平升高(P<0.05)。与ASP低剂量组比较,ASP高剂量组和西药组大鼠血清MDA水平降低,GSH-Px和SOD水平升高(P<0.05);ASP高剂量组与西药组比较差异无统计学意义(P>0.05)。见表2。
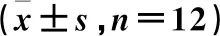
表2 各组大鼠氧化应激因子水平的比较
3.3 卵巢质量与体积比较
与对照组比较,模型组大鼠卵巢质量和卵巢体积增大(P<0.05)。与模型组比较,3个给药组大鼠卵巢质量和卵巢体积减小(P<0.05)。与ASP低剂量组比较,ASP高剂量组和西药组大鼠的卵巢质量和卵巢体积减小(P<0.05),2组比较差异无统计学意义(P>0.05)。见表3。
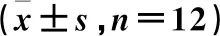
表3 各组大鼠卵巢质量与体积的比较
3.4 卵巢组织染色比较
对照组大鼠卵巢组织结构完整,各级卵泡和黄体清晰可见,发育形态正常;可见多层颗粒细胞排列紧密,无水肿和炎性细胞浸润现象。模型组大鼠卵巢组织囊泡明显扩张,各级卵泡和黄体数量减少,发育形态异常;颗粒细胞层数明显减少且排列松散、紊乱,存在大量炎性细胞浸润现象。与模型组比较,3个给药组大鼠卵巢组织囊性扩张现象明显改善,可见各级卵泡和黄体,颗粒细胞层数增加且排列紧密,炎性细胞浸润现象明显减少。见图1。

注: A.对照组;B.模型组;C.ASP低剂量组;D.ASP高剂量组;E.西药组。
3.5 Nrf2、HO-1 mRNA水平比较
与对照组比较,模型组卵巢组织Nrf2和HO-1 mRNA的表达水平下降(P<0.05)。与模型组比较,3个给药组卵巢组织Nrf2和HO-1 mRNA的表达水平升高(P<0.05)。与ASP低剂量组比较,ASP高剂量组和西药组大鼠卵巢组织Nrf2和HO-1 mRNA的表达水平升高(P<0.05),ASP高剂量组与西药组比较差异无统计学意义(P>0.05)。见表4。
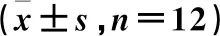
表4 各组大鼠卵巢组织Nrf2、HO-1 mRNA水平的比较
3.6 Nrf2、HO-1蛋白水平比较
与对照组比较,模型组卵巢组织Nrf2和HO-1蛋白的表达水平下降(P<0.05);与模型组比较,3个给药组卵巢组织Nrf2和HO-1蛋白的表达水平升高(P<0.05);与ASP低剂量组比较,ASP高剂量组和西药组大鼠卵巢组织Nrf2和HO-1蛋白表达水平升高(P<0.05),后两组比较差异无统计学意义(P>0.05)。见表5、图2。

注:A.对照组;B.模型组;C.ASP低剂量组;D.ASP高剂量组;E.西药组。
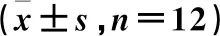
表5 各组大鼠卵巢组织Nrf2、HO-1蛋白水平的比较
4 讨论
PCOS患者机体对胰岛素的敏感性低,使胰岛素促进葡萄糖摄取和利用的作用无法发挥,机体代偿性分泌过多胰岛素,以致垂体胰岛素受体释放过多LH,促进T分泌,引起性激素水平紊乱[10-11]。治疗时首选激素药物,提高患者排卵后孕激素水平、改善黄体功能,但对卵巢功能修复效果不佳[12]。PCOS患者存在生殖障碍,不易受孕,虽然可通过促进排卵和调节激素水平增加受孕机会,但是卵巢功能差、囊性扩张仍会使患者流产风险远高于正常孕妇[13-14]。ASP是从当归干燥根中提取的水溶性成分,能通过质量浓度依赖方式改善氧化损伤[15-16]。本研究用来曲唑灌胃建立PCOS大鼠模型,从分子机制上探讨ASP对PCOS大鼠氧化应激反应和卵巢功能的修复作用。结果显示,模型组大鼠血清E2、FSH、GSH-Px和SOD的水平降低,T、LH和MDA的水平升高,表明模型组大鼠PCOS模型建立成功,出现明显性激素紊乱、代谢受到影响且处于氧化应激状态。给予不同剂量ASP和西药的大鼠血清E2、FSH、GSH-Px和SOD水平均升高,T、LH和MDA水平降低,表明ASP可以改善PCOS大鼠性激素水平,降低体内氧化应激反应。另外,ASP各剂量组和西药组大鼠卵巢组织HE染色结果也表明,大鼠卵巢囊样扩张现象得到改善,间质水肿和炎性细胞浸润现象减少。
HO-1是细胞Ⅱ期酶家族成员之一,在维持细胞氧化还原稳态、对抗由过氧化产生的活性氧自由基中发挥着重要作用[17-18]。Nrf2可调节Ⅱ期酶上游活性转录因子,正常情况下,Nrf2与ECH-1蛋白稳固结合而失去活性,受到机体氧化应激刺激时,Nrf2与ECH-1蛋白分离并通过调控HO-1提高机体内抗氧化酶活性,减轻机体氧化损伤,因此,Nrf2/HO-1信号通路是调控氧化应激损伤的重要通路[19-20]。在本研究中,与模型组比较,ASP各剂量组和西药组大鼠卵巢组织Nrf2和HO-1 mRNA蛋白的表达水平升高,卵巢质量和卵巢体积均减小,结合氧化因子水平变化,表明ASP可以有效减轻氧化应激反应,可能与激活Nrf2/HO-1信号通路有关。
综上所述,ASP能够调整PCOS大鼠血清氧化因子水平,减轻氧化应激反应,改善卵巢囊样扩张,可能是通过激活Nrf2/HO-1信号通路发挥作用的,可为临床治疗PCOS提供实验依据。
