比伐芦定及其制剂生物活性的测定
2023-07-27张睿懿
穆 娇,李 勇,张睿懿,张 伟*
1.昆明医科大学药学院暨云南省天然药物药理重点实验室,昆明 650500;2.昆明龙津药业股份有限公司,昆明 650503
冠心病是临床常见的循环系统疾病,其发病率呈逐年上升的趋势。目前,经皮冠状动脉介入术(percutaneous coronary intervention, PCI)可有效改善患者的临床症状,有利于患者预后,是治疗冠心病的主要方法之一[1-3],但是当接受PCI治疗的患者在面对抗凝药的出血风险时需要权衡利弊,所以抗凝药的选择至关重要[4-7]。肝素是心血管手术的首选抗凝剂,但部分患者可能存在肝素诱导性血小板减少症(heparin-induced thrombocytopenia, HIT)和肝素抗体阳性等情况[8-9]。
比伐芦定(bivalirudin,CAS号为128270-60-0,相对分子质量为2 180.29,分子式为C98H138N24O33)为一种新型直接凝血酶抑制剂,是根据水蛭素蛋白序列设计、合成的20肽水蛭素衍生物,可通过抑制凝血酶来发挥抗凝作用,同时能快速与凝血酶脱离,使比伐芦定迅速失效[10-12],经静脉注射,5 min内即可达到峰质量浓度,停药后1~2 h凝血功能即可恢复正常[13-15],对凝血酶的抑制作用有可逆性、短暂性和特异性等特点[16]。比伐芦定可应用于经皮冠状动脉腔内成型术(percutaneous transluminal coronary angioplasty, PTCA)的不稳定型心绞痛、PCI、心肌梗死溶栓治疗、外周血管介入治疗(peripheral vascular interventional therapy, PPI)和心脏外科手术及肝素诱导的血小板减少症(thrombocytopeniatherapy,HIT)等[17-19]。相比普通肝素,比伐芦定不需要依赖抗凝血酶就能起到抗凝作用,不用进行血液监测,其半衰期较短,抗凝效果显著优于普通肝素,还会降低不良出血事件及心血管事件的发生率,预后更佳[20-22]。
发色底物(chromogenic substrates)为化学合成的小肽,其一端为发色基团对硝基苯胺(p-nitroaniline, PNA),游离的PNA呈黄色,在405 nm波长处产生吸收峰,一定时间内,反应产物的吸光度值与酶活性呈线性相关[23]。向待检供试品中加入过量凝血酶和比伐芦定,剩余的酶可裂解产色物质并释放PNA,游离PNA可用分光光度计或酶标仪检测,监测其在405 nm处吸光度值的变化,便可测出酶的活性,从而确定比伐芦定制剂的活性。
1 仪器与试药
1.1 仪器
EPOCH2NS型酶标仪(美国伯腾有限公司);SECURA225D-ICN型分析天平(北京赛多利斯有限公司);FE28型pH计(梅特勒-托利多科技有限公司);Research plus型移液枪(德国艾本德有限公司)。
1.2 试药
生色底物S-2238(H-D-Phe-Pip-Arg-pNa·2HCl)(规格为25 mg,批号F2000197)、凝血酶(规格为100 IU,批号F2000915),均购自HYPHEN Bio Med公司;比伐芦定对照品(质量分数>88.9%,批号C1-006/D1901F04)、比伐芦定原料药(质量分数>100.03%,批号ZM0220002),均购自成都圣诺生物制药有限公司;注射用比伐芦定(规格为250 mg,批号20210413,昆明龙津药业股份有限公司);三(羟基甲基)氨基甲烷(批号20210118)、聚乙二醇6000(批号20201215),均购自国药集团化学试剂有限公司;氯化钠(批号2009081,西陇化工股份有限公司);乙二胺四乙酸二钠盐(批号2012251,四川西陇科学有限公司);水为纯化水(自制)。
2 方法与结果
2.1 溶液的制备
2.1.1缓冲液的制备 称取6.10 g三(羟基甲基)氨基甲烷、10.20 g氯化钠、2.80 g乙二胺四乙酸二钠盐、1.0 g聚乙二醇6000,置于1 000 mL烧杯中,加纯化水800 mL使溶解,用盐酸调节pH值为8.4,用纯化水稀释至1 000 mL,混匀,即得。
2.1.2凝血酶溶液和发色底物工作溶液的制备 取1瓶含有100 IU凝血酶的冻干粉,加入纯化水1 000 μL复溶,加入缓冲液9 000 μL,混匀,即得凝血酶溶液。
取1瓶含有25 mg发色底物的冻干粉,加入纯化水9 000 μL复溶,混匀,作为发色底物储备液,取发色底物储备液460 μL,加纯化水2 540 μL,混匀,即得发色底物工作溶液。
2.1.3对照品、供试品测试系列溶液的制备 精密称定比伐芦定对照品约10 mg,加缓冲液溶解并稀释制成每1 mL中约含比伐芦定100 μg的对照品储备液。取比伐芦定原料药或制剂,加纯化水适量使之溶解并稀释制成质量浓度为100 μg·mL-1的溶液,作为供试品储备液。用上述比伐芦定对照品储备液、比伐芦定供试品储备液按表1中的步骤进行稀释得到各自的测试系列溶液。

表1 对照品、供试品测试系列溶液的稀释步骤
2.2 测试程序与测试序列
以缓冲液为空白,在预热至37 ℃±0.5 ℃的酶标仪中分别加入对照品测试系列溶液、供试品测试系列溶液,按表中程序和序列进行测试(平行测定2次)。见表2、表3。

表2 测试程序

表3 测试序列
2.3 计算方法
2.3.1凝血酶抑制率(TI)计算公式 对照品系列溶液、供试品系列溶液中被作用的凝血酶抑制率TI计算公式如下:
TIstandard=[(Ablank-Astandard)×100%]/Ablank
TIsample=[(Ablank-Asample)×100%]/Ablank
Ablank为各系列溶液对应空白吸光度值的平均值;Astandard为对照品每个质量浓度溶液吸光度值的平均值;Asample为供试品每个质量浓度溶液吸光度值的平均值。
以对照品系列溶液质量浓度、供试品系列溶液质量浓度的自然对数值为横坐标,以TI为纵坐标,分别绘制对照品、供试品的线性回归曲线。
根据对照品回归方程,计算TI为45%时的对照品质量浓度,将该质量浓度代入供试品回归方程,计算得到比伐芦定TI。
2.3.2对照品、样品回归方程的回归系数(斜率)之间差异性的显著性检验 对照品、样品2个斜率之间差异性的显著性t检验公式如下。
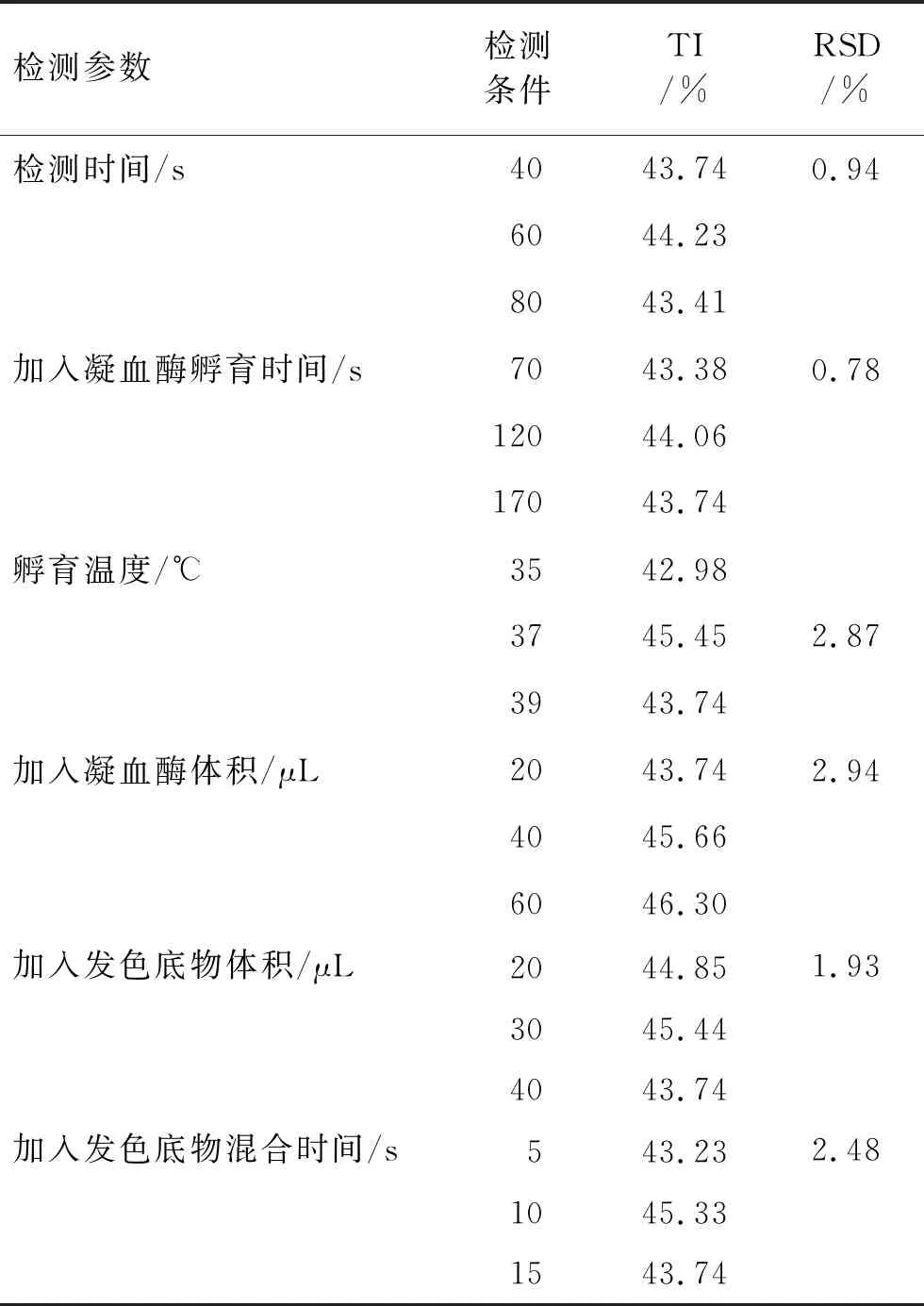
式中,x对=lnC对:对照品4个质量浓度分别取自然对数值;x1=lnC1:样品4个质量浓度分别取自然对数值;y对:对照品每个质量浓度点实测TI值;y1:样品每个质量浓度点实测TI值;N对:对照品测试系列溶液个数(4);N1:样品测试系列溶液个数(4);对照品、样品回归方程的2个斜率之间进行差异性的显著性t检验,样品回归方程相关系数大于相关系数临界值0.950(95%置信度),t 2.4.1线性与范围 取比伐芦定制剂,按照2.1.3项下方法制备对照品、供试品测试系列溶液,按照2.2项下的程序和序列分别进行吸光度值的测定。以质量浓度的自然对数值为横坐标、以TI为纵坐标,进行线性回归,计算相关系数。对照品溶液的线性方程为y1=17.228x1+24.045,相关系数为0.991 6(r>0.950),供试品溶液的线性方程为y2=16.598x2+26.412,相关系数为0.994 9(r>0.950),将对照品、样品回归方程的2个斜率进行差异性的显著性t检验,得出t=0.32,表明对照品和供试品的线性关系良好,线性显著,且TI符合要求。 2.4.2精密度 取比伐芦定制剂,按照2.1.3项下方法制备对照品、供试品测试系列溶液,按照2.2项下的程序和序列,由不同实验员在不同时间取同一批比伐芦定供试品(平行配制6份),用酶标仪测定生物活性,其生物活性的RSD值分别为1.3%、2.7%,12份供试品均值(TI)为45.49%,以上12份供试品生物活性的RSD值为2.2%。结果表明精密度良好。 2.4.3准确度 取比伐芦定制剂1瓶,按照2.1.3项下方法制备3个不同水平(50%溶液、100%溶液、150%溶液)的对照品、供试品测试系列溶液(平行配制3份),以45TI对应的对照品或供试品质量浓度(μg·mL-1)作为100%质量浓度点,将该质量浓度±50%作为50%、150%质量浓度点。按照2.2项下的程序和序列进行吸光度值的测定。结果表明,各质量浓度的回收率均在90%~110%范围内,回收率的RSD值为2.0%,结果表明准确度良好。见表4。 表4 回收率测定结果 2.4.4耐用性 取同一批比伐芦定供试品,通过调整测试条件参数(加入凝血酶孵育时间、孵育温度、凝血酶加入量、发色底物加入量、发色底物混合时间、检测时间)测定生物活性,生物活性的RSD值均小于5.0%,结果表明该方法耐用性较好。见表5。 表5 改变检测参数所测得的比伐芦定制剂生物活性 2.4.5稳定性 考察室温放置24 h对照品储备液、供试品储备液的稳定性,取在室温(25 ℃±2 ℃)量瓶中放置24 h的比伐卢定对照品储备液、供试品储备液,制备对照品系列溶液、供试品系列溶液。取新鲜配制的对照品系列溶液作为对照,测定0、24 h对照品溶液与供试品溶液的TI值,对照品、供试品24 h测定的结果与0 h比较,TI的差值绝对值为0.11%,表明对照品储备液、供试品储备液在室温放置24 h内稳定。 2.4.6专属性 制备0.01 mg·mL-1空白辅料溶液,以缓冲液作为空白溶液,按照2.2项下的程序和序列分别测定空白辅料溶液和空白溶液的吸光度值,结果显示,空白辅料溶液对空白溶液检测的干扰率为-5.3%。 比伐芦定质量浓度的自然对数与它的凝血酶抑制率(TI)呈线性关系,本方法选取系列质量浓度(1.25、2.5、5、10、20、40、60 μg·mL-1)进行测试,结果显示,对照品、供试品质量浓度在1.25~10 μg·mL-1范围内线性关系良好。 目前,在注射用比伐芦定标准号为YBH00142019和JX20160176的注册标准中,关于生物活性的测定方法是用紫外-可见分光光度法测定生物活性,因为常规的紫外-可见分光光度法酶反应动力学速率受室温影响很大,且无自身振摇功能、分子间接触面积小、反应不充分,所以重复性差。在本实验的测定过程中,用带有恒温和混合功能的酶标仪,使整个反应体系在(37 ℃±0.5 ℃)下反应,能严格模拟人体温度,并且在96孔板中反应,反应体系小、效率高、节省时间,克服了现有方法中供试品前处理复杂的缺点,弥补了用紫外分光光度法检测导致的检测结果准确度和重复性差的不足。 本研究用一种简便、快速、高效的方法进行比伐芦定及其制剂生物活性的测定,既完善了该药的质量控制标准,也能更有效地控制比伐芦定及其制剂的质量。 在开始测试前,需进行预热,并进行空板反应,以增加反应体系中的生色底物和酶分子的接触,使反应更加完全,更容易得到线性反应曲线。 由于凝血酶与生色底物的反应没有终止剂,为得到更好的曲线,整个操作过程需更快、更准,以免人为操作影响实验结果。另外,由于进板、出板时室温会影响体系的反应程度,故需要打开空调以控制室温,同时,操作者也需操作技术熟练、加样准确。 所制备的凝血酶溶液、发色底物工作溶液、缓冲液均需置于2 ℃~8 ℃保存,在室温(25 ℃±2 ℃)下放置30 min后使用。2.4 生物活性测定方法的建立

3 讨论
3.1 对照品、供试品测试系列溶液质量浓度的选择
3.2 用酶标仪测定比伐芦定及其制剂生物活性的优点
3.3 实验条件的控制
