菜薹抽薹时间、开花时间QTL定位及候选基因分析
2023-07-27李桂花符梅罗文龙骆善伟郭巨先
李桂花,符梅,罗文龙,骆善伟,郭巨先
(广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室,广州 510640)
0 引言
菜心(Brassica rapassp.parachinensis)是起源于中国华南地区的特色叶菜,仅广东省年种植面积就有20万hm2(包括复种),紫菜薹(Brassica rapassp.chinensisvar.purpurea)是起源于中国长江流域的叶菜,具有悠久的栽培历史和优良品质及独特的形态特征[1]。菜心和紫菜薹均为十字花科芸薹属小白菜变种AA染色体组(2n=20),菜薹为其食用的主要部分[2]。两者在中国很受欢迎,并销往亚洲、欧洲和美洲等国家。在菜薹的整个生长发育过程中,抽薹时间和开花时间影响着熟性早晚从而影响产量和品质。因此开展抽薹时间、开花时间性状的QTL 定位及候选基因分析具有十分重要的意义。抽薹时间和开花时间是由多个基因控制的数量性状,与其相关的研究领域涉及的是BrFLC。Tadege 等[3]首先从甘蓝型油菜中分离到了5 个序列与FLC 相似的基因,这些基因能显著延迟开花时间。之后又有Schranz 等[4]在白菜中克隆到了与FLC 同源的BrFLC1、BrFLC2、BrFLC3 和BrFLC5 等基因,分别位于A10、A02 和A03 染色体上。原玉香等[5]利用DH 群体定位到了BrFLC1。邓杰等[6]利用由小白菜构建的DH 群体定位到了BrFLC2。随着芸薹属蔬菜抽薹开花时间研究的不断深入,很多其他与开花相关的基因也被定位到。陈雪等[7]研究发现,在油菜中存在6个与开花时间同源的基因,其中有4 个定位于A07 染色体和C06染色体上。而白菜中则发现了2个与开花时间同源的基因,分别为位于A02 染色体及A07 染色体。张学铭则定位到A07 染色体上一个开花时间同源基因[8]。本试验以抽薹时间天数、开花时间天数差异大的2个材料为亲本,进行杂交获得F1,F1自交获得F2群体共150株作为作图群体,对菜心的抽薹时间、开花时间进行田间调查,利用北京百迈客生物科技有限公司简化基因组测序技术构建了包含4253 个标记的菜心分子遗传图谱[9],用混合线性复合区间作图法对菜心的抽薹时间、开花时间进行QTL 定位和候选基因分析,旨在为分子标记辅助选择不同熟性的品种提供理论依据。
1 材料与方法
1.1 试验材料
以‘湘红薹1号’与‘义农50天菜心’为双亲,构建F2群体150个单株,于2016年11月16日播种于广东省农业科学院蔬菜研究所白云基地,为减少试验中边行优势带来的误差,每畦地种2行,田间种植为随机区组设计。‘湘红薹1号’为晚抽薹开花材料,‘义农50天菜心’为早抽薹开花材料(图1),双亲间的遗传距离较大、一般配合力好,适合遗传图谱的构建及相关农艺性状的分析。

图1 作图亲本
1.2 试验方法
1.2.1 抽薹开花性状的调查每日观察并统计各植株的抽薹时间和开花时间。抽薹时间的调查标准为从播种到花蕾肉眼可见所需时间。开花时间调查标准为从播种到第一朵花完全开放所需时间。
1.2.2 叶片总DNA 提取与检测选取苗期的菜薹鲜嫩叶片,提取双亲及F2单株叶片总DNA,用1%的琼脂糖凝胶电泳检测DNA 质量,并用紫外分光光度计测其浓度。
1.2.3 分子遗传连锁图谱及构图材料将双亲及F2群体150株的DNA送至北京百迈客生物科技有限公司进行简化基因组测序(Specific-Locus Amplified Fragment Sequencing,SLAF-seq)[9],在构建菜心分子遗传图谱的基础上,用混合线性复合区间作图法对菜心的抽薹时间、开花时间进行QTL定位和候选基因分析。
2 结果与分析
2.1 菜薹高密度遗传图谱的构建
基于SLAF 文库构建和高通量测序,共获得353.57 M长度为100 bp的reads。其GC含量及Q30笔者分别为42.47%和90.21%。母本获得了10100084个reads,80935 个SLAFs,测序深度为39.4;父本获得了10181878个reads,测序深度为40.75,87833个SLAFs;在F2群体中,共获得2221944 条reads,77079 个SLAFs,平均深度为9.89(表1)[9]。对低深度SLAFs 标签进行过滤后,共获得130525 个高质量SLAFs,多态SLAFs 百分率为20.3%(26557),其中有10940 个SNP标记用于遗传图谱的构建。一共构建了10 个连锁群(图2),图谱总长1030.04 cM,共有4253个标记分布在10 个连锁群中,包含标记数最多的为LG2 连锁群,有677个标记,最少的为LG5连锁群,有235个标记;标记间的平均距离为0.27 cM,10 个连锁群长度在73.12~140.03 cM之间,其中LG5最长为140.03 cM,LG8最短为73.12 cM(表2)。图中标记的完整度为99.66%,发生双交换的比例为0.02%。
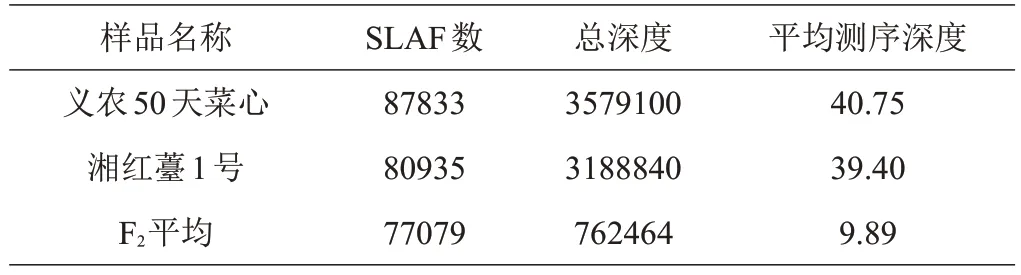
表1 SLAF测序信息统计
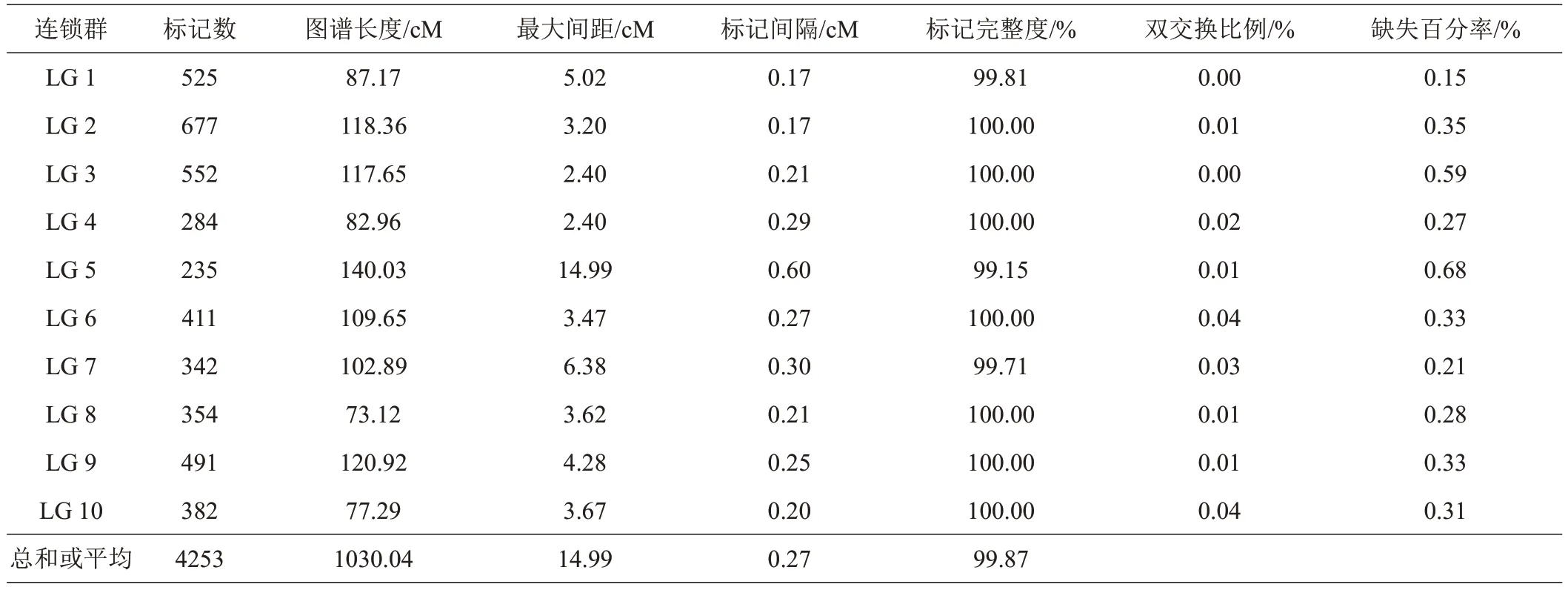
表2 各连锁群中标记数及遗传距离
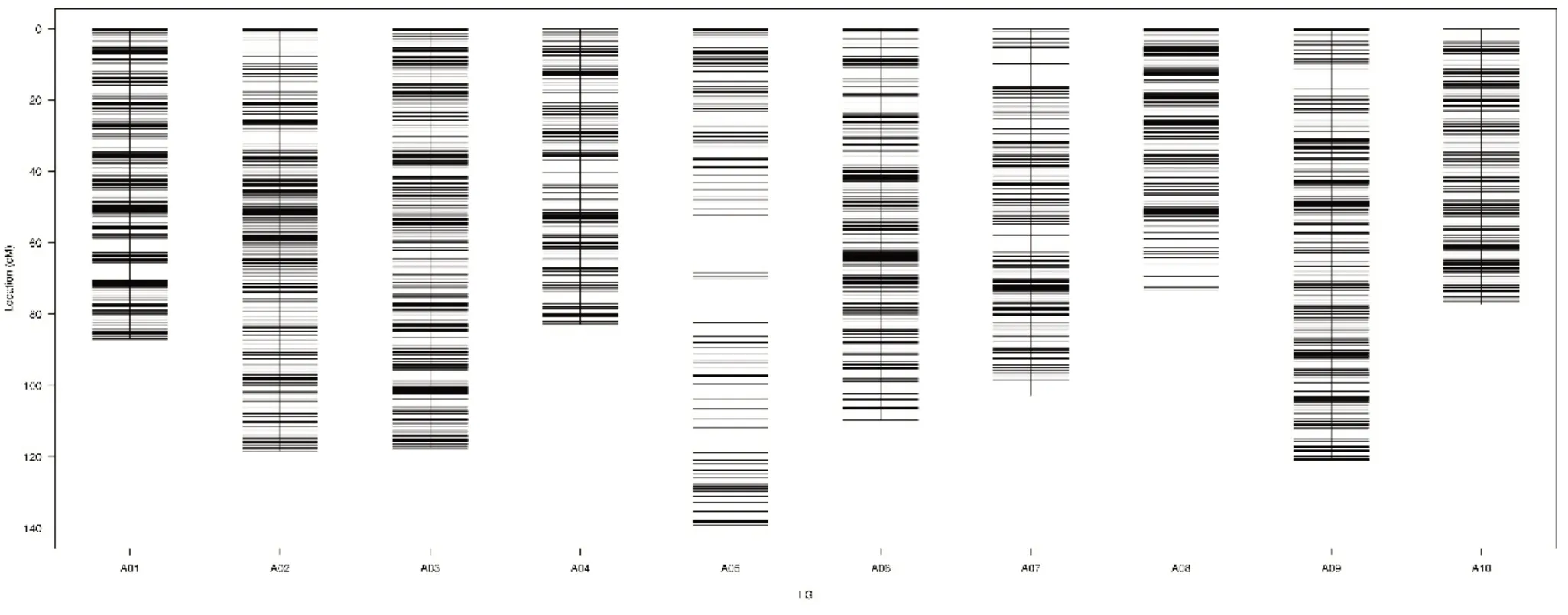
图2 菜薹高密度遗传图谱
2.2 菜薹抽薹时间、开花时间次数分布图
由表3、图3可知,双亲性状差异非常明显,其中P1的抽薹时间、开花时间天数均明显迟于亲本P2。F1抽薹时间、开花时间天数在两亲本之间。F2抽薹时间、开花时间在群体中均发生明显分离,表现为连续变化,单一峰值,属于数量性状。
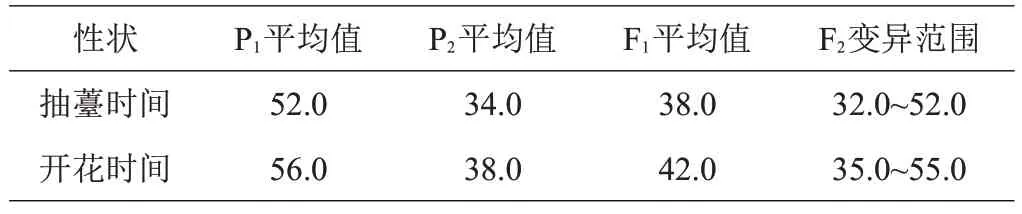
表3 亲本及F1和作图群体F2的表型d
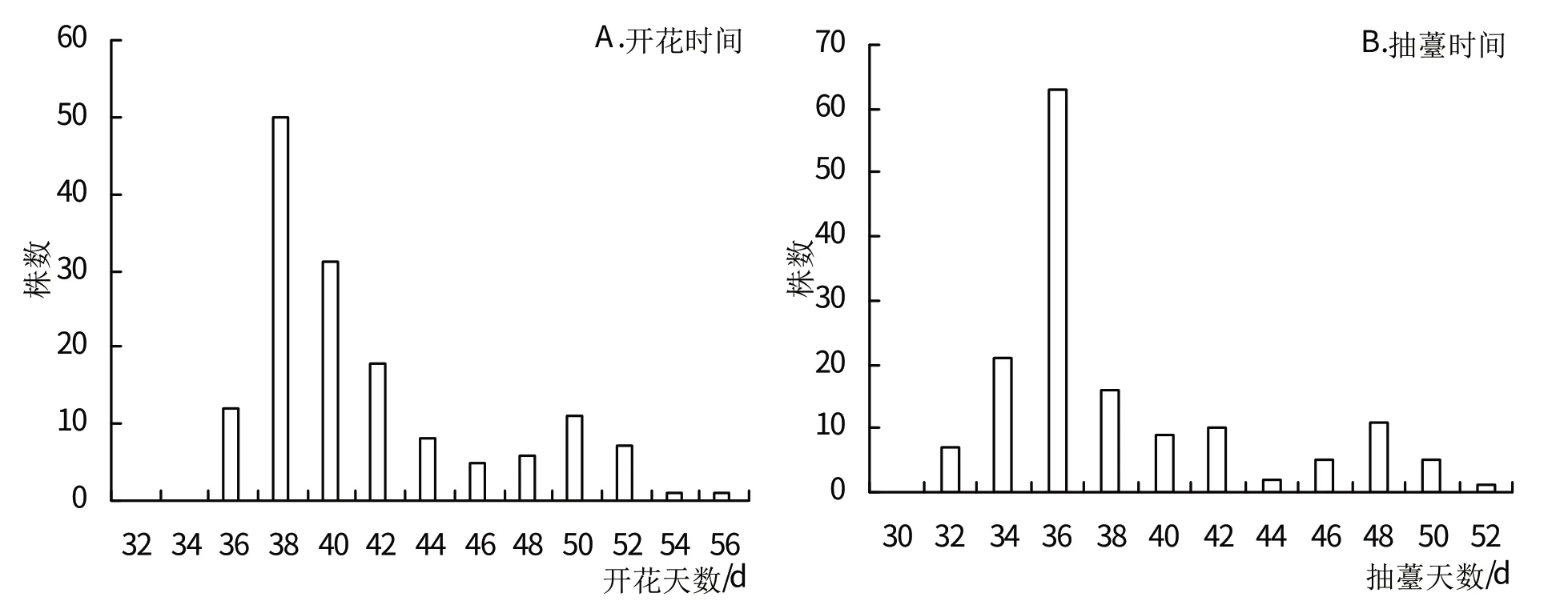
图3 F2种群抽薹时间和开花时间表型分布图
2.3 菜薹抽薹时间、开花时间性状QTL定位
通过混合线性复合区间作图法获得抽薹时间QTL 为2 个,表型贡献率在8.39%~57.55%之间;开花时间QTL 2个,表型贡献率在9.76%~56.51%之间。其中,抽薹时间主效QTL 定位于A07 号染色体上(表4、图4A),贡献率57.55%;微效QTL 则位于A09 号染色体上,贡献率8.39%(图4A)。开花时间主效QTL位于A07 号染色体上,贡献率56.51%(表4、图4B),微效QTL 则位于A09 号染色体上,贡献率9.75%(图4B)。控制抽薹时间和开花时间主效QTL 均位于A07 染色体,总间距为0.33 cM,表明抽薹时间和开花时间这2个性状是受基因的多效性或邻近基因控制的。
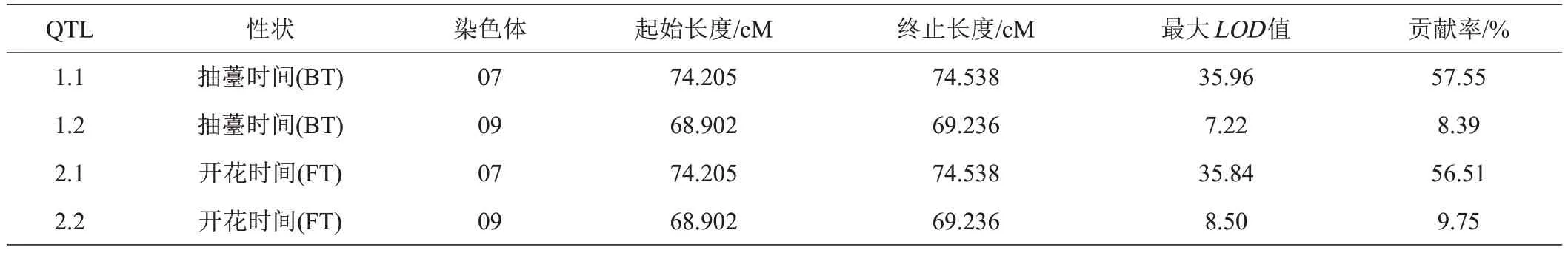
表4 菜薹抽薹时间和开花时间性状的QTL分析表
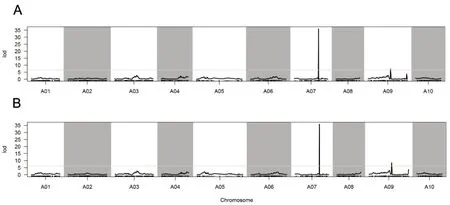
图4 菜薹A07号染色体上抽薹时间(A)和开花时间(B)性状的数量性状定位
2.4 候选基因分析
利用白菜基因组数据库,对主效QTL区域SNP标记的侧翼序列进行同源性分析[10]。利用默认参数的Blastn函数,对Ensembl植物基因组数据库中的参考基因组和已注释的白菜基因组进行序列比对,对候选基因功能进行注释。分析了位于A07 染色体抽薹时间、开花时间的主效QTL区域,以期找到参与抽薹时间与开花时间的结构基因和调控基因。将获得的数据与白菜的基因组数据库进行比对,优先确定了与抽薹时间、开花时间性状相关的12 个基因。这些候选基因在菜心抽薹、开花的过程中具有不同的调节作用。诸如Bra004159、Bra004101 和Bra004125 基因与花的分生组织的营养供给有关。而Bra004116 和Bra004125 在不同的花器官形成中发挥作用。同样,基因Bra004101 和Bra004125 也参与到植物激素的生物合成或信号传导途径中。编码转录因子的基因Bra004149 也位于主效基因QTL 区域,其中一些基因可能与早期开花性状有关。根据参考基因组,最终筛选到与抽薹时间和开花时间相关的3 个候选基因(表5、图5)。其中,Bra004125 通常被称为生长素应答因子8(ARF8),ARF8 在不同花器官的发育中起主要作用。第2 个候选基因Bra004162 是一种转录因子MYB92,主要调节植物的开花时间和次生细胞壁的形成。而第3个基因Bra004165则是编码CML24的钙结合蛋白,通过一氧化二氮(N2O)介导的途径在开花过程中起作用。

表5 在A07染色体主效QTL区域筛选到与抽薹、开花时间相关的选候选基因
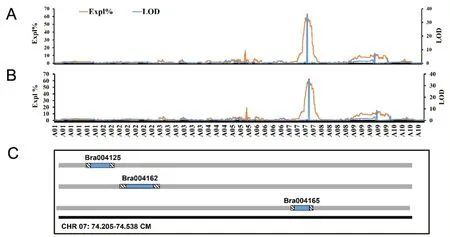
图5 菜薹抽薹时间(A)和开花时间(B)LOD值和贡献率分析
3 结论
本试验对菜薹F2分离种群的抽薹时间、开花性状进行了田间调查,利用北京百迈客生物科技有限公司构建的包含4253个标记的分子遗传图谱,通过混合线性复合区间作图法找到与抽薹时间、开花时间相关的QTL 4 个,其中2 个主效QTL 位于A07 号染色体的相邻区域。试验首次将主效QTL 区域与白菜参考基因组进行比对,筛选并推测ARF8、MYB92 和CML24 参与了菜心早期抽薹和开花性状。该结果将为下一步的基因克隆和功能分析奠定基础。
4 讨论
分子遗传图谱是研究植物数量性状QTL 定位必要条件。本研究利用抽薹时间、开花时间差异大的双亲杂交,获得F2分离群体,利用150个单株构建了一张菜薹高密度遗传图谱。与前人构建的白菜类遗传图谱相比,本图谱包含更多标记,且是利用菜薹变种内杂交进行群体构建,更有利于菜薹农艺性状的定位及候选基因分析。通过QTL 分析,鉴定筛选出4 个抽薹时间和开花时间的QTL,这些QTL定位在A09(微效基因)和A07(主效基因)染色体上(图4~5)。控制抽薹时间QTL(QTL1.1)和开花时间QTL(QTL2.1)的主效基因位于A07 染色体上相邻居位置,总间距为0.33 cM,表明抽薹时间和开花时间这2个性状是受基因的多效性或邻近基因控制的。参考注释基因组数据库对于缩小候选基因的选择范围非常重要,这些结果为基因分离和功能测试研究提供重要的参考价值。根据参考基因组和之前发表的文献以及与其他植物相同性状相关的同源基因,筛选到3 个与抽薹时间和开花时间性状相关的候选基因。其中一个通常被称为生长素应答因子8的候选基因Bra004125,控制着雄蕊和雌蕊的成熟过程[11-12]。ARF8在花器官中表达,特别是在花发育过程中的花瓣中表达[13]。该基因的功能丧失会体现在雄蕊发育改变和花丝长度减少[13-14]。ARF8 与转录因子BIGPETAL 相互作用,控制发育花瓣中的细胞分裂和扩增[14]。ARF8还会促进茉莉酸的生物合成,并导致花的成熟[11]。第2个基因Bra004162是一种转录因子,被称为MYB92。该转录因子几乎在花的所有器官中都有表达[1]。MYB92 在拟南芥中过表达促进开花,并减少了茎纤维。该转录因子的过表达进一步影响了控制拟南芥开花过程的不同基因转录水平[1]。研究结果进一步暗示了植物中的开花过程也受赤霉素控制,而MYB92可能参与赤霉素介导的开花途径。MYB92在赤霉素信号传递过程中起主要调控作用[15]。第3个候选基因Bra004165 则是编码为CML24 的钙结合蛋白[15]。CML24是潜在的钙传感器,可转换钙信号来调节一氧化二氮(N2O)的积累[16]。反过来说,N2O 水平可以通过光周期和自主调节途径影响开花的过渡期。该蛋白在拟南芥植物中的功能丧失最终表现为开花较晚,而恢复其功能则开花较早[15]。考虑到ARF8、MYB92和CML24在花器官发育中和调节诱导植物开花的某些途径的信号传导级联的重要性,Bra004125、Bra004162 和Bra004165 都是影响菜心抽薹和开花时间的重要候选基因。
