RNF187在前列腺癌细胞中的表达及其对前列腺癌细胞增殖、侵袭的影响
2023-07-27王欣文陈波李国兵肖世伟王强
王欣文?陈波?李国兵?肖世伟?王强
【摘要】目的 探討环指蛋白187(RNF187)在前列腺癌细胞中的表达及其对前列腺癌细胞增殖、侵袭的影响。方法 通过癌症基因组图谱(TCGA)和高通量基因表达(GEO)数据库分析前列腺癌组织和正常组织间RNF187的表达差异,体外培养正常前列腺上皮细胞系RWPE-1和人前列腺癌细胞系LNCaP、C4-2、DU145、PC-3,用实时荧光定量PCR(RT-qPCR)测定RWPE-1、LNCaP、C4-2、DU145、PC-3中RNF187 mRNA表达水平,蛋白免疫印迹法测定RNF187蛋白表达水平。转染RNF187-siRNA1、RNF187-siRNA2至DU145、PC-3,RT-qPCR 测定RNF187 mRNA相对表达量、CCK-8法测定细胞活性,5-乙炔基-2?脱氧尿嘧啶核苷(EdU)法测定细胞增殖能力,Transwell小室测定细胞的迁移和侵袭能力,蛋白免疫印迹法检测RNF187和上皮-间充质转化(EMT)标志蛋白及基质金属蛋白酶(MMP-9)的蛋白表达水平。结果 TCGA和GEO数据集中,前列腺癌组织中RNF187表达量均高于正常前列腺组织,Gleason评分及分期较高者的表达量较高(P均<0.05)。人前列腺癌细胞PC-3、LNCaP、C4-2、DU145中RNF187 mRNA及蛋白表达均高于正常前列腺上皮细胞RWPE-1(P均< 0.01)。RNF187-si1组、RNF187-si2组DU145、PC-3中的RNF187 mRNA相对表达量分别低于Control组的DU145和PC-3中的RNF187 mRNA相对表达量(P均< 0.001)。RNF187敲减后,DU145、PC-3细胞增殖活性及增殖、侵袭和迁移能力下降,RNF187、神经钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、MMP-9蛋白相对表达量均降低,上皮钙黏蛋白(E-cadherin)相对表达量升高(P均< 0.05)。结论 RNF187在前列腺癌组织中过表达,敲减RNF187可降低前列腺癌DU145、PC-3的细胞增殖活性及增殖、侵袭和迁移能力。
【关键词】前列腺癌;环指蛋白187;上皮间质转化;侵袭转移;泛素化
Expression level of RNF187 and its effect on the proliferation and invasion of prostate cancer cells Wang Xinwen△, Chen Bo, Li Guobing, Xiao Shiwei, Wang Qiang. △Guizhou Medical University, Guiyang 550004, China
Corresponding author, Wang Qiang, E-mail: xyfsywq@163.com
【Abstract】Objective To investigate the expression level of RING finger protein 187 (RNF187) and its effect on the proliferation and invasion of prostate cancer (PCa) cells. Methods The differences in the expression of RNF187 between PCa and normal tissues was mined through TCGA and GEO databases. Normal prostate epithelial cell line RWPE-1, and human PCa cell lines LNCaP, C4-2, DU145 and PC-3 cell lines were cultured in vitro. The expression levels of RNF187 mRNA in RWPE-1, LNCaP, C4-2, DU145 and PC-3 were determined by quantitative fluorescent real-time PCR (RT-qPCR). The expression level of RNF187 protein was determined by Western blot. DU145, PC-3 cells were transfected with RNF187-siRNA1 and RNF187-siRNA2. The relative expression level of RNF187 mRNA was determined by RT-qPCR. Cell viability was detected by CCK-8 assay. Cell proliferation was measured by 5-ethynyl-2?-deoxyuridine (EdU) labeling. Cell migration and invasion were measured by Transwell chamber. The expression levels of RNF187, epithelial-mesenchymal transition (EMT) marker proteins and matrix metalloproteinase-9 (MMP-9) were determined by Western blot. Results In TCGA and GEO datasets, the expression level of RNF187 in the PCa tissues was significantly up-regulated than that in the normal prostate tissues. Patients with higher Gleason scores and higher staging had higher expression levels of RNF187 (all P < 0.05). The expression levels of RNF187 mRNA and protein in PC-3, LNCaP, C4-2 and DU145 cells were significantly up-regulated than those in RWPE-1 cells (all P < 0.01). The relative expression levels of RNF187 mRNA in DU145 and PC-3 cells in the RNF187-si1 and RNF187-si2 groups were significantly down-regulated than those in the control group (all P < 0.001). After RNF187 knock-down, the viability, proliferation, invasion and migration capabilities of DU145 and PC-3 cells were significantly decreased, the relative expression levels of RNF187, N-cadherin, Vimentin and MMP-9 proteins were significantly down-regulated, whereas the relative expression levels of E-cadherin were significantly up-regulated (all P <
0.05). Conclusion RNF187 is over-expressed in PCa tissues. Knock-down of RNF187 can reduce the cell viability, proliferation, invasion and migration of DU145 and PC-3 cells.
【Key words】Prostate cancer; RING finger protein 187; Epithelial-mesenchymal transition; Invasion and metastasis;
Ubiquitination
前列腺癌是一种从低侵袭性到弥散性进展的泌尿系统肿瘤,在2020年的230万新增癌症病例中占7.3%,仅次于乳腺癌、肺癌和结直肠癌[1-2]。近年我国的前列腺癌发病率逐渐增加[3]。早期前列腺癌通常无明显症状,当出现血尿、骨痛等相关症状就诊时,多数已发展为中晚期疾病,癌细胞已发生远处转移,失去了根治性手术的机会,这是前列腺癌患者死亡的主要原因[4-5]。因此,针对前列腺癌侵袭转移的机制探讨如何延长前列腺患者的生存期、提高患者生活质量具有重要意义。环指蛋白187(RNF187)属于含有环结构域的E3连接酶家族,具有E3泛素连接酶活性,可促进底物泛素化。RNF187在乳腺癌、直肠癌、肝癌及脑胶质瘤中过表达,促进结直肠癌细胞的增殖、转移,与乳腺癌的易复发、转移等不良预后有关[6-7]。然而,RNF187在前列腺癌中的表达及其临床意义尚不清楚,为此本研究拟探讨其在前列腺癌中的差异表达和对前列腺癌的侵袭、转移及其与患者预后的关系。
材料与方法
一、材 料
正常前列腺上皮细胞系RWPE-1和人前列腺癌细胞系LNCaP、C4-2、DU145、PC-3购自中国科学院典型培养物保藏委员会细胞库。干扰小RNA(siRNA)-对照 (si-NC)、RNF187-siRNA1 (RNF187-si1)、RNF187-siRNA2 (RNF187-si2)购自广州锐博生物技术有限公司,Lipofectamine 2000转染试剂购自美国Gibco公司,二喹啉甲酸(BCA)蛋白定量试剂盒购武汉博士德生物工程有限公司,彩色预染蛋白分子量标准(10~170 kDa)购自美国塞默飞世尔公司,增强化学发光(ECL)试剂盒购自武汉爱博泰克生物科技有限公司,Transwell小室购自美国康宁公司,细胞计数试剂盒(CCK-8)购自江苏江莱生物技术有限公司。5-乙炔基-2'脱氧尿嘧啶核苷(EdU)试剂盒购自上海碧云天生物技术有限公司。RNF187抗兔抗体购自美国Invitrogen公司,神经钙黏蛋白(N-cadherin)抗体、波形蛋白(Vimentin)抗体、上皮钙黏蛋白(E-cadherin)抗体、基质金属蛋白酶-9(MMP-9)抗体、β-actin抗兔抗体、抗兔二抗均购自武汉三鹰生物技术有限公司。
二、方 法
1. 生物信息学分析
本研究纳入癌症基因组图谱(TCGA)数据库中492例前列腺癌患者和152例配对癌旁正常组织,通过Students t检验分析RNF187转录组水平的表达差异。通过R软件分析和预测RNF187相关的蛋白-蛋白互作网络(PPI)、细胞外RNA调控网络及转录因子调控网络。从高通量基因表达(GEO)数据库中筛选出前列腺癌患者的RNA-Seq信息进行数据分析,使用R语言的edge包筛选出差异表达的RNA-Seq,并进一步筛选与患者生存相关的RNA-Seq信息,并分析其与前列腺癌预后的相关性。
2. RNF187 mRNA在前列腺癌不同细胞系中表达水平的检测
采用实时荧光定量PCR(RT-qPCR),按照TRIzol试剂盒说明书操作步骤提取样本中总RNA,使用NanoDrop2000测定RNA的浓度,在反应体系10 μL、37 ℃ 15 min、85 ℃ 5 s、4 ℃ 50 min的反转录条件下,以提取的RNA为模板反转录生成cDNA,进行多次循环,在最后一次循环结束后于69 ℃延伸15 min。以GAPDH为内参,引物序列为:RNF187上游5'-TGGAAATCATGAGAACTTR-3′,下游5'-ACGGTCCATCACGTGTCC-3′;GAPDH上
游5'-GGCATCCTGGGCTACACTGA-3′,下游5′-
GTGGTCGTGAGGGCAATG-3′。用2-??Ct法分析目的基因的相对表达量。
3. RWPE-1、LNCaP、C4-2、PC-3、DU145細胞培养及细胞转染
RWPE-1细胞株用K-SFM培养基,PC-3、DU145细胞株用DMEM培养基,LNCaP、C4-2用含10%胎牛血清的RPMI1640培养基,于5%CO2、37℃、饱和湿度条件下培养,根据细胞状态定期更换培养基。将密度为40%的PC-3、DU145细胞传代到6孔板中,依据Lipofectamine 2000转染试剂盒操作说明制作转染物并转染DU145、PC-3细胞,将2种细胞分为si-NC组(细胞转染si-NC)、RNF187-si1组(细胞转染RNF187-si1)、RNF187-si2组(细胞转染RNF187-si2)。序列具体为:RNF187-si1 5′-TCTCGGAGCTGGAGAAGAA-3′,RNF187-si2 5′-GCACTGACCGACTACAAGA-3′。转染后各组细胞于培养箱继续培养,使用RT-qPCR验证转染效率。
4. 转染后细胞增殖活性检测
采用CCK-8法,按试剂盒说明书操作,用酶标仪测定在450 nm波长处的吸光度(即A值)并记录结果。
5. RNF187敲减对细胞增殖能力影响的验证
采用EdU法,按试剂盒说明书操作,荧光显微镜拍照、用软件Image J处理,计算增殖率。细胞增殖率(%)=EdU阳性染色细胞(红色)/总细胞(蓝色)的百分比×100%。
6. RNF187敲减对细胞侵袭与迁移能力影响的检测
采用Transwell实验,按试剂盒说明书操作,晾干后置于200倍显微镜下,随机选择5个视野观察、计数、拍照。
7. RNF187敲减对EMT标志蛋白和MMP-9表达的影响
采用蛋白免疫印迹法,按试剂盒说明书操作,ECL显影,采集图片用Image J量化分析灰度值。
三、统计学处理
采用SPSS 22. 0进行数据分析,符合正态分布的变量以表示,2组间比较行t检验,多组间比较行方差分析,两两比较行LSD-t检验;计数资料以例(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
结果
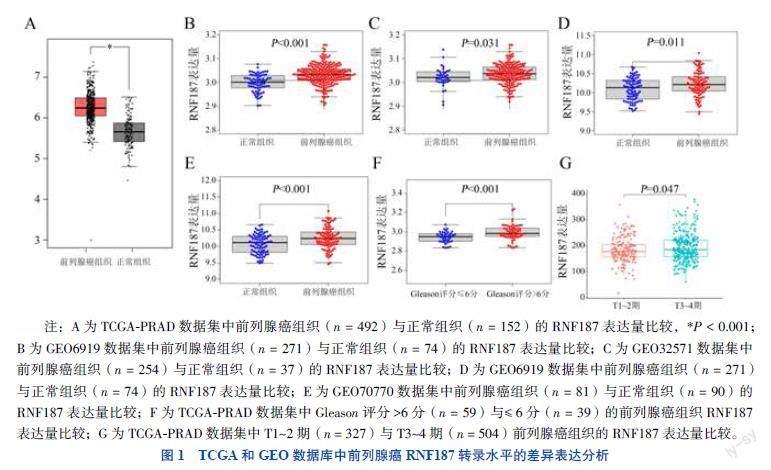
一、TCGA和GEO数据库中RNF187转录水平的差异表达分析结果
TCGA-PRAD数据集中,前列腺癌肿瘤组织中RNF187表达量高于正常组织(P < 0.001),见图1A。4个前列腺癌GEO数据集(GSE6919、GSE32571、
GSE6608、GSE70770)中,RNF187在前列腺癌组织中表达量均高于正常前列腺组织(P均 < 0.05),见图1B~E。TCGA-PRAD临床数据分析显示,Gleason评分> 6分前列腺癌组织的RNF187表达量高于
Gleason评分 ≤6分前列腺癌组织(P < 0.001);T3~4
期前列腺癌组织的RNF187表达量高于T1~2期前列腺癌组织(P < 0.05)。
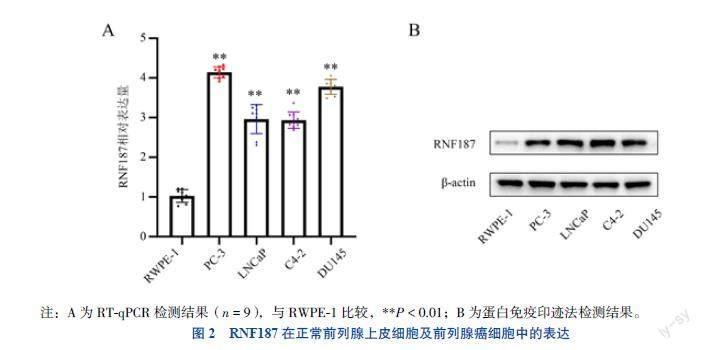
二、RNF187在正常前列腺上皮细胞及前列腺癌细胞中的表达
RT-qPCR显示,人前列腺癌细胞PC-3、LNCaP、C4-2、DU145中RNF187相对表达量均高于正常前列腺上皮细胞RWPE-1(P均 < 0.01),见图2A。进一步提取相应细胞蛋白进行蛋白免疫印迹实验,结果与RT-qPCR一致,见图2B。
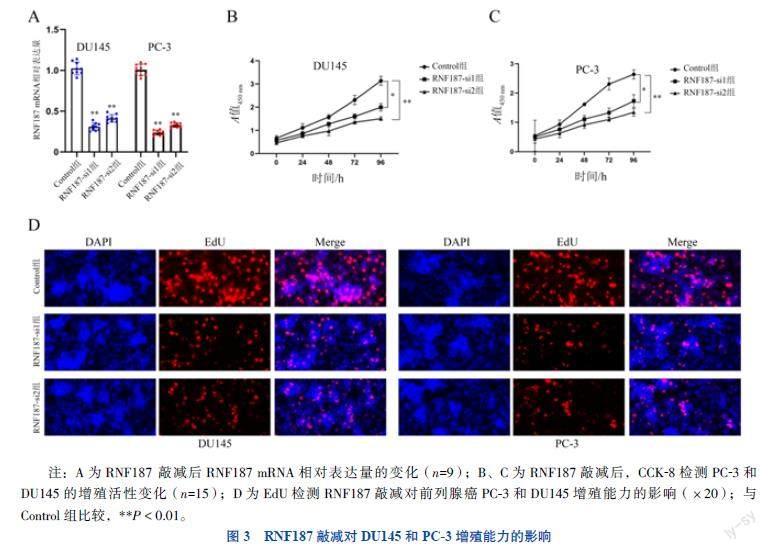
三、RNF187敲减对前列腺癌细胞DU145和PC-3增殖能力的影响
RT-qPCR显示,RNF187-si1组、RNF187-si2组DU145、PC-3中的RNF187 mRNA相对表达量分别低于Control组的DU145和PC-3中的RNF187 mRNA相对表达量(P均 < 0.001),提示转染有效,见图3A。CCK-8法检测结果显示,RNF187-si1、RNF187-si2组的PC-3和DU145與Control组比较,在96 h时细胞增殖活性均明显下降(P均 < 0.05),见图3B、C。EdU细胞增殖检测结果显示,与Control组相比,RNF187-si1组、RNF187-si2组DU145、PC-3的细胞增殖能力明显下降,见图3D。DU145和PC-3中RNF187-si1组和RNF187-si2组的EdU阳性率均低于Control组(P均 < 0.001),见表1。
四、RNF187敲减对前列腺癌细胞PC-3和DU145侵袭与迁移能力的影响
RNF187敲减后,前列腺癌细胞DU145和PC-3的侵袭与迁移能力均下降(P均 < 0.001),见表2、图4。
五、RNF187敲减对前列腺癌细胞DU145、PC-3中RNF187和EMT标志蛋白表达的影响
RNF187敲减后,DU145、PC-3中RNF187、N-cadherin、Vimentin、MMP-9蛋白相对表达量均降低,E-Cadherin蛋白相对表达量升高(P均 < 0.05),见表3、图5。
讨论
前列腺癌起病隐匿,早期没有明显症状,我国大多数前列腺癌患者在发现时已是中晚期。近年来,随着老龄化人口的增加以及新的诊断标志物如尿液外泌体circ_0040507的发现,我国前列腺癌的检出率迅速上升,前列腺癌的发病率已经趋近于膀胱癌,且早期前列腺癌占比有所增加[8-10]。早期前列腺癌并不致命,远处转移的并发症是中晚期前列腺癌患者的主要死亡原因,所以了解前列腺癌的转移和侵袭的潜在机制,有利于控制疾病的进展,降低病死率。RNF187也称为AP-1共激活因子(转录激活因子1),是一种包含环指域的泛素E3连接酶。RNF187是生长因子信号c-Jun共激活剂,对于AP-1在细胞增殖中的功能至关重要,参与了多种底物泛素化的过程[11]。RNF187在癌症中主要扮演致癌因子的角色,然而在食道鳞状细胞癌和三阴性乳腺癌中却表现出肿瘤抑制活性[12-13]。RNF187在乳腺癌、直肠癌、非小细胞肺癌、肝细胞癌及脑胶质瘤中过表达,促进结直肠癌细胞的增殖和转移[14]。赵恒奎等[15]研究发现,RNF187在脑神经胶质瘤组织中过表达,且其表达水平与脑胶质瘤的恶性程度呈正相关,RNF187参与脑胶质瘤细胞的增殖和侵袭过程,RNF187对评估脑胶质瘤患者的生存预后有一定价值。Li等[16]研究发现,RNF187在乳腺癌中呈高表达且促进了乳腺癌和移植小鼠模型中癌细胞的增殖和凋亡。p53可被RNF187诱导而降解,这一过程增加了乳腺癌细胞的侵袭和增殖能力,RNF187内源性地抑制了p53介导的抑癌信号通路[17]。EMT标志蛋白和MMP-9的表达与免疫微环境中的T淋巴细胞、肿瘤相关巨噬细胞等标志物呈正相关,改变肿瘤微环境的免疫细胞丰度可促进多种肿瘤的侵袭和转移[18-19]。
本研究中,生物信息学分析结果显示RNF187在前列腺癌组织中过表达,前列腺癌细胞系DU145、PC-3、LNCaP、C4-2中及人正常前列腺上皮细胞RWPE-1中RNF187的表达存在差异。进一步通过前列腺癌细胞DU145、PC-3研究RNF187在前列腺癌细胞中的发生及侵袭机制,CCK-8、EdU、Transwell和蛋白免疫印迹实验显示,RNF187敲减后,前列腺癌细胞的增殖、侵袭和迁移能力受到抑制,表明RNF187促进了前列腺癌的增殖、侵袭和迁移,与生物信息学分析及其他相关肿瘤研究结论一致。RNF187在未来可能成为前列腺癌治疗一个新的靶点。本研究的不足在于仅进行了基本的功能学研究,对于RNF187在前列腺癌中详细的分子机制的生物学过程还需要构建过表达细胞株和体内实验进一步验证。
参 考 文 献
[1] Gandaglia G, Leni R, Bray F, et al. Epidemiology and prevention of prostate cancer. Eur Urol Oncol, 2021, 4(6): 877-892.
[2] Moolupuri A, Camacho J, de Riese W T. Association between prostate size and the incidence of prostate cancer: a meta-analysis and review for urologists and clinicians. Int Urol Nephrol, 2021, 53(10): 1955-1961.
[3] Zhao S, Li X, Wu W, et al. Digoxin reduces the incidence of prostate cancer but increases the cancer-specific mortality: a systematic review and pooled analysis. Andrologia, 2021, 53(11): e14217.
[4] Terada N, Aizawa R, Nihei K, et al. Narrative review of local prostate and metastasis-directed radiotherapy in the treatment of metastatic prostate cancer. Jpn J Clin Oncol, 2022, 52(6): 633-641.
[5] Ali A, Hoyle A, Haran ? M, et al. Association of bone metastatic burden with survival benefit from prostate radiotherapy in patients with newly diagnosed metastatic prostate cancer. JAMA Oncol, 2021, 7(4): 555.
[6] Gao Z, Jiang J, Hou L, et al. Dysregulation of miR-144-5p/RNF187 axis contributes to the progression of colorectal cancer. J Transl Intern Med, 2022, 10(1): 65-75.
[7] Zhang L, Chen J, Yong J, et al. An essential role of RNF187 in Notch1 mediated metastasis of hepatocellular carcinoma. J Exp Clin Cancer Res, 2019, 38(1): 384.
[8] 陶文, 何涛, 何娅娣, 等. 尿液外泌体circ_0040507联合PSA对前列腺癌诊断价值的初步研究. 新医学, 2020, 51(6): 455-458.
[9] Richters A, Aben K K H, Kiemeney L A L M. The global burden of urinary bladder cancer: an update. World J Urol, 2020, 38(8): 1895-1904.
[10] Cumberbatch M G K, Jubber I, Black P C, et al. Epidemiology of bladder cancer: a systematic review and contemporary update of risk factors in 2018. Eur Urol, 2018, 74(6): 784-795.
[11] Yang P, Yao D, Aweya J J, et al. C-Jun regulates the promoter of small subunit hemocyanin gene of Litopenaeus vannamei. Fish Shellfish Immunol, 2019, 84: 639-647.
[12] Yu S, Dai J, Ma M, et al. RBCK1 promotes p53 degradation via ubiquitination in renal cell carcinoma. Cell Death Dis, 2019, 10(4): 254.
[13] Wang Z, Kong Q, Su P, et al. Regulation of Hippo signaling and triple negative breast cancer progression by an ubiquitin ligase RNF187. Oncogenesis, 2020, 9(3): 36.
[14] Fu Z, Yu W, Wang H, et al. Overexpression of RNF187 induces cell EMT and apoptosis resistance in NSCLC. J Cell Physiol, 2019, 234(8): 14161-14169.
[15] 趙恒奎, 尹亚东, 孙中磊, 等. RNF187在脑胶质瘤中的表达及其与预后生存的关系. 遵义医科大学学报, 2021, 44(5): 652-657.
[16] Li X, Niu Z, Sun C, et al. Regulation of P53 signaling in breast cancer by the E3 ubiquitin ligase RNF187. Cell Death Dis, 2022, 13(2): 149.
[17] Duffy M J, Synnott N C, Crown J. Mutant p53 in breast cancer: potential as a therapeutic target and biomarker. Breast Cancer Res Treat, 2018, 170(2): 213-219.
[18] Hilliard A, Mendonca P, Russell T D, et al. The protective effects of flavonoids in cataract formation through the activation of Nrf2 and the inhibition of MMP-9. Nutrients, 2020, 12(12): 3651.
[19] Kfoury Y, Baryawno N, Severe N, et al. Human prostate cancer bone metastases have an actionable immunosuppressive microenvironment. Cancer Cell, 2021, 39(11): 1464-1478.e8.
(收稿日期:2023-03-08)
(本文编辑:林燕薇)
