下调lncRNA DSCAM-AS1表达通过负调控miR-338-3p抑制结直肠癌细胞增殖、侵袭和迁移的机制
2023-07-26袁泉良郭跃张庆东
袁泉良 郭跃 张庆东
(南阳市中心医院肛肠科,河南 南阳 473009)
结直肠癌是常见的消化道肿瘤,发病率和病死率均居全球前三,易转移,临床治疗仍以放化疗为主,靶向治疗逐渐成为新的治疗方式〔1〕。对其分子机制的研究不仅有助于预测肿瘤进展或转移复发风险、判断预后,还利于精准化治疗。长链非编码RNA(lncRNA)属于一种基因表达网络RNA,与调节表观遗传转录和转录后水平关系密切,长度超过200 nt但不能编码蛋白质,何祖坤等〔2〕发现其在结直肠癌的发生发展中具有调控作用,在结直肠癌中表达异常,可作为预后和诊断的新型潜在生物标志物及治疗靶点。DSCAM-AS1是一种乳腺癌异性和雌激素受体α依赖性长非编码RNA,其沉默会导致乳腺癌迁移和侵袭性降低〔3〕,但其对结直肠癌细胞的影响尚未清楚。miRNAs也是一类保守非编码RNA,与结直肠癌的发生、侵袭及转移等密切相关,可通过不同的信号途径调控其靶基因进而参与结直肠癌的发生发展〔4〕。 研究发现miR-338-3p通过下调新型转化生长因子-β1型受体激酶(ALK)5抑制肾细胞癌的侵袭〔5〕;miR-338-3p抑制肝细胞癌细胞的上皮-间质转化和转移〔6〕。miR-338-3p在结直肠癌细胞中低表达,过表达可抑制肿瘤细胞侵袭转移〔7〕,还能抑制结直肠癌细胞增殖,促进细胞凋亡〔8〕。但DSCAM-AS1是否通过调控miR-338-3p影响结直肠癌的进展尚不清楚,本文旨在研究lncRNA DSCAM-AS1对结直肠癌增殖、迁移和侵袭的影响及其是否与miR-338-3p有关,为诊断治疗结直肠癌提供新靶点和新思路。
1 材料与方法
1.1材料与试剂 中国科学院上海细胞库结直肠癌细胞株SW1116、HT29、SW480和正常结直黏膜上皮细胞NCM460;RIPA蛋白裂解液和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒(上海碧云天生物技术有限公司);基质胶、Transwell小室(美国BD公司);双荧光素酶报告基因检测试剂盒(北京Solarbio公司);噻唑蓝(MTT)试剂盒、二甲基亚砜(DMSO)、二喹啉甲酸(BCA)试剂盒(Sigma公司);LipofectamineTM2000转染试剂(美国Invitrogen公司);Trizol试剂、反转录试剂盒、荧光定量试剂盒(日本TaKaRa公司);胰蛋白酶、RPMI1640培养基、胎牛血清(美国Gibico公司)。
1.2细胞培养 结直肠癌细胞株SW480、SW1116、HT29和正常结直黏膜上皮细胞NCM460采用10%胎牛血清的RPMI1640培养基培养,培养条件为饱和湿度、5% CO2、37 ℃,换液1次/d,将胰蛋白酶加入培养基消化传代,加入时机为80%左右的细胞融和度,选取实验细胞标准为处于对数生长期。
1.3细胞转染与分组 按照LipofectamineTM2000试剂盒进行转染操作。0.25%胰蛋白酶消化常规培养的结直肠癌细胞SW480后接种于96孔板中,更换为无血清培养基,更换时机为80%左右的细胞融和度,同步化12 h进行转染。转染分为miR-NC组(转染miR-NC)、miR-338-3p组(转染miR-338-3p mimics)、si-NC组(转染si-NC)、si-DSCAM-AS1组(转染si-DSCAM-AS1)、pcDNA组(转染pcDNA)、pcDNA-DSCAM-AS1组(转染pcDNA-DSCAM-AS1)、si-DSCAM1-AS1+anti-miR-NC组(共转染si-DSCAM-AS1和anti-miR-NC)、si-DSCAM-AS1+anti-miR-338-3p组(共转染anti-miR-338-3p和si-DSCAM-AS1)。
1.4qRT-聚合酶链反应(PCR)检测DSCAM-AS1 mRNA和miR-338-3p表达水平 在Trizol试剂中加入研磨充分的各组细胞并提取总RNA,RNA浓度和纯度采用微量核酸测定仪检测。将RNA反转录成cDNA,反转录使用TaKaRa试剂盒,PCR扩增以磷酸甘油醛脱氢酶(GAPDH)为内参,反应体系配制按照TaKaRa 荧光定量试剂盒使用说明,共循环40次,3次重复/样品,循环条件为95 ℃、72 ℃均30 s,60 ℃ 35 s。相对表达量计算采用2-ΔΔCt法。
1.5Western印迹检测蛋白表达 BCA试剂盒测定蛋白浓度,各组细胞加入RIPA裂解液,4 ℃离心15 min,12 377 r/min。蛋白样品SDS-PAGE后转至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭液室温封闭1 h。加入一抗(1∶1 000)4 ℃孵育过夜,TBST洗膜;室温加入二抗(1∶2 000)孵育2 h,Tris盐酸缓冲液吐温(TBST)洗涤3次,10 min/次,胶片Quantity One凝胶分析软件处理,设3个重复于每个蛋白样品。蛋白表达水平即GAPDH条带和测定的各组蛋白条带的吸光度的比值。
1.6MTT检测细胞增殖 5 g/L的MTT溶液20 μl分别加入培养至24、48、72 h的各组细胞,孵育4 h将多余培养基弃去后加入DMSO 150 μl振荡反应10 min,酶标仪检测490 nm处吸光度(OD)值。细胞活性即两组OD比值。
1.7Transwell检测细胞迁移和侵袭 浓度2×104个/ml,重悬胰酶消化后的各组细胞采用无血清培养基。细胞迁移实验:Transwell小室上室中接种细胞悬液200 μl,5% CO2、37 ℃条件下培养于含完全培养基的下室中24 h,去除培养基,取出小室,磷酸盐缓冲液(PBS)洗涤,棉签擦去上层细胞,0.1%结晶紫染色10 min,4%多聚甲醛加入后固定30 min,显微镜视野随机拍照5个,结晶紫染色细胞数即迁移细胞数。细胞侵袭实验:Transwell小室的上室铺上RPMI1640培养液1∶5比例加入并稀释的基质胶,操作同细胞迁移实验。结晶紫染色细胞数即侵袭细胞数。
1.8DSCAM-AS1对miR-338-3p的靶向调控检测 构建3′编码区(UTR)-荧光素酶表达载体,突变型和野生型基因靶点DSCAM-AS1(MUT-DSCAM-AS1和WT-DSCAM-AS1),5×104个/孔的24孔板接种对数生长期结肠癌细胞,MUT-DSCAM-AS1和WT-DSCAM-AS1组细胞采用LipofectamineTM2000分别转染miR-338-3p和miR-NC,转染时机为80%左右的细胞融和度。双荧光素酶报告实验测定使用荧光素酶报告基因检测仪,依据说明书要求。
1.9统计学方法 采用SPSS25.0软件行t检验和方差分析。
2 结 果
2.1不同细胞中miR-338-3p和DSCAM-AS1 mRNA表达 结直肠癌细胞SW480、HT29、SW1116中DSCAM-AS1 mRNA表达水平与正常结直黏膜上皮细胞NCM460相比显著升高,miR-338-3p表达水平显著降低(均P<0.05)。选择表达变化最明显的SW480细胞做后续试验。见表1。

表1 DSCAM-AS1 mRNA和miR-338-3p在不同细胞中的表达
2.2下调DSCAM-AS1 mRNA表达对结直肠癌SW480细胞增殖的影响 qRT-PCR结果显示,与si-NC组比较,si-DSCAM-AS1组SW480细胞中DSCAM-AS1 mRNA及CyclinD1蛋白表达水平明显降低,p27、p21蛋白表达水平明显升高(P<0.05)。MTT法结果显示,与si-NC组相比,si-DSCAM-AS1组24、48、72 h SW480细胞活性显著降低(P<0.05)。见表2、图1。可见,下调DSCAM-AS1表达抑制结直肠癌SW480细胞增殖。

图1 Western印迹检测两组增殖相关蛋白表达

表2 下调DSCAM-AS1 mRNA表达对结直肠癌SW480细胞增殖的影响
2.3DSCAM-AS1表达下调影响结直肠癌SW480细胞侵袭、迁移 Western印迹检测结果显示,与si-NC组相比,si-DSCAM-AS1组SW480细胞中基质金属蛋白酶(MMP)-2、MMP-9、MMP-14蛋白表达水平显著降低(P<0.05)。Transwell 法检测结果显示,与si-NC组相比,si-DSCAM-AS1组SW480细胞中迁移和侵袭数量显著降低(P<0.05)。见图2、表3、图3。
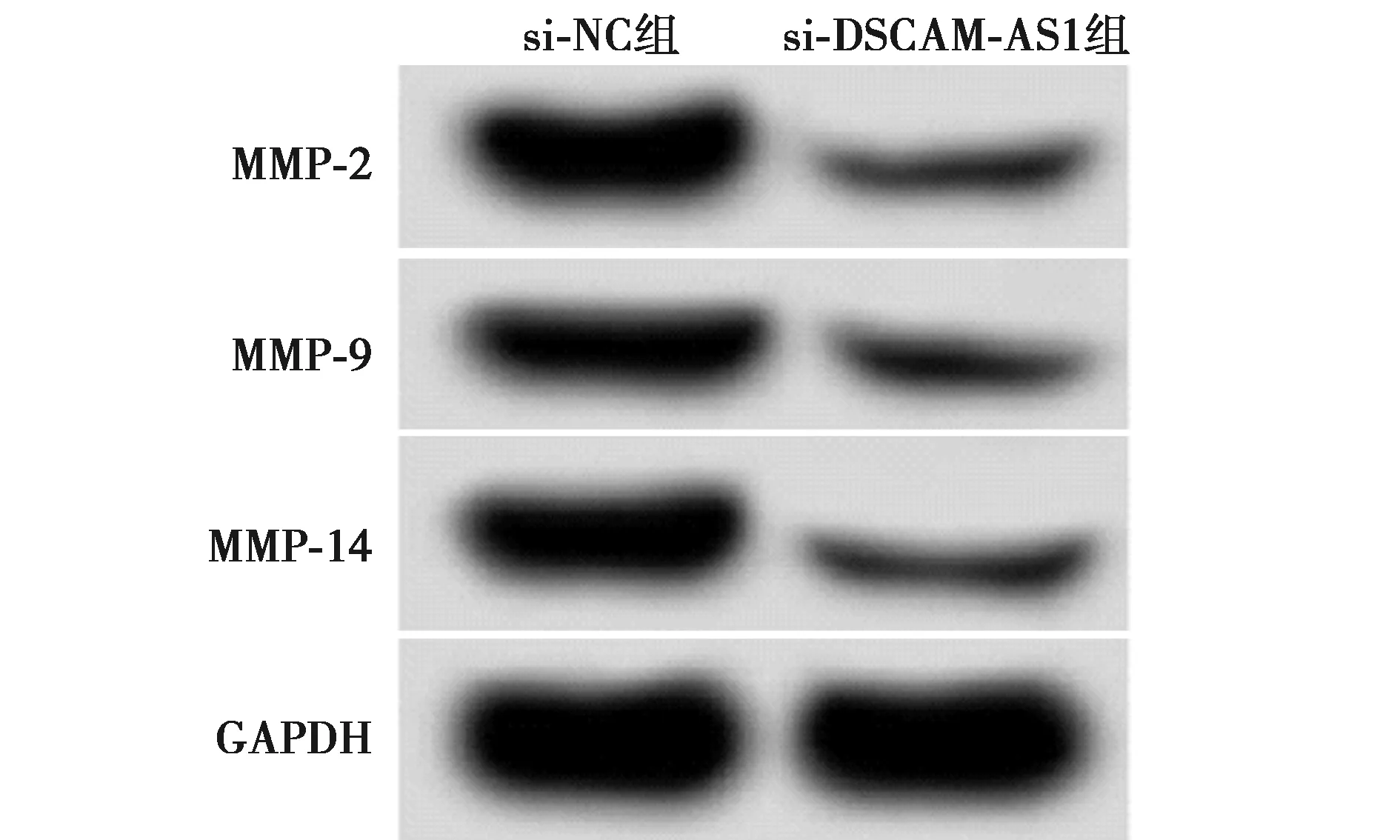
图2 Western印迹检测两组迁移、侵袭相关蛋白表达

图3 DSCAM-AS1表达下调影响结直肠癌SW480细胞迁移、侵袭(结晶紫染色,×400)

表3 各组结直肠癌SW480细胞迁移、侵袭及相关蛋白比较
2.4miR-338-3p过表达对结直肠癌SW480细胞侵袭、迁移及增殖的影响 与miR-NC组相比,miR-338-3p组SW480细胞侵袭和迁移数量和48、72 h细胞活性及CyclinD1、MMP-2、MMP-9蛋白表达水平显著降低,miR-338-3p、p21蛋白表达水平显著升高(均P<0.05)。见图4、表4。可见,结直肠癌SW480细胞侵袭、迁移和增殖受miR-338-3p过表达抑制。

1~6:miR-NC组、miR-338-3p组、si-NC组、si-DSCAM-AS1组、si-DSCAM-AS1+anti-miR-NC组、si-DSCAM-AS1+anti-miR-338-3p组图4 Western印迹检测各组相关侵袭、迁移增殖蛋白表达

表4 结直肠癌SW480细胞侵袭、迁移增殖受miR-338-3p过表达的影响
2.5lncRNA DSCAM-AS1靶向调控miR-338-3p表达 miR-338-3p与DSCAM-AS1存在结合位点通过TargetScan数据库预测,见图5。突变型DSCAM-AS1基因表达载体MUT-DSCAM-AS1被转染后,相较于miR-NC组,miR-338-3p组MUT-DSCAM-AS1结直肠癌SW480细胞的荧光素酶活性差异不显著(P>0.05)。野生型DSCAM-AS1基因表达载体WT-DSCAM-AS1转染后,相较于miR-NC组,miR-338-3p组WT-DSCAM-AS1结直肠癌SW480细胞荧光素酶活性显著降低(P<0.05),见表5。相较于pcDNA组miR-338-3p表达水平(1.02±0.09),pcDNA-DSCAM-AS1组结直肠癌SW480细胞中miR-338-3p表达水平(0.41±0.04)显著降低(P<0.05)。相较于si-NC组miR-338-3p表达水平(1.00±0.08),si-DSCAM-AS1组结直肠癌SW480细胞中miR-338-3p表达水平(2.91±0.29)显著升高(P<0.05)。可见,DSCAM-AS1可靶向调控miR-338-3p表达。

图5 DSCAM-AS1的序列中含有与miR-338-3p互补的核苷酸序列

表5 两组双荧光素酶结果比较
2.6抑制miR-338-3p表达逆转下调DSCAM-AS1表达对SW480细胞增殖迁移侵袭的影响 与si-DSCAM-AS1+anti-miR-NC组相比,si-DSCAM-AS1+anti-miR-338-3p组SW480细胞中miR-338-3p、p21蛋白表达水平显著降低,MMP-9、MMP-2、CyclinD1蛋白表达水平、细胞迁移和侵袭数量及24、48、72 h细胞活性显著升高(均P<0.05)。与si-NC组相比,si-DSCAM-AS1组SW480细胞中miR-338-3p p21蛋白表达水平显著升高,CyclinD1、MMP-2、MMP-9蛋白表达水平、细胞迁移和侵袭数量及48、72 h细胞活性显著降低(均P<0.05)。见图4、表6。下调DSCAM-AS1表达对SW480细胞侵袭、迁移、增殖抑制作用逆转的是抑制miR-338-3p表达。

表6 抑制miR-338-3p表达逆转下调DSCAM-AS1表达对SW480细胞增殖、迁移侵袭的作用
3 讨 论
结直肠癌具有很高的发病率及死亡率,严重威胁人类健康〔9〕。越来越多的研究表明lncRNAs在结直肠癌的发生发展中起重要作用,影响结直肠癌细胞的增殖、凋亡、分化、侵袭和转移等〔10〕。研究发现DSCAM-AS1参与乳腺癌的生物学进程和耐药性〔11〕;DSCAM-AS1在乳腺癌中上调表达,通过靶向miR-137增强乳腺癌中的他莫昔芬抗性〔12〕。DSCAM-AS1在吸烟者的肺腺癌组织中表达增高,且在香烟提取物处理肺腺癌A549细胞系中表达水平也升高,提示DSCAM-AS1或与吸烟和肺腺癌相关〔13〕。丰雪等〔14〕运用生物信息学分析发现DSCAM-AS1通过细胞信号传导、细胞新陈代谢、能量相关通路等与肺腺癌的发病有关,可作为肺腺癌潜在的治疗靶点。本实验结果发现,DSCAM-AS1可靶向调控miR-338-3p。研究发现miRNA在结直肠癌患者中表达异常,可靶向结合mRNA,通过沉默癌细胞生长相关基因的表达参与肿瘤进展〔15〕。此外,miRNA还能调控上皮间质转化影响结直肠癌的侵袭转移〔16〕。miR-338-3p在肝癌组织和细胞系中下调表达,通过下调FOXP4抑制肝细胞癌细胞增殖〔17〕;miR-338-3p通过靶向鞘氨醇激酶(SphK)2抑制细胞增殖并诱导非小细胞肺癌细胞凋亡〔18〕。
miR-338-3p在结直肠癌中低表达,miR-338-3p通过转录后基因沉默机制抑制结肠癌转移相关基因MACCI表达,从而抑制结直肠癌的发生〔19〕。miR-338-3p还可通过抑制精胺氧化酶(SMO)蛋白的表达从而抑制结直肠癌细胞侵袭转移〔7〕。miR-338-3p抑制剂能克服p53突变的结肠癌细胞中5-氟尿嘧啶抗性〔20〕。本实验表明,miR-338-3p被DSCAM-AS1靶向调控,抑制miR-338-3p表达部分逆转下调DSCAM-AS1对SW480细胞侵袭、迁移和增殖的抑制作用。
综上,对结直肠癌细胞的侵袭、迁移和增殖有抑制作用的机制可能与靶向调控miR-338-3p有关,结直肠癌的预后判断、治疗及诊断方面lncRNA DSCAM-AS1可提供新靶点。
