儿童支气管扩张症101例临床分析
2023-07-22陈琼华苏丽端林春燕尤玉婷庄雪娥郑敬阳
陈琼华,苏丽端,林春燕,尤玉婷,庄雪娥,郑敬阳
·论 著·
儿童支气管扩张症101例临床分析
陈琼华,苏丽端,林春燕,尤玉婷,庄雪娥,郑敬阳
福建医科大学第三临床医学院 泉州市儿童医院呼吸科,福建泉州 362000
探讨儿童支气管扩张症的临床特征,提高儿科医师对该病的认识。回顾性分析2012年1月至2022年4月泉州市儿童医院确诊的101例支气管扩张症患儿的临床表现、影像学、病原学、基因检测等资料。101例支气管扩张症患儿中,男61例,女50例,起病年龄(5.44±4.37)岁,病程(108.47±42.47)d;主要症状为湿性咳嗽(86.14%)、发热(55.45%);肺部CT显示双下叶支气管扩张最常见;39例病原体阳性,肺炎支原体感染(24.75%)最常见;53例行支气管镜检查,23例(43.40%)可见“鱼骨样改变”;15例行肺功能检查,107例为阻塞性通气功能障碍,8例限制性通气功能障碍;15例行基因检测,阳性率为46.67%。最常见的病因是感染(66.34%),其次是支气管异物(4.95%),囊性纤维化(3.96%),闭塞性支气管炎4例(3.96%),原发性纤毛运动障碍(2.97%),免疫缺陷病(2.97%),哮喘(2.97%)。经过治疗,78例(77.23%)临床改善,22例(21.78%)无明显好转,1例(1.00%)死亡。儿童支气管扩张症以湿性咳嗽为主要表现,双下肺最常受累,感染是最主要的病因,支气管异物、囊性纤维化、闭塞性支气管炎、原发性纤毛运动障碍、免疫缺陷病等病因亦不容忽视。
支气管扩张症;儿童;临床特征;病因
儿童支气管扩张症是一种慢性化脓性肺部疾病,是导致呼吸系统疾病发病和死亡的重要疾病[1]。儿童支气管扩张症不同于成人,由于患儿不会咳痰,早期症状较轻,部分直至心肺功能异常才就诊,严重影响患儿的生活质量和预后。很多儿科医师往往缺乏深层次检查,未能寻找到支气管扩张的原因[2]。而支气管扩张的病因学明确有助于患儿的管理,改善治疗的长期疗效。目前我国儿童支气管扩张症的流行病学资料较少,本研究回顾性分析近10年收治的支气管扩张症患儿的临床资料,对其临床特点、病因及治疗转归加以分析,以提高对儿童支气管扩张症的认识,达到早诊断、早治疗的目的,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2012年1月至2022年4月于泉州市儿童医院住院的101例支气管扩张症患儿的临床资料。纳入标准:①符合《儿童支气管扩张症诊断与治疗专家共识》[2]中支气管扩张症的诊断标准,肺高分辨CT表现为支气管管腔增宽超过正常管腔1.5倍,管壁增厚;支气管直径与伴行肺动脉管径比值>0.8(不存在肺动脉高压的情况下),横切面呈“印戒征”;气道由中心向外周逐渐变细的正常走行规律消失,支气管的纵切面呈“轨道征”,胸壁下1cm以内范围可见支气管影。②年龄28d至16岁。排除标准:①拒绝签署知情同意书;②不符合观察研究的特殊情况;③资料不齐全;④随访中患儿预后相关信息不清楚者。本研究获得泉州市儿童医院医学伦理委员会批准(伦理审批号:2020年伦审第7号)。
1.2 研究方法
1.2.1 临床资料收集 收集患儿的年龄、性别、既往史、临床症状体征(如发热、咳嗽、咳痰、喘息、气促、发绀、咯血、胸痛、胸闷、杵状指等),影像、肺功能、支气管镜检查结果,病原、基因检测结果,归纳及总结其临床特点,分析病因,并进行随诊。
1.2.2 支气管镜检查 在咪达唑仑静脉麻醉,利多卡因鼻腔、咽喉表面麻醉下,采用电子支气管镜,经鼻、会厌到达气管及各段、部分亚段开口,观察病变部位情况。均予生理盐水进行支气管肺泡灌洗。活检时钳夹3~5块支气管黏膜组织送病理。术中见异物时行异物取出术。
1.2.3 基因检测 取患儿及父母外周静脉血各2ml,提取基因组DNA,由北京全谱医学检验实验室进行检验,根据美国医学遗传学与基因组学会发布的变异解读指南进行致病性分析。
1.3 统计学方法
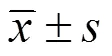
2 结果
2.1 一般资料
共有101例患儿纳入本研究,男61例,女50例,男女比例1.22∶1。年龄最小1个月,最大15岁,平均年龄(5.44±4.37)岁。病程最短1d,最长8年,平均病程(108.47±42.47)d。咳嗽87例(86.14%),发热56例(55.45%),喘息14例(13.86%),咯血3例(2.97%),胸闷2例(1.98%),胸痛2例(1.98%),杵状指2例(1.98%)。
2.2 支气管扩张症的受累部位
101例患儿高分辨CT均显示支气管扩张见图1~3,表现为“双轨征”和(或)“印戒征”,其中广泛多发支气管扩张10例(9.9%),受累部位包括:左上叶25例(24.75%),左下叶42例(41.58%),右上叶23例(22.77%),右中叶21例(20.79%),右下叶40例(39.60%)。
2.3 支气管扩张病原分布
39例患儿找到病原体,最多见的为肺炎支原体25例(24.75%),其次为沙眼衣原体6例(5.94%),流感嗜血杆菌5例(4.95%),铜绿假单胞菌4例(3.96%),腺病毒4例(3.96%)。
2.4 支气管镜下表现
53例患儿完成支气管镜检查,镜下表现为黏膜充血水肿,部分支气管黏膜表面有黏痰,甚至塑型性痰栓,23例(43.40%)表现为“鱼骨样改变”,支气管管腔塌陷,管壁增宽(图1B),1例气管软化,4例支气管闭塞(图1C),3例经支气管镜纤毛活检,发现1例纤毛超微结构异常,诊断为原发性纤毛运动障碍。5例发现支气管内异物(图3B),经支气管镜取出。

图1 闭塞性支气管炎患儿肺部CT及支气管镜表现
A.肺部CT双肺广泛支气管扩张;B.左下叶外后基底段部分亚段远端闭塞;C.支气管镜下可见支气管管腔近端呈“鱼骨样改变”
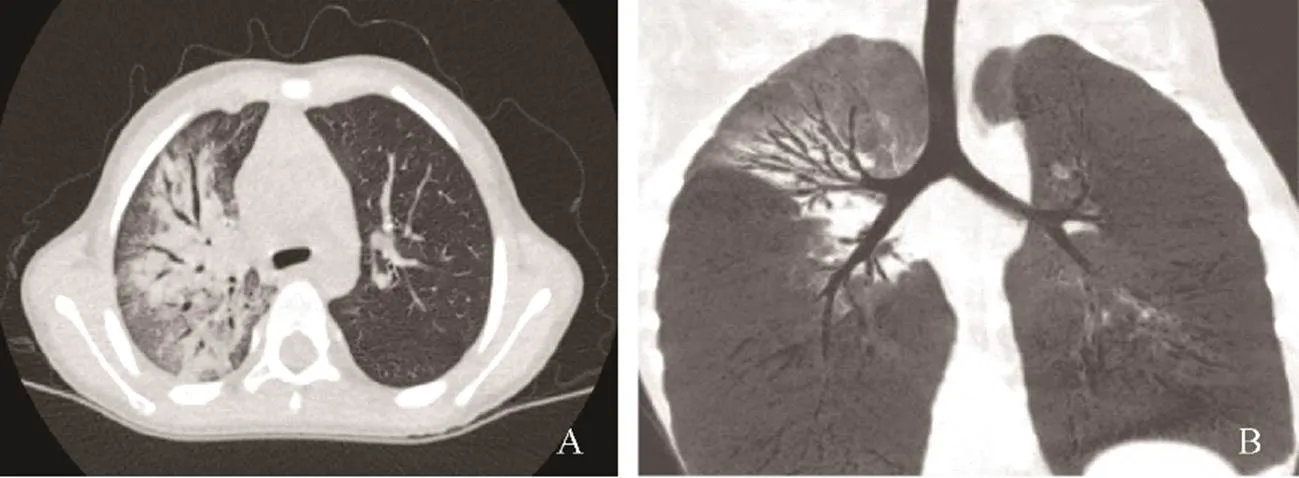
图2 肺炎支原体及腺病毒感染后患儿肺部CT表现
A.肺部CT可见右肺上叶磨玻璃状,斑片状、条索状密度增高影,周围支气管扩张;B.肺部CT重建可见右上叶支气管扩张

图3 支气管异物患儿肺部CT及支气管镜下表现
A.肺部CT可见左肺气肿,左肺下叶支气管扩张;B.支气管镜下可见左主支气管远端可见异物(花生)
2.5 肺功能检查
15例患儿完成肺功能检查,7例存在阻塞合并限制混合型通气功能障碍;10例存在阻塞性通气功能障碍,其中轻度6例,中度3例,重度1例;8例存在限制性通气功能障碍,其中轻度6例,中度1例,重度1例;4例支气管舒张试验阳性。
2.6 基因检测
15例患儿进行基因检测,阳性7例(46.67%)。通过基因检测明确4例囊性纤维化(CFTR基因变异);3例免疫缺陷,分别为X-连锁无丙种球蛋白血症(BTK基因变异),慢性肉芽肿病(CYBB基因变异)、共济失调–毛细血管扩张症(ATM基因变异)。
2.7 支气管扩张的病因
感染后支气管扩张67例(66.34%),支气管内异物5例(4.95%),闭塞性支气管炎4例(3.96%),囊性纤维化4例(3.96%),原发性纤毛运动障碍3例(2.97%),仍有2例患儿病因未明(1.98%)。
2.8 转归及随诊
所有患儿均给予呼吸支持、抗感染、祛痰等处理,7例行机械通气,26例使用静脉糖皮质激素,96例使用抗生素,其中48例(47.52%)使用阿奇霉素,33例(32.67%)选用头孢哌酮舒巴坦,26例(25.74%)选用头孢曲松。78例(77.23%)患儿临床症状改善,22例(21.78%)患儿临床症状无明显好转,1例患儿死亡(百草枯中毒)。45例患儿复查肺部CT,27例患儿治疗后7d至7个月复查,支气管扩张征改善。18例患儿治疗后7d至18个月复查,支气管扩张无改善。
3 讨论
目前全球儿童支气管扩张症的流行病学研究相当有限,各国儿童统计数据也不一[3]。随着对疾病认识的深入、诊断标准的改进、肺部CT的广泛应用,国内儿童支气管扩张症的诊断逐步增加[4]。本文总结笔者所在医院近10年的病例,发现近年来支气管扩张症的诊断也明显增多。研究显示,尽管患儿出现症状的中位年龄为6个月,但诊断中位年龄为7岁,在发达国家,晚期转诊至专科医生或误诊也是诊断延迟的常见原因[4]。本研究诊断的平均年龄(5.44±4.37)岁,平均病程(108.47±42.47)d,考虑与近年来对支气管扩张症的检测及认识水平提高有关。
咳嗽是一种保护性反射,具有清除下呼吸道分泌物的作用,是支气管扩张常见的重要症状之一,与咳嗽超敏反应和气道高反应性有关,常为湿性咳嗽,影响患儿的生活质量[5]。一项多中心研究显示,CT提示肺叶常见受累部位依次是左下叶、右上叶和右下叶,57.3%的患者多于3个肺叶受累,19.5%肺叶全部受累[6]。本研究最多受累的也为双下叶,可能与本组病例以感染后支气管扩张症最多见有关。英国指南强调微生物学的检查主要为评估气道定植和感染[7]。尽管发展中国家的数据有限,但微生物在世界范围内的分布似乎相似[8]。有研究表明,流感嗜血杆菌、肺炎链球菌和卡他莫拉菌、支原体是主要病原体,5%~16%的患儿为寄生铜绿假单胞菌[9]。本研究中病原检出肺炎支原体最多,与国内文献报道一致,可能与肺炎支原体是社区获得性肺炎常见的病原体,以及支原体黏附能力强,影响黏膜清除功能有关[10-11]。值得注意的是,本研究中有6例沙眼衣原体肺炎引起的支气管扩张症,与沙眼衣原体肺炎影像以肺节段性实变及近胸膜下小叶性实变为主的改变有所区别。
支气管镜的评估对支气管扩张占意义重大,镜下直视可发现出血灶、肉芽肿、异物和结构异常,有助临床医师的诊断及治疗。本研究有1例通过支气管黏膜活检明确原发性纤毛运动障碍,5例通过支气管镜发现异物并取出。国外文献发现,第1秒用力呼气量下降可能与支气管扩张患儿反复肺炎风险增加有关[12]。本研究患儿肺功能改变多样,有阻塞性、限制及混合性通气功能障碍。基因检测也是支气管扩张病因鉴别的重要检查,携带致病变异患者发病原因可能是因为遗传缺陷导致支气管发育不良及机体纤毛廓清能力降低,引发连续性感染,破坏呼吸道组织上皮及肺结构,引起支气管管腔变形和扩张,最终导致支气管扩张。本研究中,15例患儿进行基因检测,阳性7例(46.67%)。
既往通常认为受损支气管为不可逆转的扩张,但现代观点认为早期儿童支气管扩张症有一定可逆性,病因诊断十分重要,病因可能会改变治疗。一项纳入989名儿童的12项研究系统评价表明,既往肺炎(17%)、原发性免疫缺陷(16%)、反复误吸(10%)和原发性纤毛运动障碍(9%)是常见的潜在病因[13]。在发达国家,免疫缺陷常见于9%~34%的支气管扩张症患者;在发展中国家,既往感染导致的支气管扩张症更常见,占17%~28%[14]。感染后、原发性免疫缺陷病、支气管异物和原发性纤毛运动障碍等为儿童支气管扩张症的主要病因,约70.8%能被识别出病因[15],严重感染导致的重症肺炎和B淋巴细胞缺陷是常见的原因[2]。
本研究感染仍是儿童支气管扩张的首要病因,占66.34%,与文献报道一致,但比率较高,考虑与笔者所在医院收治的疾病种类有关。另外,儿童因牙齿发育不全,咀嚼功能不完善,进食时易活动哭闹,更易吸入异物,也是支气管扩张的重要原因之一。囊性纤维化和原发性纤毛运动障碍均有黏液清除功能异常,影响呼吸道内黏液及病原体等有害物质的排出,促进细菌等病原体在呼吸道内定植、繁育,激发炎症反应并引起感染迁延不愈,最终导致支气管扩张症[16]。国内研究发现,囊性纤维化在我国并不少见,均有肺部受累,表现为反复肺部感染,支气管扩张(95.2%),痰检铜绿假单胞菌(66.7%)、金黄色葡萄球菌(33.7%)[17]。原发性纤毛运动障碍为慢性中耳–鼻窦–肺部疾病,国内最大样本研究总结支气管扩张症的比例为78%[18],在临床工作中需要重视此类疾病,必要时进行基因检查。闭塞性细支气管炎肺部CT表现为支气管壁增厚,马赛克灌注,空气潴留征,常伴有支气管扩张[19]。有研究指出,重度哮喘儿童队列中,异常CT较为普遍,约有1/3儿童存在支气管扩张[20]。本研究中3例哮喘患儿属于哮喘重度发作,控制欠佳。
在支气管扩张症急性期治疗中,抗菌药物的使用可避免感染对呼吸道造成的进一步损伤,有助于维持肺功能稳定。Cochrane系统综述表明长期阿奇霉素治疗可抑制细菌感染并减少炎症,降低急性加重的频率并改善生活质量[20]。本研究47.52%的患儿使用阿奇霉素。头孢哌酮舒巴坦、头孢曲松及青霉素类药物使用比例较高,考虑与检出病原相应抗菌谱有关。77.23%的患儿随访临床改善,提示大部分支气管扩张诊断明确后积极处理能使患儿获益,1例因百草枯中毒肺发生进行性不可逆损害死亡。复查肺部CT的患儿比例不高,提示今后仍需加强对支气管扩张患儿的随诊及指导。
对于反复湿性咳嗽,病程中发热的患儿应注意支气管扩张症发生的可能,除识别常见的感染因素,还可通过呼吸内镜及基因检测等手段,及时明确病因,早期干预,改善预后。
综上所述,儿童支气管扩张症有逐年上升的趋势,主要临床表现为湿性咳嗽,以双下叶受累最常见,胸部CT、支气管镜及基因检测有助于诊断。支气管扩张病因以感染为首位,病原以肺炎支原体最多见,支气管异物、囊性纤维化、闭塞性支气管炎、原发性纤毛运动障碍、免疫缺陷病、哮喘等病因也应加以重视。
[1] GOYAL V, GRIMWOOD K, MARCHANT J, et al. Pediatric bronchiectasis: No longer an orphan disease[J]. Pediatr Pulmonol, 2016, 51(5): 450–469.
[2] 中华医学会儿科学分会呼吸学组疑难少见病协作组, 国家呼吸系统疾病临床医学研究中心, 编辑委员会中华实用儿科临床杂志. 儿童支气管扩张症诊断与治疗专家共识[J]. 中华实用儿科临床杂志, 2018, 33(1): 21–27.
[3] MCCALLUM G B, BINKS M J. The epidemiology of chronic suppurative lung disease and bronchiectasis in children and adolescents[J]. Front Pediatr, 2017, 5: 27.
[4] SANTAMARIA F, MONTELLA S, PIFFERI M, et al. A descriptive study of non-cystic fibrosis bronchiectasis in a pediatric population from central and southern Italy[J]. Respiration, 2009, 77: 160–165.
[5] MCCALLION P, DE SOYZA A. Cough and bronchiectasis[J]. Pulm Pharmacol Ther, 2017, 47: 77–83.
[6] MCCALLUM G B, SINGLETON R J, REDDING G J, et al. A decade on: Follow-up findings of indigenous children with bronchiectasis[J]. Pediatr Pulmonol, 2020, 55(4): 975–985.
[7] PASTEUR M C, BILTON D, HILL A T. British thoracic society guideline for non-cf bronchiectasis[J]. Thorax, 2010, Suppl1: i1–i58.
[8] CHANG A B, BUSH A, GRIMWOOD K. Bronchiectasis in children: Diagnosis and treatment[J]. Lancet, 2018, 392(10150): 866–879.
[9] PIZZUTTO S J, HARE K M, UPHAM J W. Bronchiectasis in children: Current concepts in immunology and microbiolog[J]. Front Pediatr, 2017, 5: 123.
[10] 吐尔尼萨·阿卜杜热合曼, 曹玲. 61例儿童支气管扩张症的病因及预后分析[J]. 中国医刊, 2018, 53(9): 1022–1026.
[11] KUMAR S. Mycoplasma pneumoniae: A significant but underrated pathogen in paediatric community-Acquired lower respiratory tract infections[J]. Indian J Med Res, 2018, 147(1): 23–31.
[12] GOKDEMIR Y, HAMZAH A, ERDEM E, et al. Quality of life in children with non-cystic-fibrosis bronchiectasis[J]. Respiration, 2014, 88(1): 46–51.
[13] BROWER K S, DEL V M, ARONOFF S C. The etiologies of non-CF bronchiectasis in childhood: A systematic review of 989 subjects[J]. BMC Pediatr, 2014, 14: 4.
[14] ERALP E E, GOKDEMIR Y, ATAG E, et al. Changing clinical characteristics of non-cystic fibrosis bronchiectasis in children[J]. BMC Pulm Med, 2020, 20(1): 172.
[15] 颜密. 儿童支气管扩张症病因的研究进展[J]. 国际儿科学杂志, 2019, 46(12): 896–900.
[16] LUCAS J S, BARBATO A, COLLINS S A, et al. European respiratory society guidelines for the diagnosis of primary ciliary dyskinesia[J]. Eur Respir J, 2017, 49(1): 1601090.
[17] SHEN Y, LIU J, ZHONG L, et al. Clinical phenotypes and genotypic spectrum of cystic fibrosis in Chinese children[J]. J Pediatr, 2016, 171: 269–276.
[18] GUAN Y, YANG H, YAO X, et al. Clinical and genetic spectrum of children with primary ciliary dyskinesia in China[J]. Chest, 2021, 159(5): 1768–1781.
[19] 赵顺英, 温潇慧. 重症感染后闭塞性细支气管炎的早期识别和处理[J]. 中国小儿急救医学, 2017, 24(12): 881–882.
[20] LO D, MANIYAR A, GUPTA S, et al. High prevalence of bronchiectasis on chest CT in a selected cohort of children with severe asthma[J]. BMC Pulm Med, 2019, 19(1): 136.
[21] KELLY C, CHALMERS J D, CROSSINGHAM I, et al. Macrolide antibiotics for bronchiectasis[J]. Cochrane Database Syst Rev, 2018, 3: D12406.
Clinical analysis of 101 children with bronchiectasis
Department of Respiratory Medicine, the Third Clinical Medical College, Fujian Medical University, Quanzhou Children’s Hospital, Quanzhou 362000, Fujian, China
To explore the clinical features of bronchiectasis in children, and to improve pediatricians’ understanding of the disease.A total of 101 children diagnosed of bronchiectasis in Quanzhou Children’s Hospital from January 2012 to April 2022 were included in the study. Theclinical manifestations, imaging, etiology, gene results were reviewed.A total of 101 cases of bronchiectasis in children met the diagnostic criterion, included 61 males and 50 females. The age was (5.44±4.37) years and the time of courses was (108.47±42.47) days. Clinical manifestations included wet cough (86.14%), fever (55.45%); double lower lobe bronchiectasis was most common in CT scans of all the patients; Positive result of sputum or bronchoalveolar lauage fluid were in 39 cases, mycoplasma pneumoniae infection (24.75%) was the predominant pathogen; Bronchoscopy was performed in 53 cases, 23 cases (43.40%) showed “fishbone like changes”; 15 cases underwent pulmonary function examination pulmonary function showed obstructive ventilation dysfunction in 10 cases, and restrictive ventilation dysfunction in 8 cases; Gene testing was performed in 15 cases, with a positive rate of 46.67%. The most common cause was post infection (66.34%), followed by bronchial foreign body (4.95%), cystic fibrosis(3.96%), bronchitis obliterans (3.96%), primary ciliary dyskinesia (2.97%), immunodeficiency disease (2.97%), and asthma (2.97%). After treatment, 78 cases (77.23%) were clinically improved, 22 cases (21.78%) were not significantly improved, and 1 case (1.00%) died.Wet cough is the main clinical feature of bronchiectasis in children, lower lobes are most involved. Pulmonary infection is the main etiology of bronchiectasis. The causes of bronchial foreign body, cystic fibrosis, bronchitis obliterans, primary ciliary dyskinesia, and immunodeficiency disease cannot be ignored.
Bronchiectasis; Children; Clinical features; Etiology
R562
A
10.3969/j.issn.1673-9701.2023.18.008
泉州市科技计划项目(2020N050s)
陈琼华,电子信箱:cqionghua283@163.com
(2022–11–04)
(2023–02–20)
