ZnAl-LDH/Al(OH)3复合材料的制备及其对废水中Pb2+的去除性能
2023-07-21赵鹤翔李明昕张继国郭元茹潘清江
赵鹤翔, 李明昕, 王 艳, 张继国, 郭元茹, 潘清江
(1.东北林业大学 材料科学与工程学院 生物质材料科学与技术教育部重点实验室, 哈尔滨 150040;2.黑龙江大学 化学化工与材料学院 功能无机材料化学教育部重点实验室, 哈尔滨 150080;3.哈尔滨市疾病预防控制中心(哈尔滨市卫生检验检测中心), 哈尔滨 150056)
0 引 言
随着我国工业化的蓬勃发展,在工业产量迅速增加的同时,工业废水的排放量也持续增加,其中以水体重金属污染情况最为严峻。环境安全问题关系到一个地区乃至一个国家和民族的可持续性发展。相关调查显示,水体重金属污染的元素主要有Pb、Cd和Cu等,且重金属存在形式多样[1]。重金属被排放到水体中后,无法被水体中的微生物降解,从而对水体造成了严重的危害。重金属治理方法包括沉积法、多元复合凝絮沉降方法、硅微囊技术和吸附技术等。如采用加入中和性试剂、硫化剂或者采用电解的方法,使重金属离子生成氢氧化物或硫化物沉淀,进而达到分离的目的[2-3]。
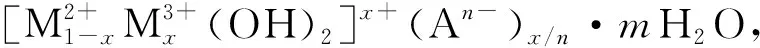
本文以共沉淀法制备了Zn/Al-LDH/Al(OH)3,利用LDH片层结构构建的大比表面积和Al(OH)3对重金属的吸附作用,协同处理废水中的Pb2+,为工业废水中重金属离子的处理提供了新的可行方法。
1 材料及方法
1.1 实验试剂
Zn(NO3)2·6H2O和Al(NO3)3·9H2O购于天津市巴斯夫化工有限公司,NaOH和Na2CO3购于天津市天力化学试剂有限公司,均为分析纯。除特殊说明外,实验用水均为去离子水。
1.2 测试与表征
产物的形貌采用日本Hitachi公司的S-4800型扫描电子显微镜(Scanning electron microscope, SEM)进行观察;样品的官能团采用美国Perkin Elmer公司的Fourier型傅里叶变换红外(Fourier transform infrared, FT-IR)光谱仪进行分析;样品的结构利用日本Rigaku公司的D/max-RC型粉末X射线衍射仪(X-ray diffractometer,XRD)来测定; X-射线光电子能谱(X-ray photoelectron spectroscopy, XPS)由美国Thermo公司的ESCALAB型XPS仪测定;Pb2+浓度利用美国Perkin Elmer公司的AAS PinAAcle 900T型原子吸收光谱仪测定;采用TriStar Ⅱ 3020型比表面仪进行N2吸附-脱附实验,测定样品的比表面积。
1.3 制备方法
取3.3 g Zn(NO3)2·6H2O和4.2 g Al(NO3)3·9H2O分别溶于20 mL去离子水中后混合, 制得A溶液。取1.8 g NaOH和1.4 g Na2CO3溶于40 mL去离子水,得到B溶液[7]。在60 ℃ 恒温水浴搅拌的条件下,向B溶液中缓慢滴加A溶液,用浓度为1 mol·L-1的NaOH溶液调节 pH,使pH维持在10~11。滴加完毕后,在60 ℃ 条件下搅拌反应1 h,超声振荡30 min,陈化24 h,陈化分为两个阶段:恒温水浴振荡陈化6 h,常温静置陈化18 h。离心,洗涤至中性,干燥,研磨得到ZAL/AH。
改变Zn(NO3)2和Al(NO3)3的投料摩尔比,当其投料摩尔比为1∶1、2∶1、3∶1和4∶1时,所制备的产物分别记为ZAL/AH-1、ZAL/AH-2、ZAL/AH-3和ZAL/AH-4。
1.4 吸附试验
称取50 mg ZAL/AH置于Pb2+离子溶液中,在25 ℃下振荡24 h,取样并测量溶液中Pb2+离子浓度,计算吸附剂对 Pb2+的吸附量:
(1)
采用准一级动力学方程和准二级动力学方程对吸附动力学过程进行拟合:
ln(Qe-Qt)=lnQe-k1t
(2)
(3)
式中:Qt为 ZAL/AH在t时刻的吸附量(mg·g-1);Qe为ZAL/AH的平衡吸附量(mg·g-1);k1为吸附的一级速率常数(min-1);k2为吸附的二级速率常数(g·mg-1·min-1)。
采用Langmuir吸附等温式和Freundlich吸附等温式对吸附过程进行拟合,其公式为:
(4)
(5)
式中:Qe为吸附量(mg·g-1);Qm为饱和吸附量(mg·g-1);b为吸附系数;Ce为与Qe相对应的平衡浓度(mg·L-1);K为吸附系数的常数;n为吸附强度的常数。
2 结果与讨论
2.1 XRD和FT-IR分析
利用XRD测试了所制备的ZAL/AH-1、 ZAL/AH-2、 ZAL/AH-3和ZAL/AH-4的晶体结构,结果如图1(a)所示。可以看出,Zn∶Al投料比不同,4种ZAL/AH材料的XRD峰不同。当Zn∶Al 投料比为1∶1时,在2θ为11.28°、23.56°和34.67°处出现Zn/Al-LDH的特征衍射峰,分别为Zn/Al-LDH的(003)、(006)和(012)晶面;在2θ为18.27°、20.26°和20.50°处的特征衍射峰为Al(OH)3,可归属于单斜晶系Al(OH)3的(002)、(110)和(200)晶面。当进一步增加Zn的含量,到Zn∶Al投料比为2∶1时,则会出现第三相,即六方晶系的Zn(OH)2[11-12]。这说明在Zn∶Al投料比例不同时,生成材料的物相组成也不同。
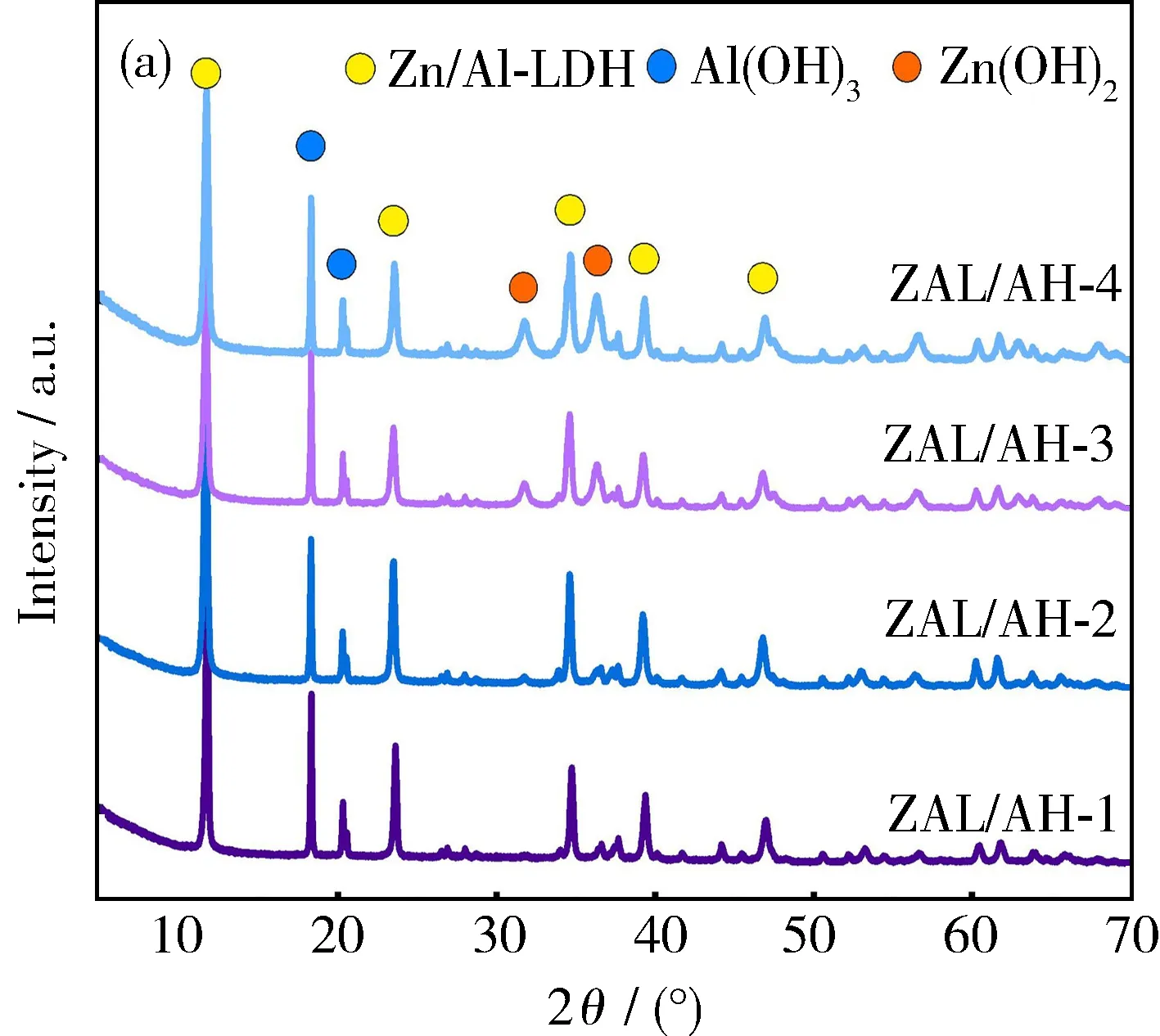
图1 ZAL/AHs的XRD图谱(a)和FT-IR光谱(b)
2.2 SEM和XPS分析
为进一步分析Zn∶Al投料比对材料形貌的影响,对所制备的ZAL/AH进行了SEM分析,结果如图2所示。可以看出,不同投料比所制备的材料均具有六边形薄片状结构,与LDH的结构特点一致。同时,Zn∶Al投料比低时,所制备的 ZAL/AH-1的片层状结构分布均匀,平均粒径约为400 nm,厚度平均约为10 nm,无明显团聚现象。当Zn∶Al投料比增加时,所制备的产物的片层变薄。这表明反应溶液中Zn2+增加时,有利于薄层ZAL/AH的制备。

图2 ZAL/AH-1 (a)、ZAL/AH-2 (b)、ZAL/AH-3 (c)和ZAL/AH-4 (d)的SEM照片

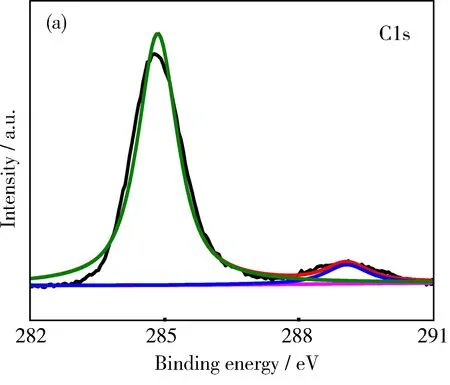
图3 ZAL/AH-1的XPS谱图
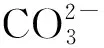
2.3 比表面积分析
吸附材料的比表面积对重金属的去除有重要影响,因此,对ZAL/AH-1材料进行了N2吸附-脱附实验,测定其比表面积,吸附-脱附等温线如图4所示。由图可知,ZAL/AH-1的N2吸附-脱附曲线与ZAL/AH-2~ZAL/AH- 4不同。ZAL/AH-1吸附等温线为Ⅱ型等温线,在低压出现拐点,表明此时达到单分子吸附饱和;在p/p0为 0.1~0.9时,吸附容量增长缓慢,表现为微孔材料的特征,因此该材料拥有较大的比表面积。随着相对压力的进一步增加,吸附量快速增加,开始发生多分子层吸附,这进一步证明所制备的复合材料具有片层结构。而ZAL/AH-2~ZAL/AH- 4在p/p0<0.9时几乎没有吸附;当p/p0>0.9时,吸附量迅速增加,表明ZAL/AH-2~ZAL/AH- 4为非孔片层材料,比表面积也比较小(在20.0 m2·g-1左右)。
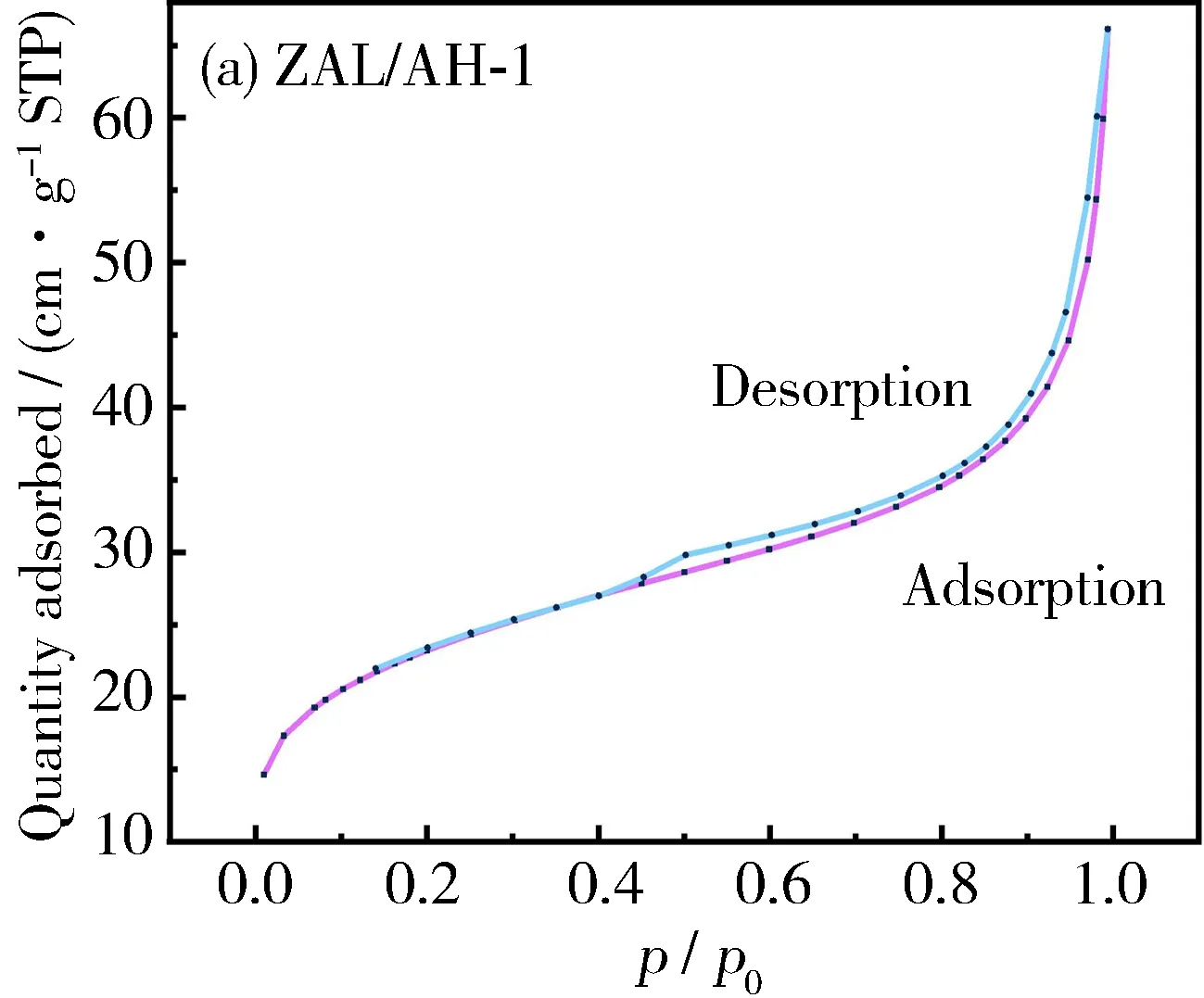
图4 ZAL/AHs的N2吸附-脱附等温线
ZAL/AH的比表面积和孔径如图5所示。由图可知,ZAL/AH-1具有大的比表面积和最小的孔径。由SEM可知,ZAL/AH-1的形貌表现为较厚的片层,一般来讲,该材料具有相对小的比表面积。但是由于ZAL/AH-1具有丰富的微孔,因此比表面积较大(82.7 m2·g-1),表现出优异的吸附性能。而ZAL/AH-2~ZAL/AH- 4虽然片层较薄,但是由于不具有孔结构,比表面积小,因此吸附容量较低。
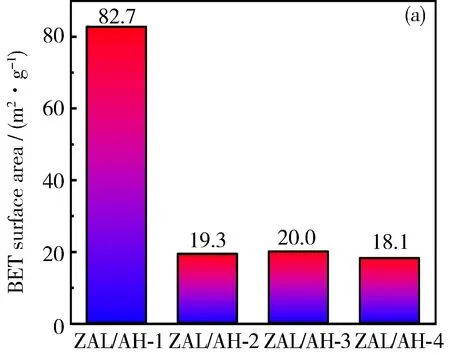
图5 ZAL/AHs的比表面积(a)和平均孔径(b)
2.4 吸附性能研究
为探究ZAL与不同条件制备的ZAL/AH的吸附性能,利用Pb2+溶液对所制备的样品进行了吸附实验,其吸附量结果如图6(a)所示。由图可知,在相同条件下,ZAL/AH-1对Pb2+表现出优异的吸附性能,吸附量达到136.0 mg·g-1,而ZAL的吸附量仅能达到75.4 mg·g-1,吸附效果远差于ZAL/AH。同时,随着Zn∶Al投料比的增加,ZAL/AH的吸附量呈现减少的趋势,如ZAL/AH-2、ZAL/AH-3、ZAL/AH-4的吸附量分别为109.8、108.0、83.5 mg·g-1,均低于ZAL/AH-1的吸附量。由前面的分析可知,Zn∶Al投料比的增加会使样品ZAL/AH出现第三相:Zn(OH)2。通过对比实验发现,Zn(OH)2对Pb2+的吸附量为33.3 mg·g-1,低于Zn/Al-LDH。这是因为Zn(OH)2只能利用表面的OH-与重金属离子结合,从而达到去除Pb2+的目的。而Al(OH)3具有较大的比表面积,可以对重金属离子有效吸附; Zn/Al-LDH通过阳离子交换实现对Pb2+的吸附,Zn/Al-LDH和Al(OH)3的协同作用, 使得复合材料具有优异的吸附性能。因此,虽然ZAL/AH-2~ZAL/AH-4的样品片层更薄,但材料整体吸附性能依然减弱。这也证明Zn(OH)2物相的出现不利于重金属离子的吸附。
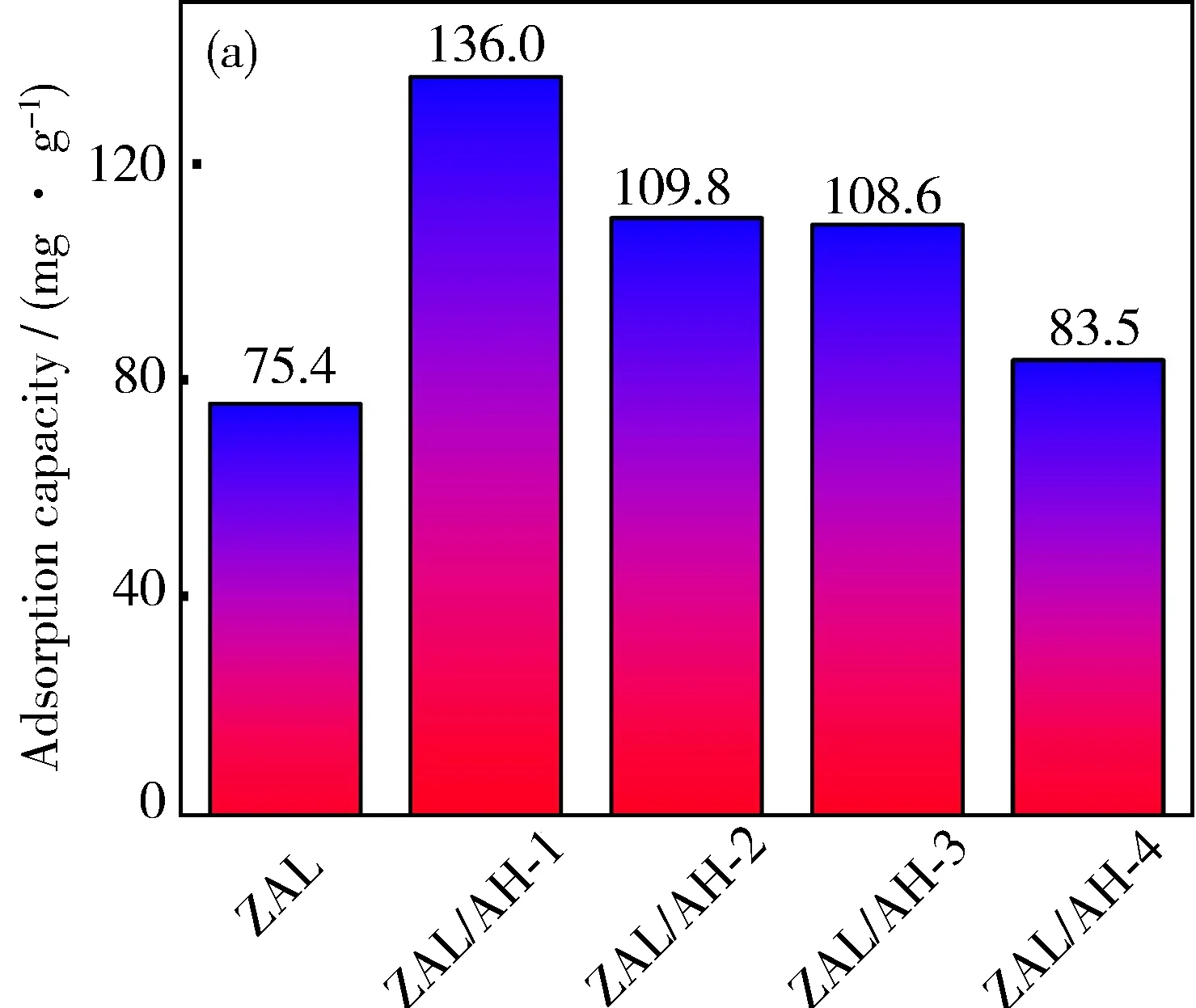
图6 ZAL和ZAL/AHs材料对Pb2+的吸附量(a)以及ZAL/AH-1对Pb2+的吸附动力学曲线(b)、 准一级动力学模型(c)和准二级动力学模型(d)
为进一步研究ZAL/AH的吸附性能,在100 mg·L-1Pb2+溶液中考察了吸附时间对ZAL/AH-1吸附性能的影响,结果如图6(b)所示。由图可知,在吸附的初始阶段,吸附反应速率较快。这是由于在吸附刚开始时,吸附剂的表面有大量的空白吸附位点;随着时间增加,ZAL/AH-1吸附剂表面的大量吸附位点被占据,可供Pb2+附着的位点减少,导致吸附速率下降,吸附去除率逐渐趋向平衡。24 h后,ZAL/AH-1对铅的吸附效率达到95%。
采用准一级和准二级动力学方程对ZAL/AH-1的吸附过程进行拟合,结果分别如图6(c)和图6(d)所示。ZAL /AH-1对Pb2+的吸附动力学很好地符合准二级动力学方程,Qe值与实验值相近,拟合相关系数R2为0.996,也说明在该吸附过程中,化学吸附起着决定反应速率的关键作用[9]。表1列出了拟合动力学方程的各个参数值,其中ZAL/AH-1的准二级吸附动力学速率常数k2为0.006 9 g·mg-1·min-1。

表1 ZAL/AH-1吸附动力学的拟合参数
由于溶液初始离子浓度对ZAL/AH-1的吸附性能有一定的影响,因此选用初始浓度为50、100、200、250、300、400、500 mg·L-1的Pb2+溶液进行吸附实验,结果如图7(a)所示。由图可知,ZAL/AH-1对Pb2+的吸附量随着初始溶液浓度的增加而增大,初始阶段的吸附量迅速上升,随着溶液浓度增加,增加趋势逐渐变得平缓,大约在500 mg·L-1时,吸附量达到117.0 mg·g-1,当溶液浓度为1 000 mg·L-1时,其吸附量达到136.0 mg·g-1。
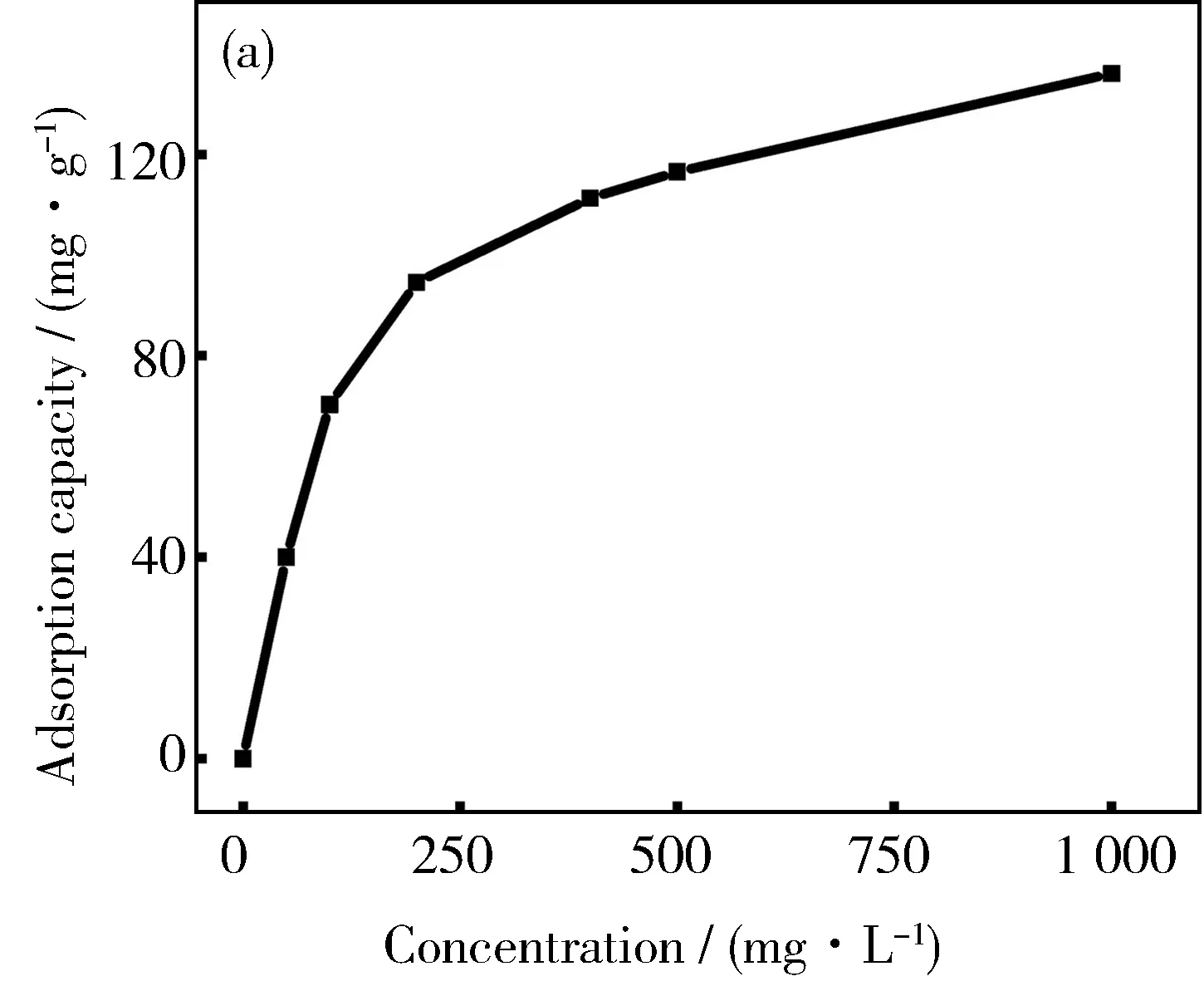
图7 ZAL/AH-1对Pb2+吸附等温线(a)、Langmuir吸附模型拟合曲线(b)和Freundlich吸附模型拟合曲线(c)
对吸附等温线进行Langmuir和Freundlich吸附模型拟合,拟合参数如表2所示。由表2可知,其Langmuir吸附等温线拟合的相关系数R2为0.996,大于Freundlich吸附等温线拟合的相关系数(0.934),表明其吸附过程更符合Langmuir吸附模型。通过拟合的Langmuir模型计算得到ZAL/AH对Pb2+的最大吸附量为143.3 mg·g-1,与实验值相近。而Freundlich模型拟合的吸附系数常数为8.056,1/n为0.443,在0.1~0.5的范围内,表明产物对Pb2+有较强的吸附能力[10]。这是由于片层结构的LDH具有很好的吸附能力,同时具有较大的比表面积,而Al(OH)3可以缓释OH-,有利于重金属的沉积,因此二者复合有利于Pb2+的吸附。
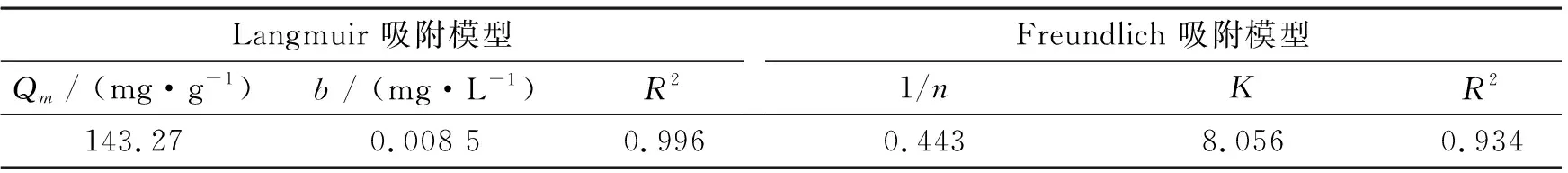
表2 ZAL/AH-1吸附等温线的拟合参数
3 结 论
通过共沉淀法制备了ZAL/AH复合材料,并考察了复合材料对水中Pb2+的吸附性能。通过XRD、IR和SEM等分析发现,复合材料ZAL/AH-1中含有ZnAl-LDH和Al(OH)3两相, 并具有很高的比表面积,其BET比表面积达到82.7 m2·g-1。通过对Pb2+离子吸附实验发现,ZAL/AH-1具有最佳的吸附性能。ZAL/AH-1对Pb2+离子的吸附量达到136.0 mg·g-1,去除率达到95%。通过动力学拟合发现,ZAL/AH-1对Pb2+的吸附过程符合拟二级动力学,即吸附反应速率是化学吸附起决定控制作用;利用Langmuir拟合得到的最大吸附量为143.3 mg·g-1,表明所制备的材料具有优异的去除重金属离子的性能。
