基于UPLC-LTQ-Orbitrap MS/MS法对粗茎秦艽药材不同初加工品化学成分的分析
2023-07-21季文静吴靳荣倪梁红赵志礼
季文静,谢 晖,吴靳荣,倪梁红*,赵志礼*
基于UPLC-LTQ-Orbitrap MS/MS法对粗茎秦艽药材不同初加工品化学成分的分析
季文静1,谢 晖2,吴靳荣1,倪梁红1*,赵志礼1*
1. 上海中医药大学,上海 201203 2. 复旦大学,上海 200433
基于代谢组学方法研究不同加工方法下粗茎秦艽药材次生代谢化合物的差异,为优化粗茎秦艽药材的加工及干燥方法提供科学依据。收集云南丽江产粗茎秦艽药材,分别进行产地和药厂加工,加工方式包括切片、原个子(不切片),干燥方式包括烘干、晒干和“发汗”。采用超高效液相色谱-离子阱-静电场轨道阱质谱(UPLC-LTQ-Orbitrap-MS)技术,结合多元统计分析方法,对各样品的次生代谢产物进行分析,筛查其差异性的特征化合物。共鉴定出44个化学成分。主成分分析(principal component analysis,PCA)结果表明,根与芦头(根茎)的化学成分存在较大的差异,根的切片组、原个子组有明显区分。正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)表明,三年生药材质量优于二年生药材,根的质量优于芦头,切片组优于原个子组,不同干燥方法中晒干组药材的质量较优,药厂加工药材质量均优于产地加工药材,并分析得到各组间主要差异化合物。粗茎秦艽药材加工时,建议选用三年生药材,去除芦头部位,并进行趁鲜切片及晒干处理。可为粗茎秦艽药材初加工工艺、质量控制与合理应用提供科学资料。
粗茎秦艽;UPLC-LTQ-Orbitrap-MS;代谢组学;加工方法;干燥方式;龙胆苦苷;马钱苷酸;獐牙菜苷;獐牙菜苦苷;6′--β-葡萄糖基龙胆苦苷
粗茎秦艽Duthie ex Burk.为龙胆科龙胆属(Tourn.) L.秦艽组Sect.Gaudin植物,是《中国药典》2020年版收载的秦艽基原植物之一,根入药,具有祛风湿、清湿热、止痹痛、退虚热的功效[1]。粗茎秦艽主要含有环烯醚萜类、黄酮类、三萜类药效成分,具有抗炎镇痛、抑菌、抗氧化、调节免疫、抗肿瘤等药理作用[2]。
中药的质量受生长环境、栽培条件、采收加工等多种因素的影响[3-4]。中药材经过加工炮制以后,会发生复杂的化学变化,将中药“质量标志物”的研究与加工炮制相结合,阐明中药加工过程中化学成分发生的变化,对中药质量控制具有指导意义[5]。切片和干燥是中药材初加工过程中不可或缺的关键操作。在干燥过程中,常涉及温度变化,易引起药材中有效成分和生物活性的变化,进而影响到中药材的药用价值和经济价值。如有研究趁鲜切制干燥对三七药材外观品质和内在成分的影响[6],以及考察干燥温度对党参药材品质的影响,优化产地加工工艺[7]。《中国药典》2020年版对粗茎秦艽的加工炮制方法较为笼统:“鲜原药材-去泥沙-发汗或否-晒干;干燥原药材洗净-润透-切厚片-干燥[1]”。有研究表明,不同干燥方式对秦艽药材中主要有效成分的含量有一定影响[8-9],但目前对秦艽初加工方法的系统性研究还较少。云南丽江为粗茎秦艽的传统道地产区,其加工炮制工艺具有代表性。课题组前期应用HPLC含量测定、指纹图谱分析方法对该地区不同加工方式的粗茎秦艽栽培药材进行化学成分比较分析,得出不同初加工方法对药材品质具有较为明显的影响[10]。
超高效液相色谱-线性离子阱-静电场轨道阱组合式高分辨质谱(UPLC-LTQ-Orbitrap-MS)是基于LTQ的多级质谱功能及Orbitrap高分辨能力的一种分析方法。前者(LTQ)富集样品离子并产生碎片,通过C-Trap注射入后者(Orbitrap)进行高分辨扫描。LTQ-Orbitrap质谱灵敏度不受分辨率影响,低分子量不影响分析时质量准确度,能够承载高浓度样品,动态范围大。这些特点使LTQ-Orbitrap质谱适合复杂混合物体系和较宽的浓度范围样品分析[11-12],已广泛应用于中药复杂化学成分的分析[13-15]。
本研究采用UPLC-LTQ-Orbitrap-MS质谱数据采集模式,结合代谢组学多元统计技术,在前期工作的基础上,进一步对丽江产粗茎秦艽进行初加工方法评价,识别并区分不同工艺、干燥方式处理后的差异性成分,以期为优化粗茎秦艽药材初加工方法提供科学依据。
1 仪器与材料
1.1 仪器
液质联用系统:Ultimate 3000超高液相色谱仪、LTQ Orbitrap质谱仪(美国Thermo Fisher Scientific公司);BSA124S-CW型电子天平(北京赛多利斯仪器系统有限公司);Milli-Q型超纯水机(美国Millipore公司);5810R型台式离心机(德国Eppendorf公司)。
1.2 试药
龙胆苦苷(批号Y30J9Q66926)、马钱苷酸(批号J22S6J3607)、獐牙菜苷(批号Y09J8C28349)、獐牙菜苦苷(批号Z05M10X87215)、6′--β-葡萄糖基龙胆苦苷(批号X25F10X81442)购自上海研谨生物科技有限公司;槲皮素(批号100081-201610)、阿魏酸(批号110773-201915)购自中国食品药品检定研究所;山柰酚(批号C26J8Y38642,上海源叶生物科技有限公司);木犀草素(批号111520-200201,中国药品生物制品检定所);芦丁(批号MUST-20011302,成都曼思特生物科技有限公司);对照品质量分数均大于98.0%。乙腈、甲醇(美国Supelco公司),甲酸(上海安谱实验科技股份有限公司),均为色谱级。
1.3 材料
2020年12月3日,于云南省丽江市鲁甸乡试验样地(E 99° 29' 12.8'',N 27° 9' 24'')采挖三年生粗茎秦艽的根,同时取适量二年生粗茎秦艽的根。凭证标本均经上海中医药大学赵志礼教授鉴定为粗茎秦艽Duthie ex Burk.,存放于上海中医药大学中药学院药用植物标本室。
药材分别于产地、药厂进行加工处理。产地加工时,不除去芦头(根茎);药厂加工时,除去芦头,将芦头单独设为一实验组。炮制加工方法:①切片,或不切片(原个子);②干燥方式:产地分为晒干、烘干;药厂分为晒干、烘干、“发汗”处理。实验样品共分为12组,编号A~L。详见表1。
表1 粗茎秦艽药材不同加工样品
Table 1 Information of sample processing
加工地点干燥方法加工方法编号 产地加工烘干组(三年生)原个子A 切片B 晒干组(三年生)原个子C 切片D 烘干组(二年生)原个子E 药厂加工烘干组(三年生)原个子F 切片G “发汗”组(三年生)原个子H 切片I 晒干组(三年生)原个子J 切片K 芦头(三年生)不加工L
2 方法
2.1 供试品溶液的制备
药材粉碎过三号筛,分别取样品粉末0.5 g,精密称定,置于50 mL锥形瓶中,精密加入色谱级甲醇溶液20 mL。在35 ℃条件下,超声提取30 min(400 W、40 kHz),取出,冷却至室温,补足减失的质量。5000 r/min离心10 min,取上清液经0.22 µm滤膜滤过,即得。
2.2 对照品溶液的制备
分别取马钱苷酸、龙胆苦苷、6′--β-葡萄糖基龙胆苦苷、獐牙菜苦苷和獐牙菜苷5种对照品适量,置10 mL量瓶中,加入甲醇定容,分别制成质量浓度为1.142、1.606、0.618、0.456、0.200 4 mg/mL的混合对照品溶液A;分别取山柰酚、槲皮素、阿魏酸对照品适量,置10 mL量瓶中,加入甲醇定容,分别制成质量浓度为0.097 60、0.236 00、0.010 63 mg/mL的混合对照品溶液B;分别取木犀草素、芦丁对照品适量,置10 mL量瓶中,加入甲醇定容,分别制成质量浓度为0.010 68、0.003 60 mg/mL的混合对照品溶液C。置于4 ℃冰箱中避光保存备用,进样前用0.22 µm微孔滤膜滤过。
2.3 分析方法
2.3.1 色谱条件 采用ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)。流动相由0.1%甲酸水溶液(A)和乙腈(B)组成。梯度洗脱:0~2 min,5% B;2~5 min,5%~12% B;5~15 min,12%~40% B;15~18 min,40% B;18~25 min,40%~95% B;25~35 min,95% B;35~40 min,95%~5% B。体积流量为0.3 mL/min,自动进样器温度为4 ℃,柱温箱温度为40 ℃,进样量为2 μL。
2.3.2 质谱条件 正负离子模式下喷雾电压分别为3.8 kV和−4.0 kV;离子源温度和毛细管温度分别为350 ℃和350 ℃。鞘气和辅助气的流量分别为40 arb和20 arb。离子传输透镜S-RFlens为30%。MS1以fullMS扫描模式检测成分,检测范围为/50~1200,分辨率为60 000。多级质谱(MS2、MS3)均采用数据依赖性扫描模式(data-dependentscanmode)进行分析,分辨率为30 000 Hz。在质谱扫描事件中,选择响应最高的离子为母离子进行裂解。裂解方式选择碰撞诱导离解(collisioninduced- dissociation),归一化碰撞能量设置为35%,间隔宽度为2.0/。激活Q(activation Q)为0.250,激活时间为10 ms。
2.3.3 进样规则 按“2.1”项所述方法,每组粗茎秦艽样品分别平行制备3份供试液,共得36份供试液,按照生成的随机数乱序放置进样室内,同时每隔6份样品溶液插入1份QC样品,共计进样42份。
2.4 数据处理
采用Thermo Xcalibur Qual Browser 2.2软件进行数据分析和处理。将所得数据导入Simca-p14.1软件进行无监督的主成分分析(principal component analysis,),初步观察12批样品的聚集情况,再结合正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis)模型的Loading plot图、S-plot图与VIP值寻找不同比较组间的差异成分,从整体到部分全面分析粗茎秦艽不同加工方式(切片与不切片)、不同干燥方法的组份差异。
3 结果与分析
3.1 质谱成分指认
正、负离子模式下混合样品的总离子流图见图1。将11个对照品图谱的保留时间和碎片离子信息比对,检索Compound Discovery软件数据库和相应的文献,结合Massfrontier7.0软件比较分析化合物的质谱信息,对其主要成分组成峰进行鉴定。共推测鉴定出44个化合物。其中环烯醚萜类14个、黄酮类12个、三萜类6个、糖类3个、有机酸类3个、苯丙素类1个、香豆素类1个、其他类4个;另有1个未知化合物。各化合物的保留时间、精确相对分子质量、二级质谱数据等见表2。
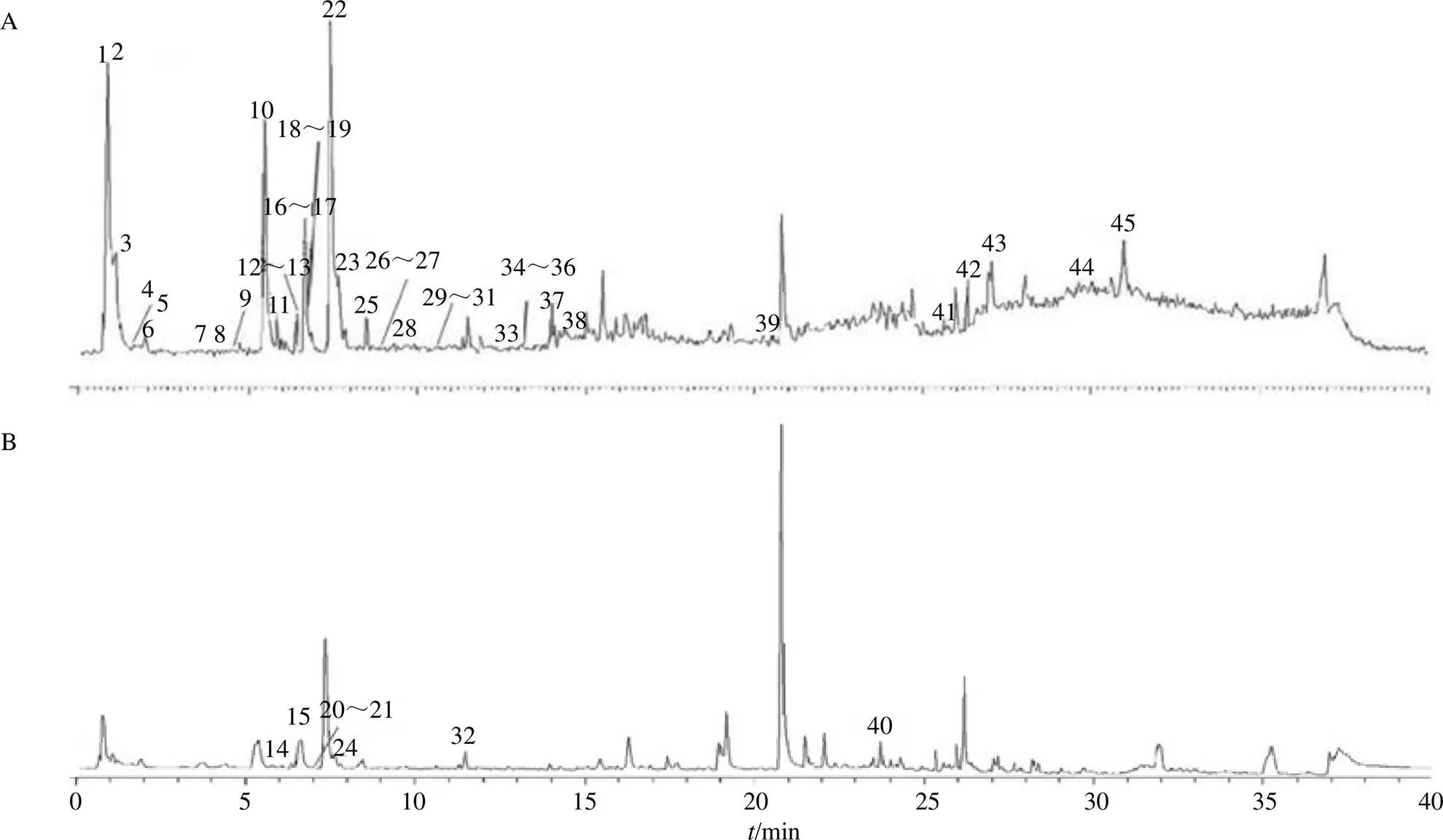
图1 粗茎秦艽UPLC-LTQ-Orbitrap-MS的负离子(A) 和正离子(B) 总离子流图
表2 粗茎秦艽化学成分保留时间及质谱参数
Table 2 Retention time and mass parameters of compounds of G. crassicaulis
编号tR/min分子式实测值(m/z)碎片离子(m/z)化合物偏差/(×10−6) 10.80C12H22O11341.107 57 [M-H]−179.056 2、161.045 8、119.035 2、89.024 6蔗糖−2.657 20.82C13H24O13387.112 64 [M-H]−341.107 5、179.055 8、119.036 0、89.024 5未知−3.166 30.86C18H32O16503.160 03 [M-H]−503.160 0、341.108 6、179.056 0棉籽糖−5.510 41.11C6H8O7191.019 24 [M-H]−191.019 4、129.019 4、111.008 8、87.008 8柠檬酸0.275 51.59C16H24O11391.122 59 [M-H]−391.122 8、229.071 2、185.081 5山栀苷−2.854 62.26C9H14O3169.086 70 [M-H]−125.097 4、123.061 3、121.031 4isoboonein−2.854 72.96C13H16O9315.070 62 [M-H]−216.928 4、153.019 3、109.029 35-(β-D-glucopyranosyl)-2-hydroxybenzoicacid−2.180 84.04C17H26O11405.138 34 [M-H]−179.056 0、161.045 3、119.035 1、89.024 5山栀苷甲酯−3.323 94.41C17H26O11405.138 43 [M-H]−179.056 2、119.035 3、89.025 6莫诺苷−3.175 10*5.41C16H24O10375.128 02 [M-H]−213.076 4、169.087 0、113.024 6、89.024 5马钱苷酸−2.697 115.60C22H34O15537.179 69 [M-H]−375.128 7、357.117 2、213.076 4、169.086 8loganicacid11-O-β-glucopyranosylester−3.974 126.42C16H22O11389.107 15 [M-H]−389.107 5、345.118 2、183.066 1、121.066 0四乙酰开联番木鳖苷−3.254 136.44C15H22O9345.117 71 [M-H]−213.076 4、183.066 1、165.055 6、89.024 6swertiajaposide B−2.280 146.51C17H24O10387.128 05 [M-H]−225.076 4、179.056 0、89.024 5马鞭草苷−1.584 15*6.58C22H30O14517.154 17 [M-H]−179.056 0、149.060 9、119.035 1、89.024 56′-O-β-D-葡萄糖基龙胆苦苷−3.249 16*6.60C16H22O10419.117 03 [M-H]−373.110 7、179.055 9、141.019 4、89.024 5獐牙菜苦苷−2.148 176.63C9H8O4179.034 62 [M-H]−179.034 6、135.045 25-乙酰基水杨酸−0.420 186.87C22H32O14519.169 25 [M-H]−519.169 8、195.065 9、125.024 5紫药苦苷−3.757 19*6.88C27H30O16609.142 40 [M-H]−609.143 6、447.091 8、357.060 8、327.050 2芦丁−5.920 206.99C10H8O5209.044 65 [M+H]+191.034 1、163.039 3、135.044 2秦皮素2.090 217.01C27H30O15593.148 32 [M-H]−575.138 4、503.118 0、473.107 6、311.052 6皂草黄苷−5.560 22*7.30C16H20O9355.102 26 [M-H]−355.112 9、149.056 6、119.035 2、89.024 6龙胆苦苷−1.906 237.35C26H28O12531.147 16 [M-H]−235.060 6、193.050 3、149.060 8gentimacroside−3.410 24*7.63C16H22O9403.122 50 [M+HCOOH-H]−357.118 3、195.066 1、179.056 0、125.024 6獐牙菜苷−2.288 258.43C21H20O11447.090 82 [M-H]−429.080 9、357.060 5、327.050 1异荭草素−4.650 268.90C21H20O10431.096 31 [M-H]−413.086 7、341.065 6、311.055 0、牡荆素−4.624 27*8.91C10H10O4193.048 69 [M-H]−178.026 8、149.060 8、134.037 5阿魏酸−1.426
续表2

编号tR/min分子式实测值(m/z)碎片离子(m/z)化合物偏差/% 289.31C17H24O11431.096 19 [M-H]−413.086 7、341.065 6、311.055 6异牡荆素−4.850 2910.26C27H32O14579.167 72 [M-H]−459.112 8、313.070 6、271.060 2、151.003 6柚皮苷−5.470 3010.38C15H10O7519.184 69 [M-H]−357.133 1、342.107 5、151.040 06′-O-β-D-葡萄糖基獐牙菜苷−2.096 3110.51C28H34O15609.179 14 [M-H]−609.179 4、325.070 7、301.070 6橙皮苷−5.400 3211.46C25H34O14557.184 63 [M-H]−323.097 9、233.081 5、189.092 0、119.035 2大叶苷D−2.767 3312.81C24H28O11491.154 21 [M-H]−191.055 7、149.045 5、89.024 4大叶苷A−1.177 34*12.91C15H10O6285.038 76 [M-H]−257.044 5、241.049 7、177.019 0、木犀草素−3.970 35*12.93C15H10O7301.033 87 [M-H]−301.034 3、193.013 8、151.003 7、槲皮素−1.957 3613.94C15H10O5269.044 46 [M-H]−269.044 7、247.437 0、117.029 0芹菜素−3.650 37*14.24C15H10O6285.039 22 [M-H]−285.093 4、257.044 5、151.003 6山柰酚0.335 3814.50C14H10O6273.039 28 [M-H]−273.039 4、229.049 8、137.024 4当药宁−4.140 3920.49C30H48O6503.335 50 [M-H]−503.335 6、326.540 1、125.954 7arjungenin−5.040 4023.86C30H48O4471.345 67 [M-H]−471.346 1、430.897 6、314.059 2科罗索酸−2.581 4125.71C30H48O3455.350 80 [M+H]+455.351 3、142.306 7、136.725 8熊果酸−4.680 4226.82C16H32O2255.232 18 [M-H]−255.232 3、114.934 2棕榈酸−3.470 4327.36C29H44O2423.324 83 [M-H]−423.324 7、394.900 1、205.159 4vaticinone−4.720 4429.16C30H48O3455.351 07 [M+H]+455.350 8、397.309 5、95.834 4齐墩果酸−4.260 4530.97C29H50O457.366 97[M+HCOOH-H]−457.366 7、441.330 5β-谷甾醇−2.278
*通过对照品对比确认
*identified by comparing with reference standards
3.2 粗茎秦艽化学成分的主成分分析
利用Simca14.1软件对在负离子模式下采集的所有样本数据进行PCA,其中9个主成分的特征值>1,占总方差的74%。6份QC样品在PCA分析图中分布集中,表明方法稳定性高,数据质量可靠。粗茎秦艽所有加工组成分的PCA得分图见图2,根聚为一簇,根茎(芦头)为单独一类,表明不同部位间差异明显。同时,根的切片组样品、原个子组样品也分别各自聚在一起,表明药材切片与否对样品化学成分的变化存在一定影响。
3.3 不同年限与不同部位的粗茎秦艽化学成分的主成分分析
OPLS-DA是一种有监督的分析方法,可用于确定2组间的代谢差异物[16]。对不同年限(二年生、三年生)粗茎秦艽药材的化学成分进行OPLS-DA分析,交叉验证参数2X、2、2分别为0.901、1.000、0.992,均远大于0.5,提示模型具有很好的稳定性和预测能力。以VIP>3、检验的<0.05,同时存在于各样品中并且含量具有明显差异为标准(下同),共鉴定出6个差异明显的化合物(图3),分别为龙胆苦苷、马钱苷酸、6′-β-葡萄糖基龙胆苦苷、柠檬酸、十四烷基硫酸酯和十八烷基-3-[(2, 6-二异丙基苯)氨基酯]-3-氧代丙酸乙酯。差异化合物含量由利用Compound Discovery软件匹配得到的数据矩阵中的化合物的峰面积表示。根据差异化合物含量高低,得出三年生药材质量优于二年生药材。
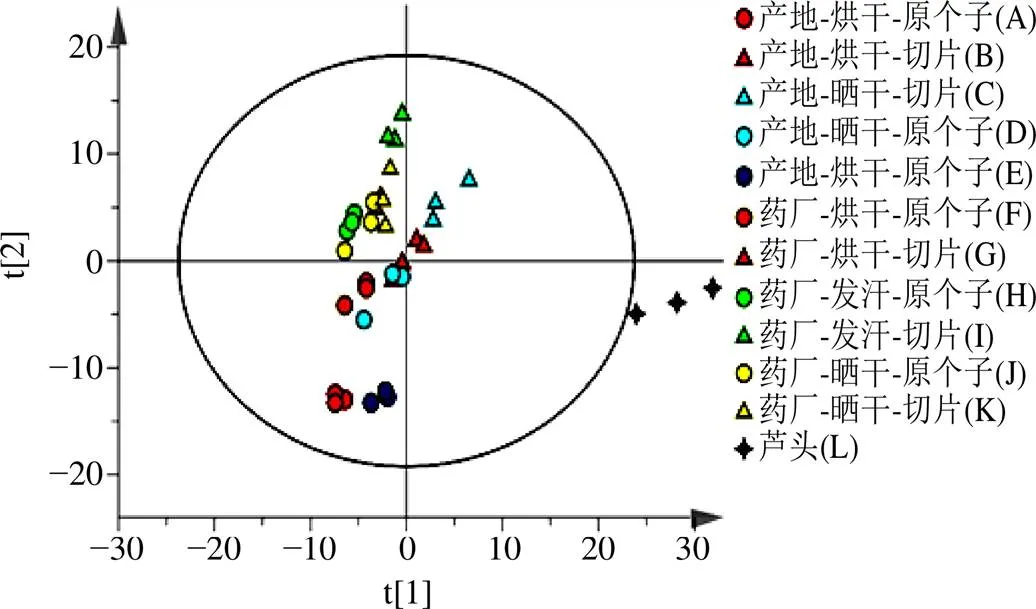
图2 粗茎秦艽样品PCA得分图
对不同部位(根、芦头)粗茎秦艽药材的化学成分进行OPLS-DA分析,交叉验证参数2、2、2分别为0.634、0.992、0.958。共鉴定出3个差异明显的化合物(图4),分别为龙胆苦苷、6′-β-葡萄糖基龙胆苦苷、4-十一烷基苯磺酸。根据差异化合物含量高低,得出根的质量明显优于芦头。
3.4 不同干燥方法下粗茎秦艽的差异化合物筛查
为进一步明确不同干燥方法下粗茎秦艽药材的组间差异性,寻找样品间化学成分变化的特征性指标,采用OPLS-DA分别对产地、药厂不同干燥方法的数据作进一步分析(均用三年生根平行比较)。表3为不同干燥方法下样品的OPLS-DA分析结果。
各组别的交叉验证参数2、2、2均大于0.5。不同组别的干燥方法间共鉴定出11种差异化合物,其中龙胆苦苷、獐牙菜苦苷和柠檬酸为各组别间共有的差异化合物。根据差异化合物含量高低,可以得出产地加工药材中,晒干组优于烘干组;药厂加工药材中,晒干组质量最优,其次为“发汗”组,最后为烘干组。
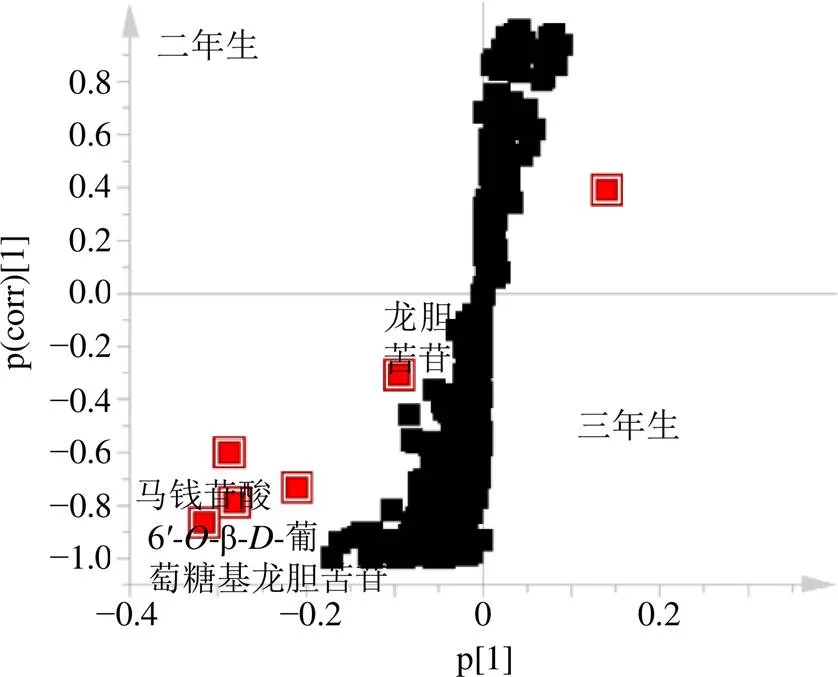
图3 二年生和三年生样品的OPLS-DAS-plot图
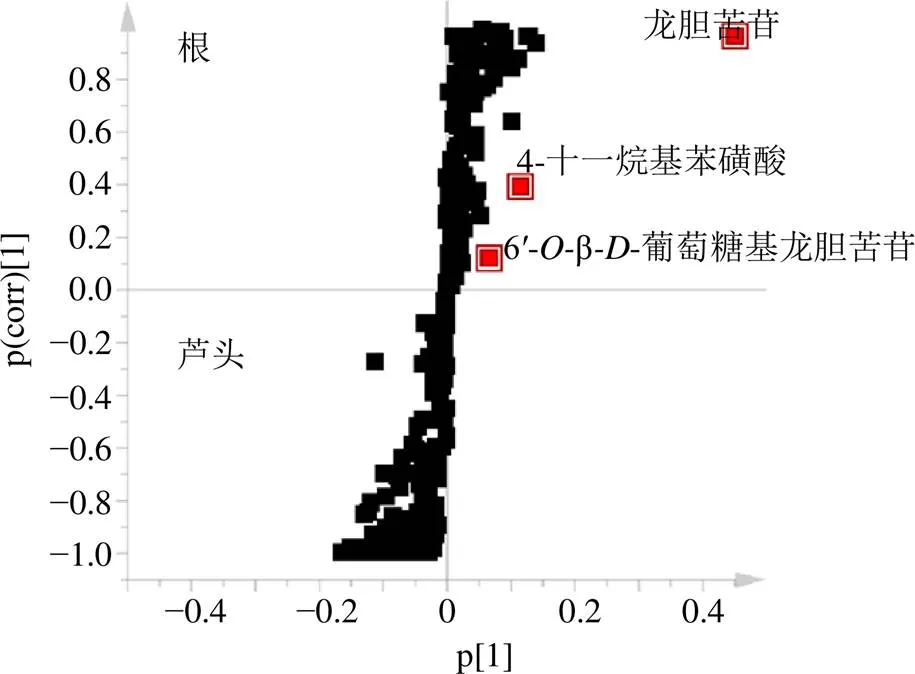
图4 芦头和根的OPLS-DAS-plot图
表3 不同干燥方法组OPLS-DA结果
Table 3 OPLS-DA results of different drying groups
比较组别R2XR2YQ2差异化合物 烘干vs晒干(产地加工)0.7980.9990.5862-羟基苯乙酸、龙胆苦苷、马钱苷酸、柠檬酸、葡萄糖酸、十八烷基-3-[(2,6-二异丙基苯)氨基]酯]-3-氧代丙酸乙酯、十四烷基硫酸酯、獐牙菜苦苷 烘干vs晒干(药厂加工)0.7390.9970.6864-十一烷基苯磺酸、6′-O-β-D-葡萄糖基龙胆苦苷、龙胆苦苷、柠檬酸、十八烷基-3-[(2,6-二异丙基苯)氨基酯]-3-氧代丙酸乙酯、十四烷基硫酸酯、獐牙菜苦苷 烘干vs发汗(药厂加工)0.7060.9970.8886′-O-β-D-葡萄糖基龙胆苦苷、龙胆苦苷、马钱苷酸、柠檬酸、獐牙菜苷、獐牙菜苦苷 晒干vs发汗(药厂加工)0.8371.0000.8704-十一烷基苯磺酸、6′-O-β-D-葡萄糖基龙胆苦苷、龙胆苦苷、柠檬酸、葡萄糖酸、十八烷基-3-[(2, 6-二异丙基苯)氨基酯]-3-氧代丙酸乙酯、十四烷基硫酸酯、獐牙菜苷、獐牙菜苦苷
产地加工条件下,晒干组中龙胆苦苷、马钱苷酸、柠檬酸和葡萄糖酸含量远高于烘干组。药厂加工条件下,晒干组中6′-β-葡萄糖基龙胆苦苷、柠檬酸、4-十一烷基苯磺酸、葡萄糖酸和十四烷基硫酸酯的含量较“发汗”组高,獐牙菜苦苷、柠檬酸、4-十一烷基苯磺酸以及十四烷基硫酸酯高于烘干组;“发汗”组中,龙胆苦苷、马钱苷酸、獐牙菜苦苷和獐牙菜苷的含量较烘干组、晒干组高。
3.5 不同加工方法粗茎秦艽的差异化合物筛查
为了明确切片和原个子样品间的差异,采用OPLS-DA分别对产地和药厂加工中的2种加工方式进行比较分析(均用三年生根平行比较),分析结果见表4。
不同加工方法间共鉴定出10种差异化合物,其中龙胆苦苷、马钱苷酸、6′-β--葡萄糖基龙胆苦苷、十八烷基-3-[(2,6-二异丙基苯)氨基酯]-3-氧代丙酸乙酯、十四烷基硫酸酯和柠檬酸为共有的差异化合物。根据差异化合物含量高低,可以得出,无论是产地或药厂加工,切片组药材的主要差异化合物含量普遍高于原个子组。产地切片组药材中,马钱苷酸、6′-β--葡萄糖基龙胆苦苷、柠檬酸、十八烷基- 3-[(2,6-二异丙基苯)氨基酯]-3-氧代丙酸乙酯和十四烷基硫酸酯等成分含量高于原个子组;药厂切片组的龙胆苦苷、马钱苷酸和獐牙菜苦苷等环烯醚萜类化合物含量远高于原个子组。
表4 不同加工方法组OPLS-DA结果
Table 4 OPLS-DA results of sliced roots and whole roots
比较组别R2XR2YQ2差异化合物 切片vs原个子(产地加工)0.8471.0000.9846′-O-β-D-葡萄糖基龙胆苦苷、5-乙基环己烷-1,3-二酮、龙胆苦苷、马钱苷酸、柠檬酸、十八烷基-3-[(2,6-二异丙基苯)氨基]酯]-3-氧代丙酸乙酯、十四烷基硫酸酯、獐牙菜苷 切片vs原个子(药厂加工)0.5180.9890.5834-十一烷基苯磺酸、6′-O-β-D-葡萄糖基龙胆苦苷、龙胆苦苷、马钱苷酸、柠檬酸、十八烷基-3- [(2,6-二异丙基苯)氨基]酯]-3-氧代丙酸乙酯、十四烷基硫酸酯、獐牙菜苦苷
3.6 药厂加工与产地加工的粗茎秦艽化学成分的主成分分析
平行选取三年生烘干及晒干样品,分别对药厂、产地加工药材的化学成分进行PCA和OPLS-DA分析(图5)。使用PCA对数据进行处理,其中8个主成分的特征值>1,占总方差的77%,由得分图可以看出,产地加工样品、药厂加工样品各自聚在一起,能够明显区分;OPLS-DA的交叉验证参数2、2、2为0.693、0.992、0.770,共鉴定出5个差异明显的化合物,分别为龙胆苦苷、马钱苷酸、十四烷基硫酸酯、4-十一烷基苯磺酸和5,7-二羟基-4-丙基香豆素。根据差异化合物含量高低,药厂加工药材质量优于产地加工药材。

图5 产地与药厂加工样品的PCA得分图(A)及OPLS-DA的S-plot图(B)
4 讨论
本实验对粗茎秦艽药材不同初加工样品进行较为系统的化学成分比较分析,显示芦头与根之间存在较大的差异;切片与原个子及不同干燥方法间也有明显区分,表明药材的部位及加工方式对化学成分具有一定影响,与前期HPLC分析方法评价基本结果一致[10]。同时,药厂加工样品均优于产地加工样品,分析可能有以下因素:首先是药材本身,产地加工的样品不除去芦头,而药厂加工的样品去除芦头;其次为干燥方式,产地烘干为传统的炭火烘烤,药厂加工则使用烘箱烘干,晒干方式上,药厂有药材专用的晒干场地,规范且统一。
UPLC-LTQ-Orbitrap高分辨质谱采用全扫描模式,分别测定正、负离子模式下的总离子流图,裂解方式采用了CID方式,绝大部分的化合物在此方式下均能产生更多的碎片信息,在保证预测化合物分子式的准确性前提下,更全面地鉴定粗茎秦艽中的化学成分。本研究运用UPLC-LTQ-Orbitrap MS技术,对不同加工方法下粗茎秦艽药材中的化学成分进行表征分析,基于化合物相关数据库、对照品指认和多级质谱碎片离子等信息,并结合相关文献报道,共鉴定出44个化合物,包括环烯醚萜苷类、黄酮类、三萜类、糖类、有机酸类、苯丙素类、香豆素类和其他类化合物,其中以环烯醚萜苷类、黄酮类化合物居多。环烯醚萜苷类成分在负离子模式下倾向于丢失环烯醚萜母核、H2O和发生逆RDA反应在环烯醚萜骨架;黄酮类成分在负离子模式下倾向于通过RDA反应在C环上产生/151的特征离子。同时,粗茎秦艽药材化学成分中有较多的同分异构体,如山柰酚和木犀草素,在制备混合对照品溶液时,同分异构体需分开配制。
对不同加工方法、不同干燥方式下粗茎秦艽药材中差异性标志物的分析表明,共有差异性成分主要为环烯醚萜类和有机酸类,提示加工方式对粗茎秦艽药材中这2大类成分的富集影响较大。不同初加工粗茎秦艽药材中化学成分的类型没有明显变化,但是主要化学成分的含量发生了变化。根据差异性成分分析结果,粗茎秦艽趁鲜切片样品的质量高于原个子样品,切片药材中龙胆苦苷、獐牙菜苦苷、獐牙菜苷等药效成分的含量均普遍高于原个子组。同时,药材趁鲜切片也可极大缩短干燥时间[6]。关于粗茎秦艽药材切片的方式、厚度等,需要进一步探讨。“发汗”是中药的特色加工方法[17],可增加药材的香味或减少刺激性,有利于干燥。本实验分析结果显示,不同干燥方式中,晒干组药材主要差异性成分的含量比“发汗”组高,与大叶秦艽药材的研究结果一致[18],同时,“发汗”组药材中龙胆苦苷、马钱苷酸等指标性成分含量较高。考虑到“发汗”干燥法耗时长,操作繁杂,粗茎秦艽药材是否需要“发汗”,可根据实际情况加以选择。
综上,粗茎秦艽药材初加工时,建议选用三年生药材,并去除芦头部位,以提升药材品质。在加工过程中,药效成分的含量受到多方面因素的影响,包括是否切片、干燥方法等。在实际应用中,根据粗茎秦艽药材特征、成分特点,建议趁鲜切片,可选用便捷的晒干方式。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 282.
[2] 聂安政, 林志健, 王雨, 等. 秦艽化学成分及药理作用研究进展 [J]. 中草药, 2017, 48(3): 597-608.
[3] 杜真辉, 张岩荣, 董诚明, 等. 不同栽培模式下铁棍山药的质量评价 [J]. 中医学报, 2017, 32(9): 1694-1696.
[4] 赵小勤, 黄晓婧, 罗霄, 等. 不同部位和不同产地加工方法的知母质量评价研究 [J]. 中草药, 2021, 52(22): 6990-6997.
[5] 孙嘉辰, 李霞, 王莹, 等. 中药加工炮制过程中质量标志物的研究进展 [J]. 中草药, 2020, 51(10): 2593-2602.
[6] 刘勇, 陈骏飞, 徐娜, 等. 趁鲜切制加工对三七药材干燥速率和质量的影响 [J]. 中国中药杂志, 2019, 44(7): 1381-1391.
[7] 黄朝润, 吴发明, 姚秋阳, 等. 产地加工过程中干燥温度对党参药材性状特征及内在质量的影响 [J]. 中药材, 2017, 40(10): 2325-2330.
[8] 张润, 陈千良, 胡河荷. 干燥方法对秦艽药材中有效成分含量的影响 [J]. 时珍国医国药, 2019, 30(6): 1348-1351.
[9] 徐燕, 李爱暖, 王玥, 等. 基于UPLC-ESI-HRMSn评价不同干燥方式对粗茎秦艽中环烯醚萜类及黄酮类成分的影响 [J]. 中草药, 2018, 49(4): 819-825.
[10] 季文静, 张玉萱, 赵志礼, 等. 云南丽江产粗茎秦艽溯源及道地药材初加工方法评价 [J]. 药学学报, 2022, 57(2): 507-513.
[11] 王勇为. LTQ-Orbitrap Velos双分压线性阱和静电场轨道阱组合式高分辨质谱性能及应用 [J]. 现代仪器, 2010, 16(5): 15-19.
[12] Eliuk S, Makarov A. Evolution of orbitrap mass spectrometry instrumentation [J].(), 2015, 8: 61-80.
[13] 肖治均, 杨欣欣, 梅矩铭, 等. 基于UPLC-LTQ- Orbitrap-MS分析刺果番荔枝叶的化学成分 [J]. 环球中医药, 2020, 13(4): 583-591.
[14] Tu J J, Li Q L, Zhou B H. The tannins fromL. (Rosaceae): A systematic study on the metabolites of rats based on HPLC-LTQ-orbitrap MS2analysis [J]., 2021, 26(13): 4053.
[15] Li D X, Liu D H, Shao D Y,. Wide identification of the compounds in licorice and exploration of the mechanism for prostatitis treatment by combining UHPLC-LTQ-orbitrap MS with network pharmacology [J]., 2019, 4(11): 3011-3017.
[16] 姚玲玲, 柯昌强, 刘佳, 等. 不同炮制程度中药饮片蜜炙甘草的次生代谢化学成分组学研究 [J]. 药学学报, 2021, 56(5): 1444-1452.
[17] 段金廒, 宿树兰, 严辉, 等. 药材初加工“发汗”过程及其酶促反应与化学转化机制探讨 [J]. 中草药, 2013, 44(10): 1219-1225.
[18] Chen Q, Shi Z, Wang Y,. Study on effects of sweating treatment and different drying methods on the quality of[J]., 2021(11): 9717.
Chemical constituents of underground part ofwithdifferent processing methodsbased on UPLC-LTQ-Orbitrap MS/MS
JI Wen-jing1, XIE Hui2, WU Jin-rong1, Ni Liang-hong1, ZHAO Zhi-li1
1. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 2. Fudan University, Shanghai 200433, China
To study the differences of secondary metabolites in underground part ofprocessed in different ways based on metabolomics, so as to provide scientific basis for optimizing its processing and drying methods., collected from Lijiang of Yunnan Province, was processed in the locality and pharmaceutical factory, respectively. The processing methods included slicing and whole roots (not slicing), and the drying methods included stoving, air drying and sweating. UPLC-LTQ-Orbitrap-MS technology and multivariate statistical analysis were used to analyze the secondary metabolites of each sample to screen the characteristic compounds with differences.A total of 44 chemical components were identified by analysis of all samples. The results of principal component analysis (PCA) showed that there were significant differences in the chemical composition between rhizomes and roots, and there were obvious differences between sliced roots and whole roots. The results of orthogonal partial least squares discriminant analysis (OPLS-DA) showed the quality of triennial materials was superior to that of biennial materials, the quality of roots was better than that of rhizomes, the quality of sliced roots was better than that of whole roots. The quality of materials by air drying was the best, and the quality of materials processed in pharmaceutical factory was better than that processed in the locality. The main differential compounds among different groups were also analyzed.It is suggested to select triennial materials, remove the rhizomes and slice the roots whenis processed. The results could provide the basis for the primary processing technology, quality control and rational application of.
Duthie ex Burk; UPLC-LTQ-Orbitrap-MS; metabonomics; processing method; drying method;gentiopicroside; loganic acid; sweroside; swertiamarin; 6′--β--glucosyl-gentiopicroside
R286.2
A
0253 - 2670(2023)14 - 4641 - 08
10.7501/j.issn.0253-2670.2023.14.025
2023-01-03
国家自然科学基金面上项目(82073959);国家自然科学基金面上项目(81173654);上海市卫生健康委员会中医药传承和科技创新项目(2022QN030)
季文静,女,硕士研究生,研究方向为中药资源与品种鉴定。E-mail: 1147221058@qq.com
倪梁红,男,副教授。E-mail: nlhtcm@126.com
赵志礼,男,教授。E-mail: zhilzhao@sohu.com
[责任编辑 时圣明]
