糖基化基因B4GALT5在胰腺癌恶性进展中的作用
2023-07-18刘雪昂马文静
刘雪昂,时 坚,胡 冉,朱 岩,马文静,朱 毅*
1南京医科大学第一附属医院胰腺中心,江苏 南京 210029;2南京医科大学胰腺研究所,江苏 南京 210029;3南京医科大学第一附属医院公共实验中心,4病理科,江苏 南京 210029
胰腺癌(pancreatic cancer,PC)是一种高度侵袭性和致命性的恶性肿瘤,是目前癌症死亡的第三大原因[1],远处转移超过50%[2],对放疗、化疗不敏感,只有15%~20%的患者能从手术中获益,5 年生存率低于10%[3]。胰腺癌发生隐匿、起病早期阶段无症状、迄今尚缺乏可靠的早期诊断生物标志物与特异敏感的诊断方法等都是导致胰腺癌确诊晚、治疗难和病死率高的根源[4]。目前糖类抗原CA19-9 虽然被广泛用于胰腺癌发生与预后的监测[5],但由于大约有10%的人群不表达Lewis 抗原,CA19-9 也可在良性胰胆管疾病和胆道梗阻的情况下升高等原因,CA19-9 尚不能提供足够的准确性来早期发现和诊断胰腺癌。为了解决胰腺癌早期诊断、根治、预后等棘手问题,探索新的生物标志物是重要和紧要的研究工作[6]。
糖基化是在酶的控制下,将糖链连接到糖类、脂类或蛋白质分子上的过程。糖基化代表了一组独特的蛋白质修饰,可能涉及单糖甚至整个寡糖(聚糖)与糖蛋白内的特定氨基酸相连接的过程。糖基化修饰主要发生在高尔基体和内质网中,反映了一系列复杂的酶、细胞器和其他因素的协调作用,糖链与脂质和蛋白质连接的两种最常见的机制是O-连接和N-连接的糖基化[7]。
糖基化也是肿瘤转化过程中的表观遗传学变化之一[8]。肿瘤中的异常糖基化修饰在50 年前被首次描述[9],迄今,许多研究表明糖基化基因主导的糖基化修饰与肿瘤的发生发展密切相关[10]。特别是,聚糖不能像蛋白质和核酸那样直接从基因组编码模板合成,其保真度主要取决于糖基转移酶(glycosyltransferase,GT)的特异性,后者通过一次添加一种糖来合成复杂的聚糖。大多数真核生物GT 定位于分泌通路的腔内,并在向细胞表面或细胞外间隙转运时修饰蛋白质和脂质[11]。与未恶性转化的细胞相比,肿瘤细胞显示出异常的糖基化改变,异常的糖基化已被认为是所有癌症的一个普遍标志。
通过系统整合在公共数据库TCGA 与GTEx 中胰腺癌患者生物样本的测序数据,本研究筛选出与胰腺癌预后相关的糖基化差异表达基因,其中,风险比(hazard ratio,HR)最大的基因是β-1,4-半乳糖基转移酶5(beta-1,4-galactosyltransferase 5,B4GALT5)。B4GALT5 是7 个β-1,4-半乳糖基转移酶基因之一,B4GALT5 催化半乳糖从UDP-半乳糖向葡萄糖神经酰胺(GlcCer)转移合成乳糖基神经酰胺(LacCer)[12-13]。B4GALT5 主要存在于细胞表面,也定位于高尔基复合体中,类似于其他糖基转移酶,它们修饰的蛋白分子作为黏附分子参与基质相互作用、细胞扩散和迁移以及信号转导级联。B4GALT5的功能在肝细胞癌[14]、妇科肿瘤[15]中已有报道,但是B4GALT5在胰腺癌中的作用迄今尚未见报道。本研究还进一步在本中心的胰腺生物样本组织和胰腺癌细胞系中验证了B4GALT5 的表达情况,通过系列体外实验证明了其在胰腺癌恶性生物学行为中的作用。
1 资料和方法
1.1 资料
本研究从公共癌症基因组图谱数据库(TCGA,https://portal.gdc.cancer.gov/)中获得了178例胰腺癌患者和4例正常胰腺样本的转录组测序数据和相关临床参数(如性别、年龄、分级、TNM 分期、生存期等)。另外165 个正常胰腺样本的信息来自基因型组织表达数据库(GTEx,https://www.gtexportal.org/home/index.html)。糖基化相关基因集来源于在线数据库GGDB(GlycoGene DataBase,https://acgg.asia/ggdb2/)[16]。验证样本集来源于南京医科大学第一附属医院胰腺中心2019—2022 年行胰十二指肠切除术60 例患者的胰腺癌组织和配对的邻近非肿瘤组织,组织样本由ISO90012015 质量认证的胰腺专病生物样本库提供,并由两位病理医生核对与证实。医院伦理委员会批准了该研究使用患者的生物样本(伦理号:2020-SRFA-364),所用的生物样本均有书面的患者签名知情同意书。
1.2 方法
1.2.1 糖基化相关的差异表达基因(differential expression genes related to glycosylation,DE-GRG)的筛选
使用Wilcoxon 检验进行糖基化差异基因的鉴定,纳入标准为P<0.05 且|log2FC|≥1。使用R 包“ComplexHeatmap”绘制聚类热图。
1.2.2 单因素Cox分析
使用R 包“survival”进行单变量Cox 分析,筛选出与胰腺癌患者生存相关的DE-GRG。
1.2.3 GO/KEGG富集分析
GO 分析用于对基因或蛋白质进行功能分类,主要应用于基因表达谱分析、蛋白质互作网络分析和新基因功能预测等领域。KEGG分析主要针对生物体中的代谢通路。使用R 包“clusterProfiler”进行GO/KEGG富集分析。
1.2.4 表达验证及生存分析
应用在线分析网站GEPIA(http://gepia.cancerpku.cn/)对目的基因进行表达水平和预后相关分析,Kaplan-Meier 曲线又称生存曲线,主要分析与评估单一因素对患者生存期的影响。
1.2.5 细胞培养
人胰腺癌细胞系(CFPAC-1、MIA PaCa-2、BxPC-3、PANC-1)和正常人的胰腺导管上皮细胞系(HPNE)均购于上海细胞库。小鼠胰腺癌细胞系Panc02 购于北京国家实验细胞资源共享服务平台。细胞系均使用含有10%胎牛血清的DMEM 培养基,在5%CO2培养箱中37 ℃培养。
1.2.6 定量PCR
使用TRIzol 试剂抽提细胞和研磨后组织中的总RNA。接下来,使用1 μg 总RNA 和TRUEscript RT 试剂盒在20 μL 的最终体积中进行逆转录。采用2×SYBR Green Master Mix和终体积10 μL的体系进行定量PCR。采用2-ΔΔCt法计算相对基因表达量。每次实验均设置3 个复孔,共重复3 次。B4GALT5 引物序列如下:上游5'-GATCCGGGACAACGTGA-GAAC-3';下游5'-TTCAGGGCAGGTATGGTTTGC-3'。GAPDH 引物序列如下:上游5'-ACGGGAAGC-TTGTCATCAAT-3';下 游5'-TGGACTCCACGACGTACTCA-3'。
1.2.7 Western blot
使用RIPA 缓冲液分离总蛋白,然后用BCA 蛋白分析试剂盒定量。用10%SDS-PAGE 胶电泳,恒压100 V 持续1 h。接着用PVDF 膜恒流0.4 A 湿转40 min。用5%脱脂牛奶封闭2 h 后,使用稀释后的一抗在4 ℃下孵育过夜,然后加入辣根过氧化物酶标记的二抗在室温下孵育2 h。洗涤3 次后,使用ECL 化学发光试剂检测。使用Image J 软件对电泳条带进行灰度扫描,同时进行半定量分析。
1.2.8 质粒转染
取无酶1.5 mL EP 管,加入对应比例的Lipofectamine 3000 转染试剂和不含抗生素的DMEM 培养基,吹打混匀静置5 min;另取1.5 mL EP管,加入质粒,再加入不含抗生素的DMEM 培养基,吹打混匀静置5 min。最后将两个EP 管中的试剂混合均匀,静置15 min 后将Lipofectamine 3000和质粒混合溶液缓慢旋转加入细胞培养皿中。24 h 后换液,48~72 h检验转染效率。
1.2.9 CCK-8实验检测细胞的增殖水平
将转染后的胰腺癌细胞接种于96孔板,37 ℃培养48 h 后,替换为100 μL/孔10%的CCK-8 溶液,放置培养箱避光孵育1 h,酶标仪测定450 nm 处的吸光度值。
1.2.10 划痕实验
铺板前用记号笔在6 孔板背面划2 条横线,线间距为0.5~1.0 cm,横穿过孔。每孔加入5×105个细胞。24 h后用枪头垂直于背后的横线划痕。PBS洗3 次去除漂浮的细胞,加入无血清培养基,放入37 ℃、5% CO2培养箱培养。按0 h、24 h 时间点取样,拍照。使用Image J 软件测量最开始(0 h)的划痕面积和24 h的伤口面积,计算24 h的伤口划痕百分比=24 h的伤口面积/0 h的划痕面积×100%。
1.2.11 Transwell侵袭实验
用1∶5 稀释的基质胶包被上室底部,放置于37 ℃培养箱约30 min。用无血清的DMEM 制备细胞悬液,细胞浓度调整为2×105个/mL。在上室加入200 μL 细胞悬液,在下室加入500 μL 含10% FBS的培养基,在37 ℃、5% CO2培养箱中培养24 h。用棉签轻轻擦拭上室的细胞,用4%多聚甲醛固定10 min,然后用0.1%结晶紫染色5~10 min,用PBS 洗涤3 次,在倒置显微镜下随机选择10 个高倍视野(×200)进行细胞计数。
1.3 统计学方法
所有数据统计分析和可视化均在R4.2.1版本及GraphPad Prism 7 中进行,每个实验独立重复3 次,数据以均数±标准差(±s)表示,pROC[1.18.0]用于受试者工作特征(receiver operating characteristic,ROC)曲线分析,生存分析采用Kaplan-Meier 法并进行log-rank 检验,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 胰腺癌预后相关糖基化基因的筛选
基于TCGA-GTEx 联合数据库中178 例胰腺癌患者数据(表1)和169 例正常组织数据,在糖基化基因集中共筛选出66 个DE-GRG,包含20 个下调基因和46 个上调基因,绘制热图将其进行可视化(图1A)。为了进一步鉴定与预后相关的DE-GRG,根据TCGA 数据库中的转录本信息和临床参数,使用单因素Cox 分析得到20 个与预后相关的DE-GRG,其中14个为危险性因素,6个为保护性因素(图1B),其中,HR 最大的基因是糖基转移酶B4GALT5(HR=21.372,P<0.05)。

图1 预后相关DE-GRG的筛选Figure 1 Identification of prognosis-related DE-GRG
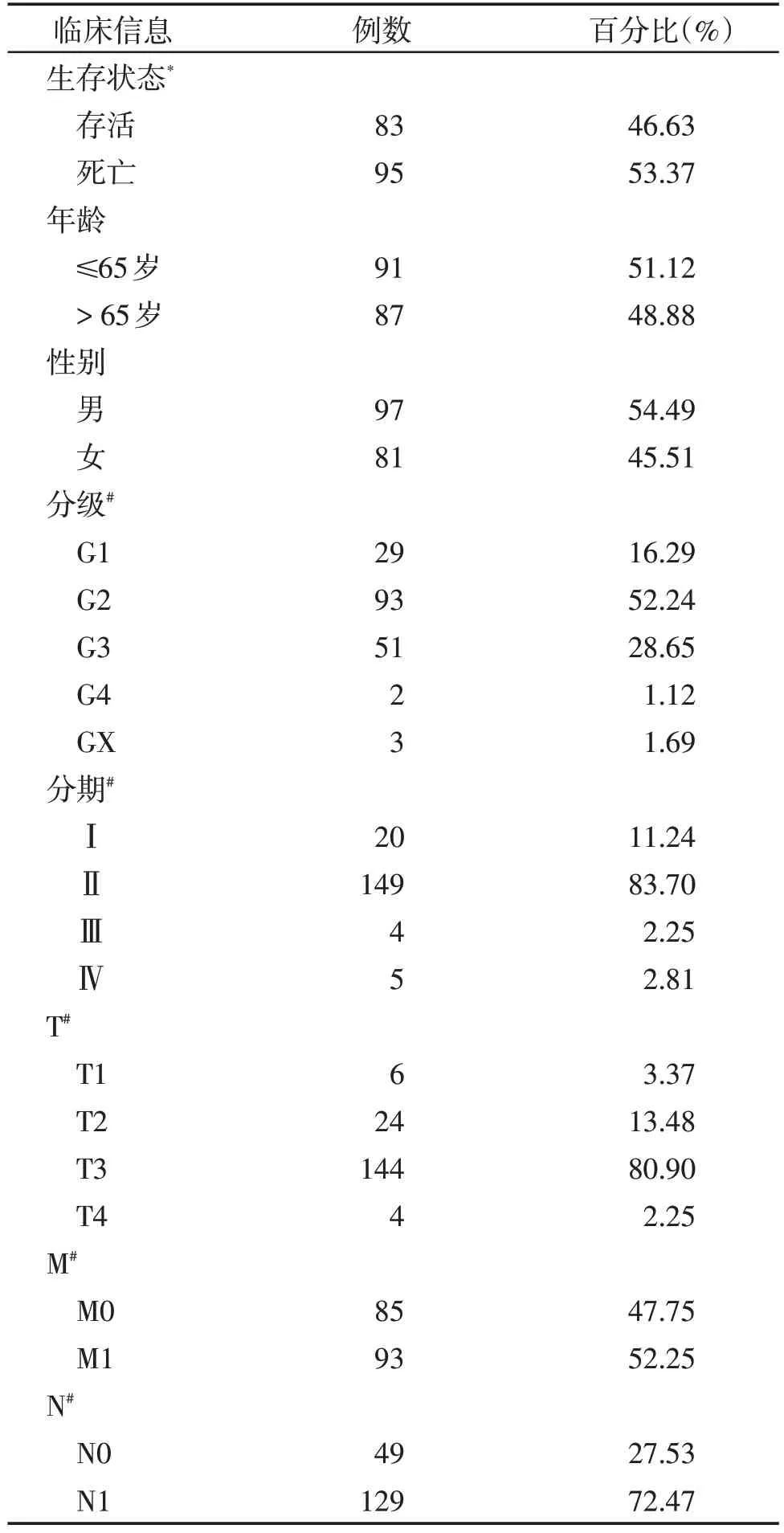
表1 TCGA数据库中患者的临床信息Table 1 Clinical information of patients in the TCGA database
进一步对20个预后相关的DE-GRG 进行了GO和KEGG富集分析。在GO分子功能中,DE-GRG主要富集在各类糖基转移酶活性领域GO 生物过程中,包括乙酰葡糖胺转移酶活性、乙酰半乳糖胺基转移酶活性、UDP-糖基转移酶活性等。DE-GRG 与肿瘤的糖蛋白途径密切相关,包括糖蛋白的生物合成过程和代谢过程,大分子和蛋白质的糖基化修饰过程等。在细胞内,DE-GRG 主要定位于高尔基体中,亚细胞器分布集中于高尔基体亚室、高尔基体堆栈和高尔基体池中。KEGG通路富集分析结果进一步提示,DE-GRG 主要在黏蛋白O-糖基化生物合成、乳酸和新乳酸生物合成、糖基磷脂酰肌醇的锚定过程等各种类型的糖基化生物合成通路中发挥作用(图1C)。20 个预后相关的DE-GRG 相关性如图1D所示。
2.2 B4GALT5高表达与胰腺癌不良预后正相关
公共数据库TCGA-GTEx中的数据分析显示,与正常胰腺组织相比,B4GALT5在胰腺癌组织中表达升高,且其高表达与不良预后正相关(图2A)。ROC曲线分析显示,1、3、5年OS的AUC值为0.643、0.752和0.877,证明B4GALT5 具有良好的预测能力(图2B)。

图2 B4GALT5的表达与胰腺癌预后的相关性分析Figure 2 Analysis of the correlation between the expression of B4GALT5 and the prognosis of pancreatic cancer
进一步通过定量PCR 检测本中心的60 对癌和癌旁组织中B4GALT5 的表达。这些患者术前均未接受化疗或放疗,在2019—2022年接受了胰十二指肠切除术,并经病理证实为胰腺癌,术后严格随访。总生存期被定义为从手术到死亡或最后一次随访日期的时间。结果显示,与癌旁组织相比,B4GALT5在胰腺癌组织中的表达同样升高(图2C),B4GALT5 高表达的患者预后更差,生存期更短(图2D),与公共数据库研究结果的趋势一致。
TCGA数据库中亚组临床参数生存分析的结果显示,高表达B4GALT5 在不同的TNM、年龄、性别、临床分期组中均能够作为不良预后的显著预测因素(图2E~L)。因此,推测B4GALT5 的高表达可能在胰腺癌恶性演进中有重要作用。
2.3 B4GALT5 表达量与胰腺癌组织中免疫浸润水平的相关性分析
有研究报道肿瘤周围浸润淋巴细胞的差异与胰腺癌恶性演进和不良预后有关,且免疫治疗也是胰腺癌综合治疗方案的重要组成之一[17]。本研究使用在线数据库TIMER(http://timer.comp-genomics.org/)分析B4GALT5 表达与浸润性免疫细胞的关联。分析结果显示,在胰腺癌组织中,B4GALT5 基因的表达水平与B 细胞(r=0.196,P=0.010)、CD8+T细胞(r=0.376,P<0.001)、骨髓来源的抑制性细胞(r=0.265,P<0.001)、中性粒细胞(r=0.439,P<0.001)、巨噬细胞(r=0.260,P<0.001)、肿瘤相关成纤维细胞(r=0.320,P<0.001)、淋巴样祖细胞(r=0.231,P<0.001)、树突状细胞(r=0.427,P<0.001)的浸润水平呈正相关(图3A);与CD4+T 细胞(r=-0.221,P=0.004)、自然杀 伤(natural killer,NK)T 细 胞(r=-0.265,P<0.001)的浸润水平呈负相关(图3B)。
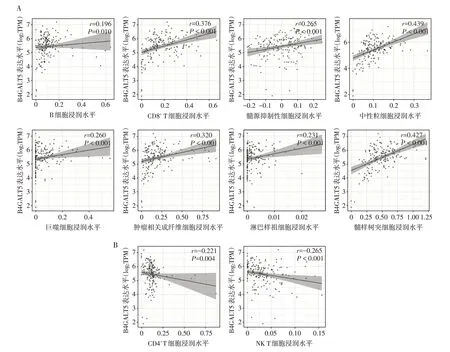
图3 B4GALT5基因表达与免疫细胞浸润的相关性Figure 3 Correlation between B4GALT5 gene expression and immune infiltration
2.4 过表达和敲低B4GALT5 基因的人胰腺癌细胞株的构建
首先,以胰腺正常导管细胞HPNE 为对照,在mRNA 和蛋白两种水平检测4 种人胰腺癌细胞系(BxPC-3、CFPAC-1、MIA PaCa-2、PANC-1)中B4GALT5 表达情况,结果显示:相较于HPNE 细胞,B4GALT5 在胰腺癌细胞系中表达升高(图4A),该变化趋势与前述的胰腺癌组织中的检测结果一致。我们选择其中B4GALT5 表达水平相对较高的CFPAC-1 和MIA PaCa-2 两株胰腺癌细胞系进行后续功能实验。使用过表达质粒和shRNA 质粒转染细胞,48~72 h后进行定量PCR及Western blot实验,结果表明:B4GALT5 干扰及B4GALT5 过表达的稳转细胞株构建成功(图4B~C)。

图4 定量PCR及Western blot检测B4GALT5在胰腺癌细胞亲本株、干扰或过表达后的表达情况Figure 4 B4GALT5 expression in pancreatic cancer parent strains after interference or overexpression detected by qRT-PCR and Western blot
2.5 B4GALT5促进胰腺癌细胞的侵袭和增殖
接下来,基于构建的干扰和过表达B4GALT5的人胰腺癌细胞系,对其在肿瘤进展中发挥的功能进行探究,进行CCK-8 细胞增殖实验。在两种胰腺癌细胞系中,过表达B4GALT5 可以促进胰腺癌细胞增殖,干扰B4GALT5 则抑制胰腺癌细胞增殖(图5A~D)。同时,细胞划痕实验结果表明:与对照组相比,在CFPAC-1 和MIA PaCa-2 两种胰腺癌细胞株中,B4GALT5 过表达均可促进细胞的迁移,相反B4GALT5 干扰抑制细胞的迁移(图5E~F)。Transwell 细胞侵袭实验结果表明:与对照组相比,B4GALT5 过表达组中穿过基质胶的细胞数量显著增加(P<0.01),相反,在B4GALT5干扰组中穿过基质胶的细胞数量相较于对照组显著减少(P<0.05,图5G~H)。以上结果说明B4GALT5 促进胰腺癌细胞的增殖和浸润。

图5 B4GALT5过表达或干扰对胰腺癌细胞增殖、迁移和侵袭能力的影响Figure 5 Effects of B4GALT5 overexpression or interference on proliferation,migration and invasion of pancreatic cancer cells
3 讨论
胰腺癌是消化道高度恶性肿瘤之一,是人类癌症死亡的第三大原因,发病率以每年1.3%的速度增长,起病隐蔽、进展迅速,死亡风险高。胰腺癌预后极差的原因之一是早期缺乏特异性的临床表现,90%的肿瘤在扩散到胰腺外才被诊断出来,就诊时已失去手术切除的机会[18]。异常的糖基化改变被认为是癌症的一个普遍标志。肿瘤细胞与未转化的同类细胞相比,显示出广泛的糖基化改变[19],但胰腺癌中的糖基化研究目前仅集中在血清糖蛋白生物标志物中[20],发现在胰腺癌发生发展中起作用的新的糖基化基因和探索其作用机制,对找到高特异性及敏感性的诊断标志物和靶向治疗具有重要意义[15,21]。
本研究首先通过GGDB网站获得糖基化相关基因,并从TCGA-GTEx联合数据库中检测其在胰腺癌中的差异表达情况。基于单因素Cox 回归分析,确定了20 个与预后相关的DE-GRG 用于进一步研究。进行GO和KEGG分析及相关性分析后,最终聚焦于B4GALT5基因上。与癌旁组织相比,该基因在胰腺癌组织中高表达,风险比在这20 个基因中最高,是胰腺癌发生的高危因素。
B4GALT5是7个β-1,4-半乳糖基转移酶基因之一,于2005年被首次报道[22],B4GALT5和B4GALT6负责乳糖神经酰胺合酶的产生,其在神经节苷脂生物合成的初始步骤中发挥作用[23]。在成熟的3T3-L1 脂肪细胞中,肿瘤坏死因子-α诱导的胰岛素抵抗伴随着糖链结构的各种变化,包括B4GALT5 的表达增加,这表明B4GALT5 也可能参与炎症反应过程[24]。此外,B4GALT5参与N-连接寡糖和各种糖脂的合成,有助于形成高度半乳糖基化的细胞表面蛋白,这些蛋白与胚胎外发育以及宫颈癌[25]和神经胶质瘤[26]的发生有关。近年来,关于B4GALT5的作用机制研究逐渐增加。在乳腺癌中,B4GALT5通过糖基化修饰调节乳腺癌干细胞,以稳定Frizzled-1并激活Wnt/β-catenin 信号,以维持细胞干性[13]。在膀胱癌和肝细胞癌中,B4GALT5可作为致癌基因发挥促癌作用。B4GALT5 较高的mRNA 表达与较差的总生存率相关。体外实验表明,B4GALT5的缺失显著抑制了肝癌细胞的增殖、迁移和侵袭,表明B4GALT5 可能是肝细胞癌的预后生物标志物[14]。使用CDK7 抑制剂可以抑制下游B4GALT5 表达,提高膀胱癌细胞的化疗药物敏感性[27]。此外,B4GALT5 也是几种明星通路的共同下游靶标。circ_0009910可以通过下调急性骨髓性白血病细胞中的miR-491-5p 来激活PI3K/AKT 信号通路,调节B4GALT5的表达[28]。SIRT2在去势抵抗前列腺癌症和神经内分泌前列腺癌症中过表达,并可通过激活ERK1/2通路和上调B4GLAT5来诱导乳糖神经酰胺的产生,促进细胞生长和迁移[29]。
本研究使用2个公共数据库及本中心的胰腺癌组织样本与对应临床数据,进行了包括临床亚组分析在内的多层次统计分析,证明:①与癌旁组织相比,B4GALT5 在胰腺癌组织中高表达,提示后续可以进行血清学检测,验证其是否可以作为生物标志物用于早期诊断;②B4GALT5的表达量增高与胰腺癌不良预后呈显著正相关。B4GALT5 的表达量增高在不同的TNM、年龄、性别、临床分期组中均能够作为不良预后的显著预测因素。进一步,本研究结果还显示B4GALT5 的表达量增高与多种免疫细胞浸润呈正相关,其中包括骨髓来源的抑制性细胞与巨噬细胞,但与CD4+T细胞和NK T细胞浸润呈负相关,提示胰腺癌细胞可能利用B4GALT5与肿瘤微环境中的各种免疫细胞发生复杂的互作关系,后续的深入研究,有可能为胰腺癌的个体化免疫治疗与预后改善带来新思路。此外,通过系列体外功能实验,本研究初步证明B4GALT5 在促进胰腺癌的增殖、运动与浸润功能中发挥重要作用,初步的体内实验结果也和体外实验趋势一致(结果未公布)。总之,虽然本研究找到了影响胰腺癌发生发展的糖基化修饰中发挥关键作用且未曾报道过的糖基转移酶,并初步验证其功能,但是尚未完成系统的体内实验验证与糖基化修饰作用具体机制的阐明,因此,本课题组正在计划开展系统的体内实验与深入的机制研究。
