羟基樟脑调控的氨基酸S/R构型相互转化
2023-07-18余伟董思凡李傲齐崔斌李昊龙秦源韩天佼范士明
余伟 董思凡 李傲齐 崔斌 李昊龙 秦源 韩天佼 范士明

摘 要:為解决当前通过纯化学法进行氨基酸S/R构型转化中存在的手性分子结构复杂、分子质量大以及耗费等当量重金属盐的问题,提出一种利用结构简单的2-羟基樟脑和3-羟基樟脑进行氨基酸S/R构型转化的新方法。通过对碱、溶剂和反应温度的筛选,建立最优反应体系,然后对不同侧链的外消旋以及光学纯氨基酸的构型转化进行研究。结果表明,以叔丁醇钾为碱,异丙醇为溶剂,在40 ℃下反应获得最佳转化效果,其能够兼容具有不同芳环和脂肪侧链的氨基酸,高效进行氨基酸S/R构型的相互转化,展现出优秀的立体选择性,且羟基樟脑可循环利用;机理分析表明,拆分的高立体选择性由热力学控制。新方法所用手性试剂结构简单并可循环使用,无需将氨基酸合成特定的反应底物,反应转化率和立体选择性高,为氨基酸纯化学S/R构型转化提供了一种新的途径。
关键词:有机合成化学;构型转化;氨基酸;樟脑;手性
中图分类号:O621.25
文献标识码:A DOI:10.7535/hbkd.2023yx03007
收稿日期:2022-06-26;修回日期:2023-04-28;责任编辑:王淑霞
基金项目:国家自然科学基金(21978067);河北省自然科学基金(H2020208030)
第一作者简介:余 伟(1986—),男,陕西商南人,硕士研究生,主要从事氨基酸和甾体化合物的不对称合成方面的研究。
通信作者:韩天佼工程师。E-mail: hantianjiao_2005@126.com
范士明博士。E-mail: fanshiming@hebust.edu.cn
Hydroxycamphor-controlled S/R interconversion of amino acids
YU Wei1,2, DONG Sifan1,3, LI Aoqi1,3, CUI Bin1,3, LI Haolong1,3, QIN Yuan1,3HAN Tianjiao4, FAN Shiming1,3
(1.Laboratory Breeding Base-Hebei Province Key Laboratory of Molecular Chemistry for Drug, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2.Hebei Grand Jiufu Biotechnology Company Limited, Baoding, Hebei 072150, China; 3.Hebei University of Science and Technology,Shijiazhuang,Hebei 050018,China;4.School of Chemical and Pharmaceutical Engineering,NCPC New Preparation Branch Factory, Shijiazhuang, Hebei 052160, China)
Abstract:In order to overcome the problems of complex chiral molecular structure, high molecular weight and consumption of equivalent heavy metal salts in purely chemical S/R interconversion of amino acids, a novel method for S/R interconversion of amino acids was developed by using structurally simple 2-hydroxycamphor or 3-hydroxycamphor. The reaction conditions were optimized by assessing the base, solvent and reaction temperature. Then the S/R interconversion of racemic and enantiopure amino acids with different side chains were carried out. The result shows that the best interconversion effect is obtained at 40 ℃ with potassium tert-butoxide as the base and isopropanol as the solvent. Various amino acids with fatty and aromatic side chains are well tolerated in the reactions and the S/R interconversion of amino acids can be carried out efficiently, showing excellent stereoselectivities, and the hydroxycamphors can be reused. The mechanism study shows that the high stereoselectivity of dynamic resolution is thermodynamically controlled. This method has the advantages of using structurally simple and recyclable chiral reagents, avoiding the synthesis of specific substrates from amino acids and giving good reaction conversions and stereoselectivity, which provides a novel approach for purely chemical S/R-interconversion of amino acids.
Keywords:organic synthetic chemistry; configuration inversion; amino acids; camphor; chirality
手性是氨基酸的基本特征之一,根据α-手性碳原子的构型不同,分为L-(S)-氨基酸和D-(R)-氨基酸。氨基酸的手性在药物研发和不对称合成领域发挥着重要作用。在药物研发中,不同构型氨基酸对药物分子的生物活性影响非常大[1-2]。在合成方面,手性氨基酸是手性药物和多肽分子合成的重要中间体[3-7],也是金属催化不对称合成反应中一类非常重要的配体[8]。近几年,手性氨基酸作为瞬态导向基团在不对称C—H活化领域也展现出巨大潜力[9]。鉴于手性氨基酸的广泛应用,其合成方法一直受到极大关注。氨基酸α-C原子构型的定向转化是产生手性氨基酸的一种重要方法。通过构型转化能够将外消旋体氨基酸中其中一个构型的氨基酸定向转化成相反构型的氨基酸,从而获得单一构型的产物。此外,天然的L-氨基酸可经生物发酵大规模生产,价格较低,因此通过构型转化将廉价易得的L-氨基酸转化成昂贵的非天然D-氨基酸展现出了重大的合成价值。迄今为止,关于氨基酸S/R构型相互转化的方法仍然较为有限,包括生物催化转化和纯化学转化方法。对于生物转化法,往往面临着相关酶的来源受限問题,且需要先将氨基酸制备成适合酶反应的特定底物[10-13]。通过纯化学方法利用手性小分子模拟酶实现氨基酸构型转化最近获得极大关注,相比于生物法,化学法所使用的手性分子可通过合成大量获得,并且对氨基酸底物的兼容性高,尤其是一些非蛋白编码的特殊氨基酸也能有很好的反应[14-21]。然而此方法仍然面临着手性分子分子量大、结构较为复杂、合成困难或者需要等当量的重金属参与等问题,因此开发简单的手性分子实现高效的氨基酸构型转化是一个具有较大挑战和亟待解决的问题。
樟脑类化合物由于特有的刚性环状结构、广泛的来源和低廉的价格引发了人们极大关注[22-23]。本研究开发了一种利用2-羟基樟脑和3-羟基樟脑对光学纯氨基酸进行了S/R构型的相互转化的新方法,方案如下:3-羟基樟脑A与苄氧羰基(Cbz)保护的(S)-氨基酸(S)-1通过成酯键连接,随后在钯碳/氢气条件下的碱性质子溶液中进行一锅法反应,经氢解脱除保护基、环合形成亚胺、α-C构型翻转的连续反应得到(R)-构型的三环亚胺内酯3,随后水解得到(R)-氨基酸(R)-1;反之使用2-羟基樟脑B,可将(R)-氨基酸转化成(S)-氨基酸(见图1)。利用这种方案,本文首先以羟基樟脑将外消旋氨基酸转化成单一构型(S)-或(R)-氨基酸,然后进一步研究羟基樟脑对光学纯氨基酸S/R构型的相互转化效果。
1 实验部分
1.1 试剂与仪器
氨基酸,购自上海吉尔生化有限公司;四氢呋喃、乙酸乙酯、石油醚、异丙醇、浓盐酸,均为分析纯,购自国药试剂有限公司;2-羟基樟脑和3-羟基樟脑,购自上海陶术生物技术有限公司;所用其他试剂,购自北京百灵威科技有限公司。
戴安UltiMate-3000高效液相色谱,购自美国DIONEX公司;Bruker AV-500 MHz型核磁共振仪,购自德国 Bruker公司;Advion质谱仪,购自美国ADVION公司;X-4型数字显示显微熔点测定仪,购自北京泰克仪器有限公司;Biotage快速制备色谱仪,购自瑞典Biotage公司;恒温水浴锅,购自河南巩义予华仪器有限公司。
1.2 实验方法
将2-羟基樟脑(或3-羟基樟脑) (10 mmol),N-Cbz-氨基酸(11 mmol),4-二甲氨基吡啶(DMAP) (0.6 g,5 mmol)溶于40 mL四氢呋喃,在0 ℃下搅拌15 min后,将二环己基碳二亚胺(DCC) (3.1 g,15 mmol)的四氢呋喃(10 mL)溶液滴加到反应液中,0 ℃下搅拌2 h后升至室温,搅拌16 h。过滤、减压浓缩,硅胶柱层析(乙酸乙酯与石油醚体积比为1∶8)得到酯。将上述反应得到的酯、5% Pd/C(0.50 g)、叔丁醇钾(t-BuOK)(224 mg,2 mmol)溶于40 mL异丙醇(i-PrOH),加入干燥的4 分子筛,在常压下通入氢气,40 ℃反应15 h。过滤、浓缩,硅胶柱层析(乙酸乙酯与石油醚体积比为1∶4)得到单一构型的环合产物三环亚胺内酯。
(1R,2S,5S,8S)-5-苄基-1,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳6-烯-4-酮(5a):白色固体,熔点68~ 70 ℃ (Ref.[23]68 ~70 ℃);1H NMR (500 MHz, Chloroform-d)δ7.37(d,J=8.2 Hz, 2H),7.30(t,J=7.5 Hz, 2H),7.24~7.20(m,1H),4.27 (s,1H),3.95 (ddd,J=8.3,4.7,1.4 Hz,1H),3.56(dd,J=14.4,4.7 Hz,1H),3.24 (dd,J=14.5,8.4 Hz,1H),2.43(d,J=4.4 Hz,1H),1.97 (ddt,J=12.6,8.2,4.1 Hz,1H),1.88 (td,J=12.5,4.6 Hz,1H),1.59~1.49 (m,1H),1.35 (ddd,J=13.1,9.3,3.6 Hz,1H),1.08 (s,3H),0.95 (s,3H),0.80 (s,3H)。13C NMR (126 MHz,Chloroform-d)δ181.6,170.6,138.9,129.7,128.4,126.5,81.9,62.8,53.1,37.4,34,0,21.8,20.2,19.5,10.1。HRMS (ESI) calcd for C19H24NO2[M+H]+298.180 2,found 298.181 1。
(1S,2R,5R,8R)-5-芐基-8,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳6-烯-4-酮(3a):白色固体,熔点122~124 ℃(Ref.[23]122~124 ℃);1H NMR (500 MHz,Chloroform-d)δ7.47 ~ 7.37 (m,2H),7.29 (t,J=7.6 Hz,2H),7.24 ~ 7.17 (m,1H),4.43 (d,J=1.5 Hz,1H),3.94 (ddd,J=7.1,5.2,1.5 Hz,1H),3.52 (dd,J=14.1,5.2 Hz,1H),3.29 (dd,J=14.1,7.6 Hz,1H),2.23 (d,J=4.9 Hz,1H),2.10~1.99(m,1H),1.74 (ddd,J=13.4,12.0,4.0 Hz,1H),1.58~1.50(m,1H),1.32(td,J=9.2,4.6 Hz,1H),1.04 (s,3H),0.95 (s,3H),0.71 (s,3H)。 13C NMR (126 MHz,Methanol-d4)δ 183.8,171.6,129.5,127.6,125.9,77.60,62.0,52.3,36.8,29.2,24.5,18.9,18.7,8.9。HRMS (ESI) calcd for C19H24NO2[M+H]+298.180 2,found 298.181 5。
(1R,2S,5S,8S)-5-对溴苄基-1,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳-6-烯-4-酮(5b):白色固体,熔点147~ 150 ℃;1H NMR (500 MHz,Chloroform-d) δ 7.41 (d,J=8.3 Hz,2H),7.25 (d,J=8.4 Hz,2H),4.27 (d,J=1.5 Hz,1H),3.91 (ddd,J=8.4,4.7,1.5 Hz,1H),3.47 (dd,J=14.4,4.7 Hz,1H),3.19 (dd,J=14.4,8.3 Hz,1H),2.42 (d,J=4.5 Hz,1H),1.98 (ddt,J=12.7,8.2,4.1 Hz,1H),1.88 (td,J=12.5,4.6 Hz,1H),1.53(ddd,J=13.3,9.2,4.6 Hz,1H),1.35 (ddd,J=13.1,9.2,3.7 Hz,1H),1.07 (s,3H),0.95 (s,3H),0.78 (s,3H)。 13C NMR (126 MHz,Chloroform-d) δ 181.8,170.3,137.6,131.5,131.4,81.8,62.2,53.1,49.4,49.1,36.7,33.9,21.7,20.1,19.4,10.0。HRMS (ESI) calcd for C19H23BrNO2[M+H]+376.090 7,found 376.091 5。
(1S,2R,5R,8R)-5-对溴苄基-8,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳-6-烯-4-酮(3b):白色固体,熔点165 ~ 166 ℃; 1H NMR (500 MHz,Chloroform-d) δ 7.40 (d,J=8.4 Hz,2H),7.28 (d,J= 8.4 Hz,2H),4.43 (d,J=1.5 Hz,1H),3.91 (ddd,J=7.0,5.1,1.6 Hz,1H),3.44 (dd,J=14.1,5.1 Hz,1H),3.24 (dd,J=14.2,7.4 Hz,1H),2.23 (d,J=4.8 Hz,1H),2.02 (dt,J=12.0,4.9 Hz,1H),1.75 (td,J=12.8,12.3,4.0 Hz,1H),1.55 (d,J=4.6 Hz,1H),1.46 (td,J=9.1,4.7 Hz,1H),1.03 (s,3H),0.99 (s,3H),0.68 (s,3H)。13C NMR (126 MHz,Chloroform-d) δ 182.9,170.5,137.6,131.9,131.1,120.4,62.0,49.2,47.4,36.8,29.7,25.3,20.0,19.6,9.9. HRMS (ESI) calcd for C19H23BrNO2[M+H]+376.090 7,found 376.091 8。
(1R,2S,5S,8S)-1,5,11,11-四甲基-3-氧-6-氮杂三环-[6.2.1.02,7]十一碳-6-烯-4-酮(5c):白色固体,熔点160 ~162 ℃(Ref.[24]161~162 ℃);1H NMR (500 MHz,Chloroform-d) δ 4.32 (d,J=1.5 Hz,1H),3.83 (qd,J=7.1,1.5 Hz,1H),2.42 (d,J=4.5 Hz,1H),2.02 (tt,J=12.8,4.3 Hz,1H),1.91 (td,J=12.6,4.7 Hz,1H),1.66 (d,J=7.0 Hz,3H),1.56 (ddd,J=13.4,9.2,4.7 Hz,1H),1.42~1.38 (m,1H),1.09 (s,3H),0.96 (s,3H),0.83 (s,3H)。13C NMR (126 MHz,Chloroform-d) δ 181.7,171.6,82.0,56.8,53.1,49.4,49.1,34.0,21.8,20.1,19.4,17.4,10.1。HRMS (ESI) calcd for C13H20NO2[M+H]+222.148 9,found 222.148 0。
(1S,2R,5R,8R)-5,8,11,11-四甲基-3-氧-6-氮杂三环-[6.2.1.02,7]十一碳-6-烯-4-酮(3c):白色固体,熔点85~87 ℃(Ref.[25]85 ~ 87 ℃);1H NMR (500 MHz,Chloroform-d) δ 4.65~4.59 (m,1H),4.57 (s,1H),2.23 (d,J=4.8 Hz,1H),2.06 (ddd,J=12.5,9.0,5.3 Hz,1H),1.76 (td,J=12.7,12.3,3.8 Hz,1H),1.56 (ddd,J=13.9,9.2,5.3 Hz,1H),1.43 (d,J=7.6 Hz,3H),1.36 (ddd,J=13.1,9.2,3.8 Hz,1H),1.04 (s,3H),0.96 (s,3H),0.80 (s,3H)。13C NMR (126 MHz,Chloroform-d) δ 182.8,171.6,79.6,56.8,52.5,49.1,47.2,29.4,25.3,20.1,19.6,17.3,10.1。HRMS (ESI) calcd for C13H20NO2[M+H]+222.148 9,found 222.148 2。
(1R,2S,5S,8S)-5-正丙基-1,11,11-三甲基-3-氧-6-氮杂三环[6.2.1..02,7]十一碳-6-烯-4-酮(5d):无色油状液体,1H NMR (500 MHz,Chloroform-d) δ 4.29 (d,J=1.0 Hz,1H),3.75~3.78(m,1H),2.87~2.92 (m,1H),2.70~2.76 (m,1H),2.46 (d,J=4.5 Hz,1H),1.97~2.03 (m,1H),1.86~1.92 (m,1H),1.53~1.59 (m,3H),1.35~1.40 (m,1H),1.15(t,J=7.2 Hz,3H),1.08 (s,3H),0.95 (s,3H),0.82 (s,3H)。13C NMR (126 MHz,Chloroform-d) δ 182.0,170.5,81.8,61.0,53.2,49.5,49.1,35.5,34.0,21.81,20.2,19.5,17.5,13.8,10.1. HRMS (ESI) calcd for C15H24NO2[M+H]+250.180 2,found 250.180 5。
(1S,2R,5R,8R)-5-正丙基-8,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳-6-烯-4-酮(3d):白色固体,熔点76~78 ℃;1H NMR (500 MHz,Chloroform-d) δ 4.47 (d,J=1.4 Hz,1H),3.77 (ddd,J=7.1,5.6,1.5 Hz,1H),2.96~2.84 (m,1H),2.82~2.70 (m,1H),2.25 (d,J=4.9 Hz,1H),2.14~1.98 (m,1H),1.77 (ddd,J=13.5,12.0,4.1 Hz,1H),1.52~1.58 (m,3H),1.36 (td,J=9.2,4.7 Hz,1H),1.17 (t,J=7.2 Hz,3H),1.05 (s,3H),0.96 (s,4H),0.76 (s,3H)。13C NMR (126 MHz,Chloroform-d) δ 183.4,170.8,79.7,61.2,52.6,49.2,47.5,35.6,29.7,25.4,20.2,19.9,17.8,13.6,10.1。HRMS (ESI) calcd for C15H24NO2[M+H]+250.180 2,found 250.180 1。
(1R,2S,5S,8S)-5-(S)-仲丁基-1,11,11-三甲基-3-氧-6-氮雜三环[6.2.1.02,7]十一碳-6-烯-4-酮(5e):白色固体,熔点130 ~ 132 ℃;1H NMR (500 MHz,Chloroform-d) δ 4.57 (d,J=1.0 Hz,1H),3.64 (s,1H),2.59 (d,J=4.5 Hz,1H),2.33~2.20 (m,1H),2.06 (ddd,J=12.3,7.3,5.0 Hz,1H),1.80 (ddd,J=14.0,9.4,5.0 Hz,1H),1.62~1.52 (m,2H),1.47~1.39 (m33,1H),1.33 (td,J=9.2,4.7 Hz,1H),1.10 (s,3H),1.02~0.93(m,12H)。13C NMR (126 MHz,Chloroform-d) δ 182.1,172.0,81.7,63.3,53.9,50.7,46.1,35.7,28.9,26.4,25.6,19.7,18.4,14.6,13.0,12.1。HRMS (ESI) calcd for C16H26NO2[ M+H]+264.195 8,found 264.195 1。
(1S,2R,5R,8R)-5-(S)-仲丁基-8,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳-6-烯-4-酮(3e):白色固体,熔点81~83 ℃;1H NMR (500 MHz,Chloroform-d) δ 4.89 (d,J=8.0 Hz,1H),4.50 (d,J=7.0 Hz,1H),2.05~2.04 (q,J=6.9 Hz,1H),1.79~1.58 (m,2H),1.36~1.24 (m,3H),1.29~1.16 (m,1H),1.21~1.06 (m,1H),0.98 (d,J=6.8 Hz,3H),0.92~0.89 (m,9H),0.85 (s,3H)。13C NMR (126 MHz,Chloroform-d) δ 176.1,170.0,72.1,68.8,53.6,51.0,45.9,36.4,32.7,24.9,20.9,17.6,16.5,15.9,10.1。HRMS (ESI) calcd for C16H26NO2[ M+H]+264.195 8,found 264.194 6。
(1R,2S,5S,8S)-5-异丁基-1,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳-6-烯-4-酮(5f):白色固体,熔点135~137 ℃;1H NMR (500 MHz,Chloroform-d) δ 4.32 (s,1H),3.72~3.58 (m,1H),2.47 (d,J=4.5Hz,1H),2.10~1.80 (m,4H),1.62~1.58 (m,1H),1.48~1.29 (m,2H),1.09 (s,3H),1.01~0.92 (m,9H),0.82 (s,3H)。 13C NMR (126 MHz,Chloroform-d) δ 181.1,170.2,81.4,65.5,53.4,49.4,48.9,34.1,29.1,21.8,20.1,19.8,19.5,17.2,13.7,10.1。HRMS (ESI) calcd for C16H26NO2[ M+H]+264.195 8,found 264.195 4。
(1S,2R,5R,8R)-5-异丁基-8,11,11-三甲基-3-氧-6-氮杂三环[6.2.1.02,7]十一碳-6-烯-4-酮(3f):白色固体,熔点92~93 ℃;1H NMR (500 MHz,Chloroform-d) δ 4.94 (d,J=7.0 Hz,1H),4.81~4.69 (m,1H),2.01 (q,J=6.5 Hz,1H),1.78~1.68 (m,1H),1.55~1.42 (m,2H),1.39~1.36 (m,1H),1.35~1.18 (m,3H),0.98~0.81 (m,15H)。13C NMR (126 MHz,Chloroform-d) δ 172.9,168.7,75.2,58.3,53.9,53.0,47.6,43.7,32.5,26.8,24.0,21.2,20.1,11.2。HRMS (ESI) calcd for C16H26NO2[ M+H]+264.195 8,found 264.195 1。
环合产物(4 mmol)溶解在4 mol/L HCl (2 mL)中,加热到85 ℃反应2 h,冷却后加入蒸馏水(2.0 mL),乙醚萃取,对乙醚层进行浓缩得到羟基樟脑。水层用浓氨水调节pH值至7,减压浓缩后用反相制备色谱纯化(C8柱,MeOH/water,1/9),浓缩得到氨基酸产物。
(S)-苯丙氨酸(6a):白色固体,产率87%,271~275 ℃(dec.)( Ref.[26]262~276 ℃(dec.));1H NMR (500 MHz,Deuterium Oxide) δ 7.35 (t,J=7.5 Hz,2H),7.33~7.28 (m,1H),7.25 (d,J=7.2 Hz,2H),3.95~3.88 (m,1H),3.22 (dd,J=14.5,5.2 Hz,1H),3.05 (dd,J=14.5,8.0 Hz,1H)。通過手性HPLC检测氨基酸光学纯度,色谱柱:大赛璐CROWNPAK CR(+);流动相:高氯酸(HClO4)水溶液(pH值为2)∶甲醇=9∶1;柱温:5 ℃;流速:0.5 mL/min;检测波长:254 nm;保留时间13.3 min。
(R)-苯丙氨酸(7a):白色固体,产率90%,271~275 ℃(dec.)。光学纯度检测方法同6a,保留时间:8.9 min。
(S)-对溴苯丙氨酸(6b): 白色固体,产率88%,261~263 ℃(dec.)(Ref.[27]260.5~262 ℃(dec.));1H NMR(500 MHz,Deuterium Oxide)δ 7.34 (d,J=8.4 Hz,2H),7.06 (d,J=8.4 Hz,2H),3.31 (dd,J=7.2,5.8 Hz,1H),2.78 (dd,J=13.6,5.8 Hz,1H),2.66 (dd,J=13.6,7.2 Hz,1H)。通过手性HPLC检测氨基酸光学纯度。色谱柱:大赛璐CROWNPAK CR(+),流动相:高氯酸(HClO4)水溶液(pH值为2):甲醇=9∶ 1,柱温:5 ℃,流速:1 mL/min,检测波长:254 nm,保留时间:22.7 min。
(R)-对溴苯丙氨酸(7b): 白色固体,产率91%,261~263 ℃(dec.)。光学纯度检测方法同6b,保留时间:17.6 min。
3-羟基樟脑A:白色固体,熔点166~168 ℃(Ref.[25]166~168 ℃);1H NMR(500 MHz,Methanol-d4)δ 3.69 (s,1H),2.07~1.96 (m,2H),1.73~1.65 (m,1H),1.42~1.35 (m,2H),0.98 (s,3H),0.96 (s,3H),0.89 (s,3H).
2-羟基樟脑B: 白色固体,熔点218~220 ℃(Ref.[24]218~220 ℃);1H NMR (500 MHz,Chloroform-d) δ 3.53 (s,1H),2.50 (d,J=2.6 Hz,1H),2.17 (d,J=4.9 Hz,1H),1.97~1.79(m,2H),1.53~1.33(m,2H),1.04 (s,3H),1.02 (s,3H),0.93 (s,3H)。
2 结果与讨论
2.1 反应条件优化
以2-羟基樟脑B对外消旋苯丙氨酸构型转化作为模板反应进行条件筛选。将外消旋氨基酸与羟基樟脑的羟基进行酯化反应合成4a,对氨基保护基进行筛选,对苄氧羰基(Cbz)、叔丁氧羰基(Boc)、笏甲氧羰基(Fmoc)进行考察,以DCC为缩合剂进行反应。结果表明,相比于Boc和Fmoc,Cbz的空间位阻小,更容易反应,产率分别为72%,66%,95%。
获得酯化产物后对构型转化条件进行筛选,反应在碱性醇溶剂和氢气条件下进行。反应过程为:氢解脱除Cbz保护基,暴露出来的氨基与羟基樟脑的羰基自发反应生成亚胺键,形成六元环结构后在碱性条件下发生动态拆分,氨基酸α-C构型定向转化,获得exo构型的三环亚胺内酯产物5a,反应式见图2。
为获得理想的反应结果,考察了碱、溶剂和温度对反应的影响,结果见表1。当以K2CO3为碱,乙醇为溶剂时,构型转化效果较差,exo和endo产物的比例几乎相同(见表1,编号1)。使用Cs2CO3时,立体选择性略有提高(见表1,编号2)。使用强碱乙醇钠时,exo产物比例大大提高,但产率降低,经检测发现反应中产生的乙氧基负离子容易与亚胺键发生亲核加成反应(见表1,编号3)。当改用位阻较大的叔丁醇钾为碱,异丙醇为溶剂时,发现随着反应温度的升高,不仅提高了环合产率,更为重要的是,exo构型的产物占比迅速上升(见表1,编号4—编号7),最佳反应条件为升高温度至40 ℃时,产率为85%,dr> 99∶1,获得光学纯的exo产物(见表1,编号7)。
2.2 外消旋氨基酸底物拓展
为了验证此方法的可行性,对反应底物进行拓展实验,反应通式见图3。
基于上述最佳反应条件,利用羟基樟脑对含有不同側链的外消旋氨基酸的构型转化进行了考察,包括外消旋的苯丙氨酸、对溴苯丙氨酸、丙氨酸、戊氨酸和异亮氨酸,结果如表2所示。
由表2可知,当使用2-羟基樟脑(B)时,与外消旋的氨基酸反应生成三环亚胺内酯5,氨基酸α-C转化为S构型;当使用3-羟基樟脑(A)时,则生成三环亚胺内酯3,氨基酸α-C构型转化为(R)。对于侧链中含有芳香环的苯丙氨酸和对溴苯丙氨酸,表现出了极为优秀的立体选择性,dr>99∶1 (见表2,编号1—编号4)。当氨基酸侧链为脂肪链时,同样表现出良好的转化效果,且随着烷烃侧链的增大,立体选择性增高(见表2,编号5—编号10)。以2-羟基樟脑(B)作为手性试剂时反应产率略高于3-羟基樟脑(A)的反应,可能是由于3-羟基樟脑与氨基酸生成CN键时受相邻樟脑上甲基的空间位阻影响导致的。对于氨基酸β-C无取代基的氨基酸,反应获得了较高的产率,而对于β-C有取代基的异亮氨酸,受β-甲基的空间位阻作用影响环合,需升高反应温度以获得较高产率(见表2,编号9—编号10)。
由表3可知,3-羟基樟脑A能高效地将(S)-氨基酸α-C立体选择性地转化成R构型,2-羟基樟脑B能将(R)-氨基酸α-C立体选择性地转化成S构型,展现出了极佳的立体转化能力,dr>96∶4。
2.4 羟基樟脑的回收和手性氨基酸的生成
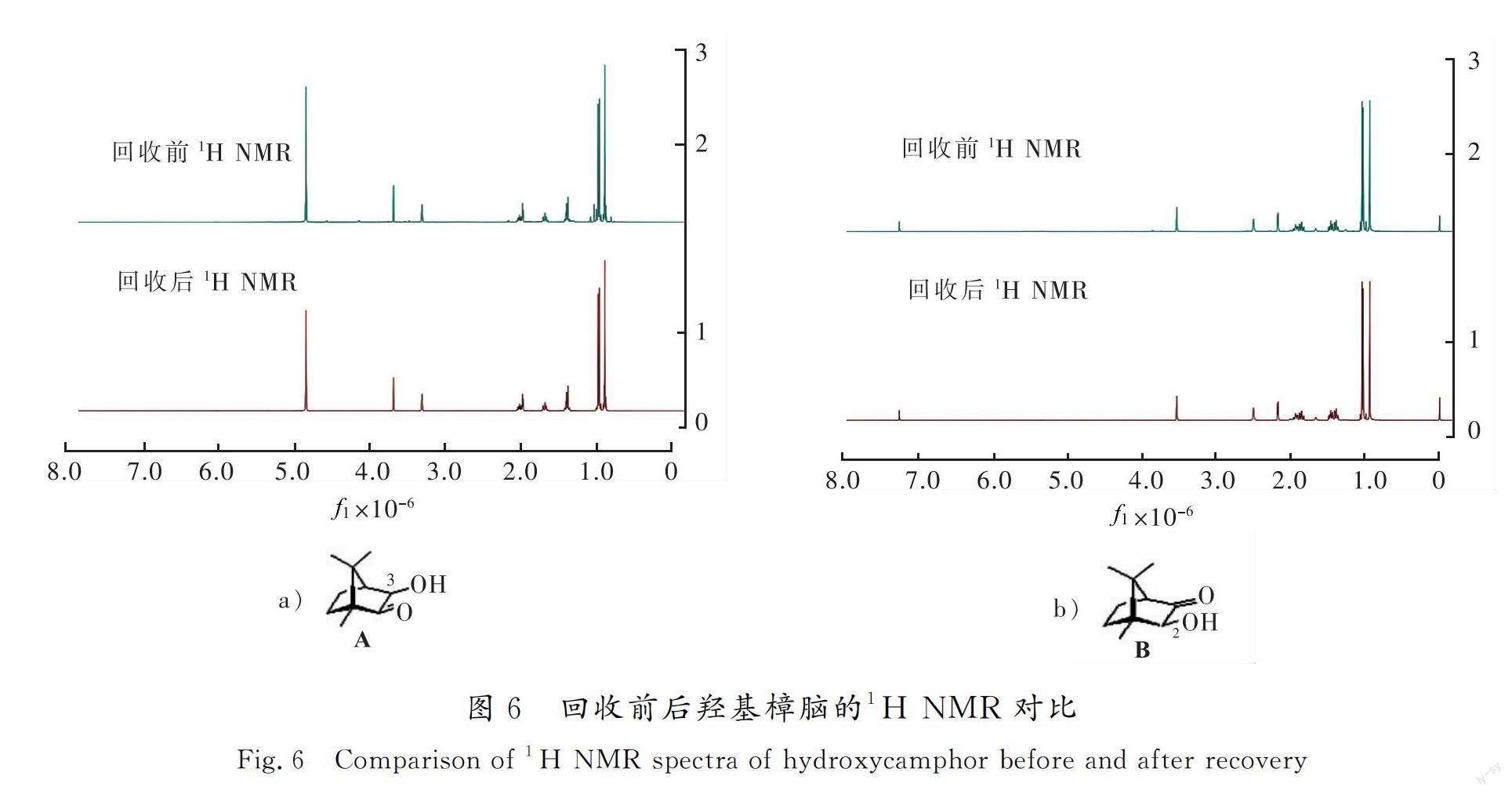
获得的三环亚胺内酯在盐酸条件下水解可得到氨基酸产物和羟基樟脑[23],为考察水解后羟基樟脑能否被回收利用以及酸解条件对氨基酸的光学纯度影响,选择了5a,3a,5b,3b在4 mol/L盐酸中水解,反应式见图5。
反应结果如表4所示,水解后获得光学纯氨基酸(ee≥97.8%)。羟基樟脑经有机溶剂萃取回收,经NMR检测发现结构未发生改变(见图6)。利用回收的羟基樟脑经过3次的循环使用拆分苯丙氨酸,无论3-羟基樟脑还是2-羟基樟脑,拆分效果在产率和立体选择性上均没有发生变化。
2.5 反应机理探讨
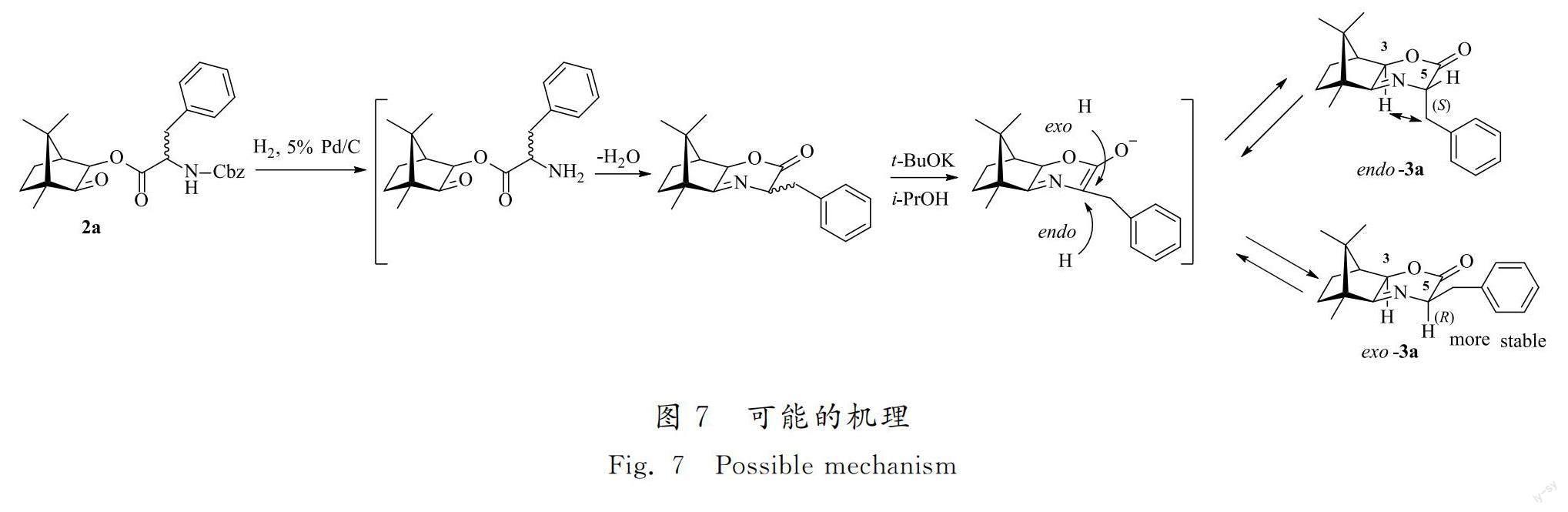
基于上述实验结果,提出了该反应的可能机理。以3-羟基樟脑对外消旋苯丙氨酸的构型转化为例,2a经氢解脱除Cbz、环合,在碱的作用下氨基酸α-C失去质子形成烯醇负离子结构,由sp3杂化碳转化成平面的sp2杂化。随后,由溶剂醇提供氢质子重新转化成sp3杂化碳,在质子转移过程中,质子可以从三环亚胺内酯的endo侧或exo侧反应(见图 7)。从反应动力学角度看,三环亚胺内酯的endo侧位阻小,容易反应,因此应主要生成exo产物,但反应位点α-C距离樟脑有一定空间距离,且氢的体积较小,反应时仍有部分氢从exo侧反应得到endo产物,导致立体选择性并不十分理想(见表1,编号4)。而当升高温度后则高选择性地转化为exo产物(见表1,编号5—编号7)。在三环亚胺内酯产物中,3号和5号碳原子所在六元环为船式构象,C3的氢原子和C5上的苄基处在船头和船尾的位置,对于endo产物,C3的氢原子和C5上的苄基处在同侧,相对距离近,苄基的体积较大,导致产生斥力较大,造成endo产物能量较高;而exo产物中氢原子和苄基距离较远,分子相对稳定[23]。因此反应在较高温度下为热力学控制,使得endo产物朝向exo产物的方向转移。尽管动力学和热力学反应方向一致,均倾向生成exo产物,但反应温度较高,热力学控制条件下给出更优的立体选择性。
3 结 论
本研究开发了一种利用羟基樟脑对外消旋氨基酸以及光学纯氨基酸S/R构型相互转化的新方法,所用拆分剂结构简单且可循环利用,立体选择性高,具体结论如下。
1)以外消旋苯丙氨酸的构型转化为模型反应,建立了最优的反应条件:叔丁醇钾为碱,异丙醇为溶剂,反应温度为40 ℃。拓展了反应底物,对于含有不同结构侧链的氨基酸,选择使用2-羟基樟脑或者3-羟基樟脑,获得光学纯(S)-氨基酸对映体和光学纯(R)-氨基酸对映体,展现出了优秀的立体选择性,dr ≥ 96∶4。
2)进行了光学纯氨基酸S/R构型的相互转化,3-羟基樟脑能高效地将(S)-氨基酸α-C立体选择性地转化成R构型,反之2-羟基樟脑能将(R)-氨基酸α-C立体选择性地转化成S构型。
3)构型转化后获得的亚胺内酯化合物经简单的盐酸水解,可得到光学纯的目标氨基酸,羟基樟脑经萃取回收后可循环利用。
4)结合实验结果提出了可能的反应机理,反应的高立体选择性由热力学控制。
本方法研究了侧链含芳基和脂肪烷基的氨基酸构型转化,对其他类型的氨基酸进行拓展是下一步需要完善的工作。
参考文献/References:
[1] SELLERS R P,ALEXANDER L D,JOHNSON V A,et al.Design and synthesis of hsp90 inhibitors: Exploring the SAR of sansalvamide a derivatives[J].Bioorganic & Medicinal Chemistry,2010,18(18):6822-6856.
[2] SUN Haixia,CHEN Daoyuan,ZHAN Siyue,et al.Design and discovery of natural cyclopeptide skeleton based programmed death ligand 1 inhibitor as immune modulator for cancer therapy[J].Journal of Medicinal Chemistry,2020,63(19):11286-11301.
[3] 甄小丽,李晓浩,张阳.含非对称苝二酰亚胺侧链多肽的合成[J].河北科技大学学报,2018,39(2):149-153.
ZHEN Xiaoli,LI Xiaohao,ZHANG Yang.Synthesis of polypeptides with asymmetric perylene diimide side chains[J].Journal of Hebei University of Science and Technology,2018,39(2):149-153.
[4] 任涵,李茹祥,陳志坚,等.自组装多肽的修饰方法及其应用[J].有机化学,2021,41(10):3983-3994.
REN Han,LI Ruxiang,CHEN Zhijian,et al.Modification methods and applications of self-assembly peptides[J]. Chinese Journal of Organic Chemistry,2021,41(10):3983-3994.
[5] KURNIA D Y,MAHARANI R,HIDAYAT A T,et al.Total synthesis of xylapeptide B[Cyclo-(L-Leu-L-Pro-N-Me-Phe-L-Val-D-Ala)][J].Journal of Heterocyclic Chemistry,2022,59(1):131-136.
[6] D′ANGELO K A,SCHISSEL C K,PENTELUTE B L,et al.Total synthesis of himastatin[J].Science, 2022,375(6583):894-899.
[7] 李雷,叶荣魁,张辉.左乙拉西坦的合成工艺研究[J].辽宁化工,2014,43(9):1134-1135.
LI Lei,YE Rongkui,ZHANG Hui.Research on synthesis technology of levetiracetam[J].Liaoning Chemical Industry,2014,43(9):1134-1135.
[8] LIU Xiaohua,DONG Shunxi,LIN Lili,et al.Chiral amino acids-derived catalysts and ligands[J].Chinese Journal of Chemistry,2018,36(9):791-797.
[9] BAG D,VERMA P K,SAWANT S D.Chiral transient directing group strategies in asymmetric synthesis[J].Chemistry, an Asian Journal,2020,15(20):3225-3238.
[10]BAXTER S,ROYER S,GROGAN G,et al.An improved racemase/acylase biotransformation for the preparation of enantiomerically pure amino acids[J].Journal of the American Chemical Society,2012,134(47):19310-19313.
[11]SUMIDA Yo sue,IWAI S,NISHIYA Y,et al.Identification and characterization of D-succinylase, and a proposed enzymatic method for D-amino acid synthesis[J].Advanced Synthesis and Catalysis,2016, 358(13):2041-2046.
[12]de CESARE S,CAMPOPIANO D J.The N-acetyl amino acid racemases (NAAARs),native and evolved biocatalysts applied to the synthesis of canonical and non-canonical amino acids[J].Current Opinion in Biotechnology,2021,69:212-220.
[13]SUMIDA Y,YAMASAKI M,NISHIYA Y,et al.Protein engineering of D-succinylase from cupriavidus sp.for D-amino acid synthesis and the structural implications[J].Advanced Synthesis & Catalysis,2021, 363(20):4770-4778.
[14]NIAN Yong,WANG Jiang,ZHOU Shengbin,et al.Purely chemical approach for preparation of d-α-amino acids via(S)-to-(R)-interconversion of unprotected tailor-made α-amino acids[J].Journal of Organic Chemistry,2016, 81(9):3501-3508.
[15]SO S M,MOOZEH K,LOUGH A J,et al.Highly stereoselective recognition and deracemization of amino acids by supramolecular self-assembly[J].Angewandte Chemie,2014,126(3):848-851.
[16]PARK H,KIM K M,LEE A,et al.Bioinspired chemical inversion of L-amino acids to D-amino acids[J].Journal of the American Chemical Society,2007,129(6):1518-1519.
[17]MANDAI H,HONGO K,FUJIWARA T,et al.Dynamic kinetic resolution of azlactones by a chiral N,N-dimethyl-4-aminopyridine derivative containing a 1,1′-Binaphthyl unit:importance of amide groups[J]. Organic Letters,2018,20(16):4811-4814.
[18]XIE Mingsheng,HUANG Bin,LI Ning,et al.Rational design of 2-substituted DMAP-N-oxides as acyl transfer catalysts:Dynamic kinetic resolution of azlactones[J].Journal of the American Chemical Society,2020,142(45):19226-19238.
[19]WAKAFUJI K,IWASA S,OUCHIDA K N,et al.Dynamic kinetic resolution of azlactones via phase-transfer catalytic alcoholysis[J].ACS Catalysis,2021,11(22):14067-14075.
[20]NIAN Yong,WANG Jiang,ZHOU Shengbin,et al.Recyclable ligands for the non-enzymatic dynamic kinetic resolution of challenging α-amino acids[J].Angewandte Chemie-International Edition,2015,54(44): 12918-12922.
[21]WANG Shuni,ZHOU Shengbin,WANG Jing,et al.Chemical dynamic thermodynamic resolution and S/R interconversion of unprotected unnatural tailor-made α-amino acids[J].Journal of Organic Chemistry,2015, 80(20):9817-9830.
[22]LUO Yongchun,ZHANG Huanhuan,WANG Yao,et al.Synthesis of α-amino acids based on chiral tricycloiminolactone derived from natural(+)-camphor[J].Accounts of Chemical Research,2010,43(10): 1317-1330.
[23]FAN Shiming,LIU Shouxin,ZHU Sufang,et al.Temperature-dependent enantio-and diastereodivergent synthesis of amino acids with one or multiple chiral centers[J].Organic Letters,2017,19(17):4660-4663.
[24]XU Pengfei,CHEN Y S,LIN S I,et al.Chiral tricyclic iminolactone derived from(1R)-(+)-camphor as a glycine equivalent for the asymmetric synthesis of α-amino acids[J].Journal of Organic Chemistry,2002, 67(7):2309-2314.
[25]XU Pengfei,LU T J.Selective synthesis of either enantiomer of alpha-amino acids by switching the regiochemistry of the tricyclic iminolactones prepared from a single chiral source[J].Journal of Organic Chemistry,2003,68(2):658-661.
[26]HEMANTHA H P,SURESHBABU V V.Poly(vinyl)chloride supported palladium nanoparticles: Catalyst for rapid hydrogenation reactions[J].Organic & Biomolecular Chemistry,2011,9(8):2597-2601.
[27]LIU Shouxin,YANG Yihua,ZHEN Xiaoli,et al.Enhanced reduction of C—N multiple bonds using sodium borohydride and an amorphous nickel catalyst[J].Organic & Biomolecular Chemistry,2012,10(3):663-670.
