利奈唑胺对MRSA感染致慢性骨髓炎大鼠细菌负荷和骨修复的影响
2023-07-17陈立喜陈元良卓泽铭王和杰
陈立喜,陈元良,卓泽铭,王和杰
慢性骨髓炎是细菌感染引起的伴有骨质破坏的慢性炎症过程,好发于开放性骨折或创伤后多次手术人群,骨折部位不稳定、置入固定物、软组织损伤、清创不彻底等因素可引起感染后局部组织溃烂、骨坏死,导致病情反复发作,经久不愈[1-2]。手术彻底清创后抗菌药物灌注治疗是目前临床上治疗慢性骨髓炎的主要方式,但抗菌药物长期使用会增加致病菌耐药性,如耐甲氧西林金黄色葡萄球菌(MRSA)感染引起的慢性骨髓炎发病率呈升高趋势[3]。利奈唑胺属于唑烷酮类抗菌药物,可通过抑制细菌蛋白质合成来灭杀甲氧西林耐药革兰阳性球菌[4]。慢性骨髓炎引起的骨骼肌纤维化、瘢痕形成是导致患者肢体功能障碍的主要因素,转化生长因子(transforming growth factor,TGF)-β1 是组织纤维化过程中的重要分子标志物,已被证实在创伤性骨髓炎大鼠骨组织中表达明显升高[5]。TGF-β/骨形态发生蛋白(bone morphogenic protein,BMP)是哺乳动物骨形成生理过程中的重要信号通路之一,TGF-β1/BMP-2 可协同促进骨分化过程[6]。本研究通过MRSA 构建慢性骨髓炎大鼠模型,给予利奈唑胺干预,初步探究利奈唑胺的作用效果是否与TGF-β/BMP 信号通路变化有关,旨在为慢性骨髓炎的治疗提供理论依据。
1 材料与方法
1.1 材料
SPF 级健康雄性Wistar 大鼠45 只,6~8 周龄,体质量290~350 g,购自广东维通利华实验动物技术有限公司[动物生产许可证号:SCXK(粤)2022-0063],饲养于海南医学院动物房。实验动物分笼饲养,自由饮水和摄食,饲养室温度24~25 ℃,相对湿度12%,光/暗循环为12 h。动物实验相关操作严格遵守中华人民共和国国家标准GB/T35892-2018《实验动物福利伦理审查指南》。MRSA 购自中国工业微生物菌种保藏管理中心;利奈唑胺葡萄糖注射液(国药准字:H20150223)购自江苏豪森药业集团有限公司;TGF-β1、白细胞介素(interleukin,IL)-1β、IL-6 检测试剂盒均购自南京建成生物工程研究所;兔源抗TGF-β1、激活素受体样激酶1(activin receptor-like kinase 1,ALK-1)、BMP-2、甘油醛-3-磷酸脱氢酶(GAPDH)抗体和辣根过氧化物酶(HRP)标记羊抗兔IgG二抗购自英国Abcam公司;兔源抗Smad1/5、p-Smad1/5抗体购自美国Cell Signaling Technology 公司;BX53型显微镜购自日本日立公司;Western blot 电泳仪、ChemiDoc MP 凝胶成像分析系统购自美国Bio-Rad 公司;Multuskan Go 1510 酶标仪购自美国Thermo公司。
1.2 动物分组、建模及干预
以随机数字表法将45只Wistar大鼠分为假手术组、模型组、利奈唑胺组,各15只。参考文献[7]方法造模:大鼠称质量后以氯胺酮(10 mg/kg)腹部皮下注射麻醉,8%硫化钠(Na2S)擦拭膝关节及小腿皮肤脱毛,完成后生理盐水反复冲洗,仰卧位固定于手术台,于膝关节沿胫骨内侧做1.5 cm 切口,依次剥开骨膜后暴露胫骨上端,于膝关节下10 mm处,用2.5 mm 钻头钻入骨髓腔,挖出部分骨髓后形成空腔;模型组、利奈唑胺组大鼠于空腔内接种10 µL 含1.0×108CFU/mL 的MRSA悬液,接种后,将长度为5 mm、厚度为1 mm的克氏针插入胫骨腔,使用牙科石膏填充钻孔,缝合皮肤并应用聚维酮碘溶液消毒。造模后7 d,利奈唑胺组大鼠参考文献[8]中利奈唑胺的使用剂量腹腔注射54 mg/kg,假手术组及模型组给予等体积葡萄糖注射液,连续14 d。
1.3 指标观察
1.3.1 伤口愈合及Rissing、Norden评分观察
(1)末次给药结束后7 d,根据伤口愈合标准[9]进行观察,记录各组大鼠甲、乙、丙级愈合情况。甲级愈合:伤口愈合良好;乙级愈合:愈合处有红肿、血肿、积液等炎症反应,但未化脓;丙级愈合:伤口处有化脓。(2)末次给药结束后7 d,对模型组、利奈唑胺组大鼠右后肢正、侧位拍摄X线片,参考改良X 线Norden 骨髓炎评分标准[10]进行半定量评估:①死骨形成。有死骨记3 分,疑似死骨形成记1.5 分,无死骨记0 分。②骨质破坏。有记2分,疑似记1分,无记0分。③骨质增生。有记1 分,疑似记0.5 分,无记0 分。④软组织炎性包块影。有记1分,疑似记0.5分,无记0分。最高分7分,分数越高表示骨髓炎程度越严重。(3)末次给药结束后7 d,颈椎脱臼法处死模型组、利奈唑胺组大鼠,称体质量后,剥离皮肤和筋膜后暴露胫骨组织,肉眼观察后进行Rissing 评分[9]:严重骨质吸收、脓肿,记4分;红斑并胫骨骨干增粗、窦道形成或脓液渗出,记2 分;少量红斑,记1 分;无脓肿、红斑、死骨、水肿和新骨形成,记0分;评分由同一人完成。收集骨髓组织用于细菌负荷测定,并取病灶组织周围骨骼肌组织冻存后-20 ℃保存,用于酶联免疫吸附试验(ELISA)检测。将胫骨组织分成两部分,一部分4%中性甲醛固定脱钙后行HE 染色病理观察,另一部分液氮冻存后-80 ℃保存,用于蛋白免疫印迹检测。
1.3.2 细菌负荷测定
将骨髓组织匀浆培养于巧克力培养基中,放置5%CO2、37 ℃恒温细胞培养箱中培养,对细菌及菌落情况进行观察。
1.3.3 HE染色观察胫骨组织病理改变
取1.3.1中固定脱钙后的胫骨组织,梯度乙醇脱水,石蜡包埋,常规切片,每组选取3张4µm石蜡切片,脱蜡,苏木精、伊红染色后脱水封片,光学显微镜下观察并拍照。
1.3.4 骨骼肌炎性因子水平检测
将冻存的病灶组织周围的骨骼肌组织进行匀浆后,采用ELISA法检测TGF-β1、IL-1β、IL-6等水平,所有操作过程均严格按照试剂盒说明书进行。
1.3.5 蛋白免疫印迹法检测TGF-β/BMP信号通路相关蛋白表达
取50 mg 冻存的胫骨组织于含液氮的研钵中,磨成粉末后加入离心管中,加入蛋白提取试剂,BCA法检测蛋白浓度,调整各组蛋白浓度一致后,经SDS-PAGE 凝胶电泳、电转膜至甲醛预处理过的聚偏二氟乙烯(PVDF)膜,密封2 h,加入兔抗鼠TGF- β1、ALK-1、Smad1/5、p-Smad1/5、BMP-2、GAPDH 一抗(1∶500)4 ℃孵育过夜,TBST 漂洗40 min,加入HRP 标记的二抗(1∶500)孵育1 h,TBST 漂洗40 min,ECL 发光液将PVDF膜显色,曝光,Image J软件分析条带灰度值,以目标蛋白与内参蛋白GAPDH条带灰度值比值表示蛋白的表达水平。
1.4 统计学方法
采用SPSS 20.0软件和SigmaStat 3.5软件进行数据分析。计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较行LSD-t法;2组等级资料比较采用Kruskal-WallisH秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 利奈唑胺对MRSA 致慢性骨髓炎大鼠创口愈合及Rissing、Norden评分、细菌负荷的影响
末次给药结束后7 d观察发现,假手术组大鼠均为甲级愈合,模型组大鼠乙级愈合3只、丙级愈合12只,利奈唑胺组大鼠乙级愈合9只、丙级愈合6只,各组大鼠创口愈合情况比较差异有统计学意义(χ2=35.111,P<0.01)。与模型组比较,利奈唑胺组大鼠Rissing、Norden 评分、细菌负荷均降低(P<0.05),见表1。
Tab.1 Comparison of Rissing,Norden scores and bacterial load between the model group and the linezolid group表1 模型组与利奈唑胺组大鼠Rissing、Norden评分及细菌负荷比较(n=15,±s)

Tab.1 Comparison of Rissing,Norden scores and bacterial load between the model group and the linezolid group表1 模型组与利奈唑胺组大鼠Rissing、Norden评分及细菌负荷比较(n=15,±s)
**P<0.01。
组别模型组利奈唑胺组t Rissing评分/分2.85±0.32 1.62±0.38 9.589**Norden评分/分2.75±0.43 1.35±0.31 10.229**细菌负荷/(CFU/mL)2.13±0.42 0.51±0.04 14.871**
2.2 利奈唑胺对MRSA 致慢性骨髓炎大鼠胫骨病理学的影响
假手术组大鼠胫骨无炎症反应;模型组大鼠局部骨质破坏严重,明显髓腔内及骨膜下脓肿,明显炎细胞浸润及局部纤维化;利奈唑胺组大鼠较模型组骨质破坏较轻,炎细胞浸润及纤维化明显减轻。见图1。
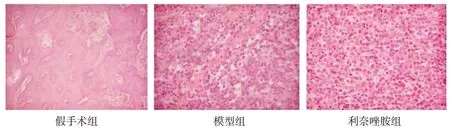
Fig.1 Pathological changes of tibia tissue in each group(HE staining,×100)图1 各组大鼠胫骨组织病理变化(HE染色,×100)
2.3 利奈唑胺对MRSA 致慢性骨髓炎大鼠骨骼肌组织TGF-β1、IL-1β、IL-6水平的影响
与假手术组比较,模型组和利奈唑胺组骨骼肌组织TGF-β1、IL-1β、IL-6水平均升高(P<0.05);与模型组比较,利奈唑胺组大鼠骨骼肌组织中TGF-β1、IL-1β、IL-6水平降低(P<0.05),见表2。
Tab.2 Comparison on levels of TGF-β1,IL-1β and IL-6 in skeletal muscle tissue between different groups表2 各组大鼠骨骼肌组织TGF-β1、IL-1β、IL-6水平比较(n=15,ng/L,±s)

Tab.2 Comparison on levels of TGF-β1,IL-1β and IL-6 in skeletal muscle tissue between different groups表2 各组大鼠骨骼肌组织TGF-β1、IL-1β、IL-6水平比较(n=15,ng/L,±s)
**P<0.01;a与假手术组比较,b与模型组比较,P<0.05,表3同。
组别假手术组模型组利奈唑胺组F TGF-β1 21.24±5.17 185.18±16.51a 75.35±23.48ab 369.144**IL-1β 29.51±6.12 115.32±25.73a 58.25±14.38ab 94.726**IL-6 11.35±2.42 69.51±17.64a 28.61±7.25ab 108.634**
2.4 利奈唑胺对MRSA 致慢性骨髓炎大鼠胫骨组织中TGF-β/BMP通路相关蛋白表达的影响
与假手术组比较,模型组和利奈唑胺组胫骨组织中TGF-β1、ALK-1、p-Smad1/5 蛋白表达升高,BMP-2 蛋白降低(P<0.05);与模型组比较,利奈唑胺组胫骨组织中TGF-β1、ALK-1、p-Smad1/5 蛋白降低,BMP-2蛋白表达升高(P<0.05),见表3、图2。
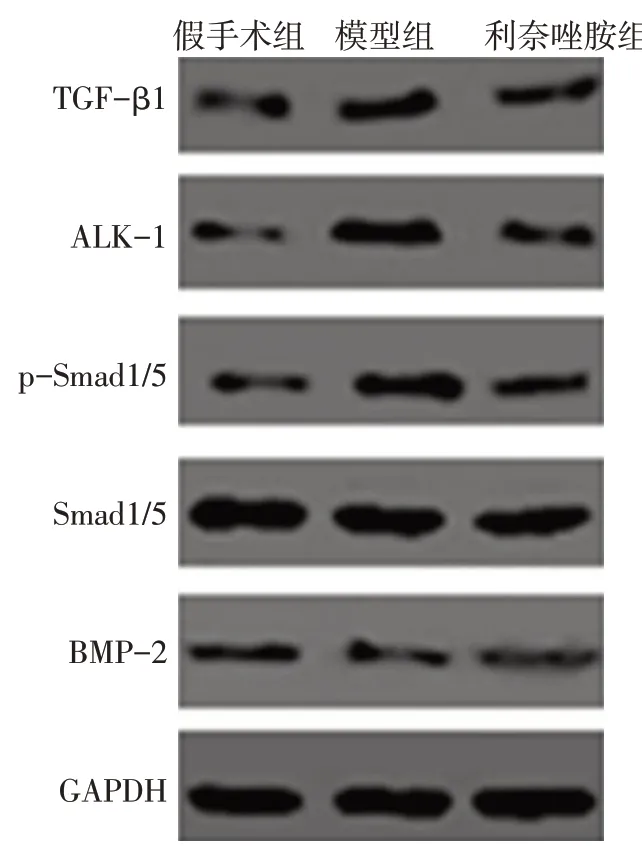
Fig.2 Expressions of TGF-β/BMP pathway-related proteins detected by Western blot assay图2 Western blot检测TGF-β/BMP通路相关蛋白的表达
Tab.3 Comparison on expression levels of TGF-β1,ALK-1,p-Smad1/5 and BMP-2 in tibia tissue between different groups表3 各组大鼠胫骨组织中TGF-β1、ALK-1、p-Smad1/5、BMP-2蛋白表达水平比较 (n=15,±s)

Tab.3 Comparison on expression levels of TGF-β1,ALK-1,p-Smad1/5 and BMP-2 in tibia tissue between different groups表3 各组大鼠胫骨组织中TGF-β1、ALK-1、p-Smad1/5、BMP-2蛋白表达水平比较 (n=15,±s)
组别假手术组模型组利奈唑胺组F TGF-β1 0.42±0.07 1.18±0.25a 0.78±0.14ab 74.759**ALK-1 0.31±0.05 1.32±0.27a 0.65±0.18ab 110.246**p-Smad1/5 0.35±0.06 0.95±0.24a 0.67±0.17ab 45.017**BMP-2 0.53±0.09 0.35±0.06a 0.42±0.07ab 22.319**
3 讨论
细菌感染是慢性骨髓炎的基本病因,骨细胞外基质中的蛋白质可作为MRSA侵入机体后的黏附载体,MRSA持续增殖后会释放大量的内毒素,影响骨吸收、骨形成动态平衡;同时,细菌生物膜可以阻挡抗菌药物渗入,降低细菌对抗菌药物的敏感性,使抗菌药物的抗菌效果减弱,抗菌药物广泛使用又会增加细菌的耐药概率,因而耐药菌感染所致慢性脊髓炎的临床治疗难度较大[11-12]。利奈唑胺可与细菌50S 亚基的23S 核糖体RNA 上的位点结合,阻止功能性70S 始动复合物的形成,抑制细菌细胞蛋白合成,且与其他抗菌药物没有交叉耐药现象,目前利奈唑胺在多重耐药革兰阳性菌所致感染疾病治疗中取得明显效果[13]。本研究旨在通过构建MRSA感染所致慢性骨髓炎模型来探究利奈唑胺对慢性骨髓炎潜在作用机制。
目前用于慢性骨髓炎研究的动物模型类型较多,Wistar 大鼠因其胫骨小、骨质易钻透、机体耐受力强以及成本低等优势[14],常用作慢性骨髓炎模型制备的首选实验动物。慢性骨髓炎大鼠模型制备是否成功与细菌接种剂量关系密切,细菌接种剂量过大可致死,接种剂量过小无法达到模型预期效果,10µL 1×108CFU/mL 是MRSA 目前比较适宜的造模剂量[15]。本研究结果显示,模型组大鼠创口愈合较差,且创口有流脓现象,而利奈唑胺组大鼠创口愈合情况较模型组得到明显改善,且Rissing评分、Norden评分和细菌负荷较模型组明显降低,说明利奈唑胺干预可促进MRSA感染所致慢性骨髓炎创口愈合,改善病灶组织内环境,可能与降低细菌负荷有关。
本研究结果显示,模型组大鼠的胫骨组织呈现出局部骨质破坏现象,且髓腔内和骨膜下有脓肿产生,还伴有大量炎性细胞浸润和局部纤维化,而给予利奈唑胺干预可使慢性骨髓炎大鼠上述病理症状得到明显缓解,说明慢性骨髓炎大鼠处于感染性炎症反应状态,给予利奈唑胺干预可以改善这种炎症状态。细菌感染、创伤愈合过程中均伴有炎症反应,中性粒细胞、巨噬细胞浸润会诱导多种生长因子过度表达[16],TGF-β就是其中一员。TGF-β作为多肽信号分子,可在创伤愈合及瘢痕修复过程中发挥重要作用[17]。本研究结果显示,模型组大鼠病灶组织周围的骨骼肌组织中TGF-β1、IL-1β、IL-6 水平较假手术组升高,而利奈唑胺干预可降低TGF-β1、IL-1β、IL-6 水平,这提示利奈唑胺干预可通过抑菌作用减轻炎症反应,促进慢性骨髓炎恢复。
TGF-β超家族可通过结合特定的Ⅰ型和Ⅱ型丝氨酸或苏氨酸激酶受体,将细胞内Smad转录因子转移至细胞核来发挥其相应作用[18]。ALK-1是TGF-β的Ⅰ型受体,ALK-1 激活可招募Smad1/5 并使Smad1/5磷酸化,磷酸化的Smad1/5被转运至细胞核后编码下游效应蛋白合成[19-20]。BMP 是TGF-β 超家族成员之一,具有成骨因子作用,可通过刺激间充质骨祖细胞分化为成熟骨细胞,诱导骨、软骨及骨相关结缔组织形成[21]。BMP-2 是促进骨形成及诱导骨细胞分化重要细胞外信号分子[22]。本研究通过分析慢性骨髓炎大鼠胫骨组织中TGF-β/BMP 信号通路关键蛋白表达结果显示,模型组大鼠骨组织TGFβ1、ALK-1 及p-Smad1/5 蛋白表达较假手术组明显升高,而BMP-2 蛋白表达较假手术组明显降低,提示过度活化TGF-β信号通路可能抑制BMP-2表达,从而抑制骨修复,而利奈唑胺干预后可以抑制TGFβ通路,解除过度活化TGF-β信号通路对BMP-2的抑制效用,促进骨修复。
综上所述,利奈唑胺可通过抑菌作用减轻慢性骨髓炎病灶处的过度炎症反应,其机制可能是通过抑制TGF-β 通路解除对BMP-2 介导的骨形成抑制作用,从而促进骨修复。本研究初步探讨了利奈唑胺对MRSA 感染慢性骨髓炎的可能作用机制,但其防治作用是否与其他信号通路有关尚需进一步探究。
