低温胁迫对紫花苜蓿幼苗AsA酶活性的影响
2023-07-17马亚珺杨国柱田海宁
马亚珺 杨国柱 田海宁
摘 要 为研究低温胁迫对不同品种紫花苜蓿体内抗坏血酸(Ascorbic acid,AsA)酶活性的影响,选育出适宜在青海省高寒地区种植的紫花苜蓿品种,以青大1号、大业1号、中苜1号、中兰2号、甘农3号、甘农9号和WL232这7个品种为试验对象,设置0 h(CK)、24 h(T1)、48 h(T2)、72 h(T3)4个低温处理,并测定紫花苜蓿幼苗中的抗坏血酸氧化酶(Ascorbate oxidase,AAO)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)的活性。结果表明,紫花苜蓿幼苗中酶活性极易受到环境的影响,且苜蓿品种不同、处理时长不同,幼苗体内酶活性不同,但在处理一定时间后,幼苗体内酶活性会减弱并趋于一个稳定值。其中,AAO、APX、DHAR活性最高的品种是青大1号紫花苜蓿,比较适宜在青海省高寒地区推广种植。
关键词 紫花苜蓿;低温胁迫;抗坏血酸氧化酶;抗坏血酸过氧化物酶;脱氢抗坏血酸还原酶
中图分类号:S541.9 文獻标志码:A DOI:10.19415/j.cnki.1673-890x.2023.08.001
紫花苜蓿(Medicago sativa L.)是多年生豆科牧草,根系发达,主根粗大,抗寒性、抗旱性和可再生能力较为强大,且产草量高,富含蛋白质,适口性好,固氮能力强,适应性广,被称为“牧草之王”[1-2]。在植物体内已发现的抗氧化物中,抗坏血酸含量最为丰富,抗坏血酸(Ascorbic acid,AsA)又名维生素C,常起到抗氧化和辅助7-α-羟化酶促进胆固醇转化胆汁酸的作用,是植物和大多数生物体内重要的抗氧化剂,在生长发育过程中起着重要作用。在高等植物中,抗坏血酸氧化酶(Ascorbate oxidase,AAO)是一种含铜的酶,位于细胞质中或与细胞壁结合,与其他氧化还原反应相偶联作为末端氧化酶,能催化抗坏血酸的氧化,具有抗衰老等作用;抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)是植物活性氧代谢中重要的抗氧化酶之一,又是维生素C代谢的主要酶类,紫花苜蓿中丰富的维生素C是饲草中重要活性营养成分[3];脱氢抗坏血酸还原酶(DHAR)是调控植物体内AsA氧化还原态的关键酶,在循环利用AsA、维持植物体内AsA的正常代谢水平、保护细胞组分抵御氧化损伤方面发挥着重要作用[4]。
1 材料与方法
1.1 试验材料、仪器、试剂
1.1.1 试验材料
试验材料为青大1号、大业1号、中苜1号、中兰2号、甘农3号、甘农9号和WL232紫花苜蓿幼苗。
1.1.2 试验仪器
试验仪器有培养皿、人工气候箱、分析天平、研钵、50 mL量筒、50 mL三角瓶、微量滴定管、滴定架、离心机、恒温水浴槽、洗耳球、酶标板、EP管及紫外分光光度计等。
1.1.3 试验试剂
试验试剂有碘酸钾、冰醋酸、磷酸氢二钠、磷酸二氢钾、抗坏血酸、淀粉溶液、乙醇、偏磷酸、三氯乙酸、双蒸水及牛血清蛋白等。
1.2 试验方法
1.2.1 试验材料的准备
采用盆栽试验,选用大小均匀、颗粒饱满的紫花苜蓿种子,将其用75%的乙醇溶液消毒后,播种在标记好的花盆中,每盆播种50粒,每个品种播种12盆。将播种好的花盆置于人工气候室内进行培养,温度保持在25 ℃。于播种后90 d进行试验。
1.2.2 试验实施
在进行低温处理时,将人工气候室温度调至4 ℃,同时设置胁迫时间,共设置0 h(CK)、24 h(T1)、48 h(T2)、72 h(T3)4个处理,并分别测定紫花苜蓿AsA酶活性。
1.2.3 项目测定
采用碘量法测定抗坏血酸氧化酶活性、采用紫外吸收法测定抗坏血酸过氧化物酶活性、采用微量法测定脱氢抗坏血酸还原酶活性。
1.3 数据处理
运用Excel 2010和SPSS 26.0软件进行绘图与统计分析。
2 结果与分析
2.1 低温胁迫对不同品种紫花苜蓿幼苗抗坏血酸氧化酶活性的影响
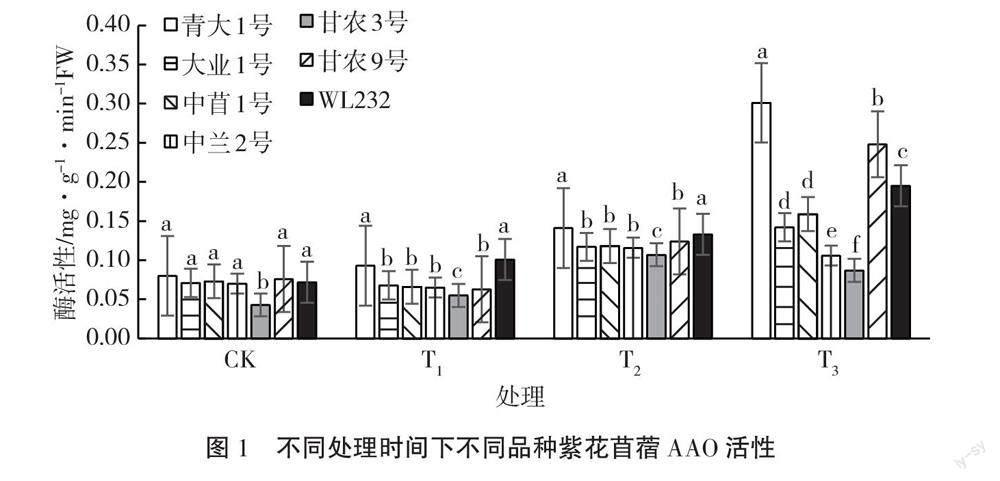
紫花苜蓿幼苗在4 ℃低温胁迫过程中,AAO活性变化如图1所示。由图1可知,随着处理时间的延长,T2、T3处理紫花苜蓿幼苗体内AAO活性呈上升趋势。在T3处理下,青大1号AAO活性显著高于其他品种(p<0.05)。在T1处理下,各紫花苜蓿幼苗体内AAO活性表现为WL232>青大1号>大业1号>中苜1号>中兰2号>甘农9号>甘农3号;在T2处理下,各紫花苜蓿幼苗体内AAO活性表现为青大1号>WL232>甘农9号>中苜1号>大业1号>中兰2号>甘农3号;在T3处理下,各紫花苜蓿幼苗体内AAO活性表现为青大1号>甘农9号>WL232>中苜1号>大业1号>中兰2号>甘农3号。这表明低温胁迫可促进紫花苜蓿幼苗体内的AAO发挥作用,清除植物体内聚集的活性氧,使种植在高寒地区的紫花苜蓿能够很好地抵御冷害。
2.2 低温胁迫对不同品种紫花苜蓿幼苗抗坏血酸过氧化物酶活性的影响
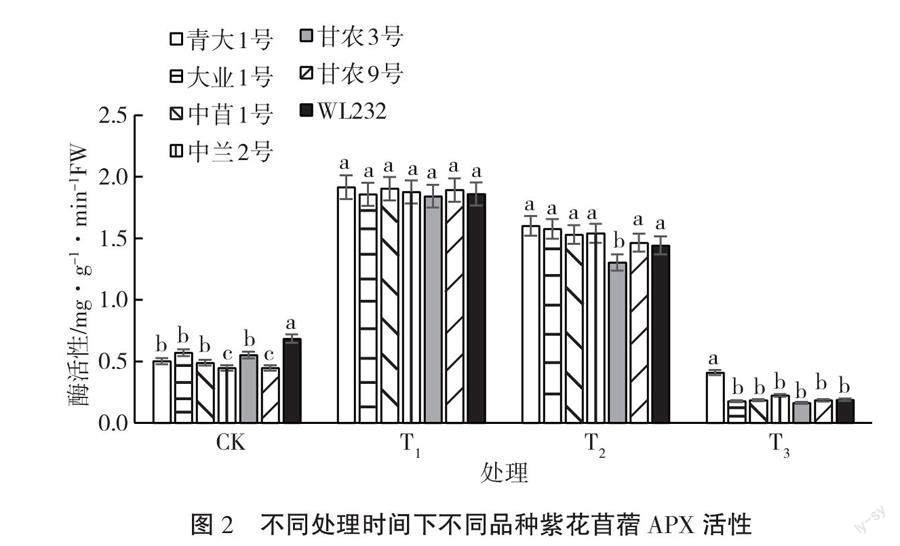
紫花苜蓿幼苗在4 ℃低温胁迫过程中,APX活性变化如图2所示。由图2可知,7个品种紫花苜蓿幼苗体内的APX活性在T1处理下达到高峰,随后逐渐呈现下降趋势。在T2处理下,只有甘农3号幼苗体内APX活性显著低于其他紫花苜蓿品种(p<0.05)。在T3处理下,各紫花苜蓿幼苗体内APX活性骤然下降。对比不同品种紫花苜蓿幼苗体内的APX活性,发现降幅最大的品种是甘农3号,相比T1处理,在T2处理和T3处理下,下降幅度分别为29%和91%;青大
1號幼苗体内APX活性下降幅度最小,在T2处理和T3处理下,下降幅度分别为16%和77%。在T1处理下,各紫花苜蓿幼苗体内APX活性表现为青大1号>中苜1号>甘农9号>中兰2号>WL232>大业1号>甘农
3号;在T2处理下,各紫花苜蓿幼苗体内APX活性表现为青大1号>大业1号>中兰2号>中苜1号>甘农9号>
WL232>甘农3号;在T3处理下,各紫花苜蓿幼苗体内APX活性表现为青大1号>中兰2号>WL232>中苜1号>
甘农9号>大业1号>甘农3号。这说明适度的低温处理可以很好地激活紫花苜蓿幼苗体内APX活性,有助于清除活性氧给植物带来的损伤,但是长时间低温会使幼苗体内O2-·和H2O2大量积累,而积累的活性氧必将攻击紫花苜蓿的植物膜,导致并加速冷害的发生,使APX失活,不利于植物抵抗寒冷。
2.3 低温胁迫对不同品种紫花苜蓿幼苗脱氢抗坏血酸还原酶活性的影响
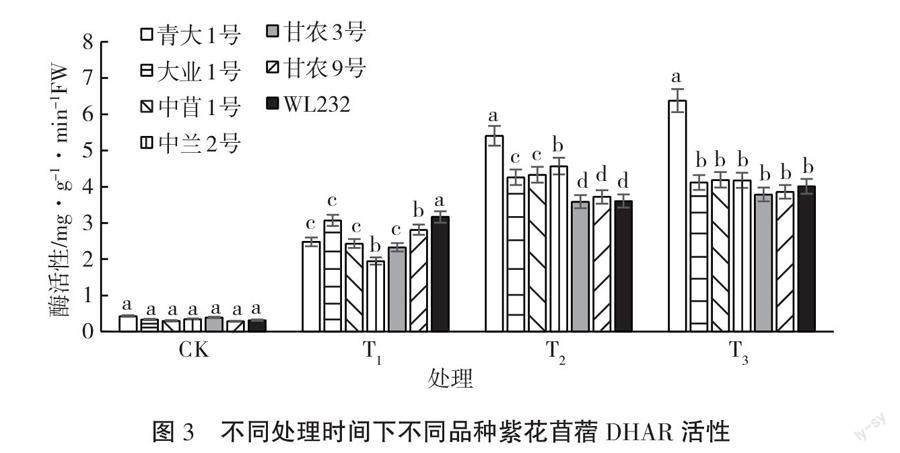
紫花苜蓿幼苗在4 ℃低温胁迫过程中,DHAR活性变化如图3所示。由图3可知,7种紫花苜蓿幼苗在CK处理下,即不经过低温处理,幼苗体内DHAR活性处在一个较低的水平,但随着低温胁迫时间的延长,DHAR活性呈上升趋势。在T1处理下,大业1号和WL232幼苗体内DHAR较活跃,增幅较CK均达到了88%;各紫花苜蓿幼苗体内DHAR活性表现为WL232>大业1号>甘农9号>甘农3号>中苜1号>青大1号>中兰2号;在T2处理下,各紫花苜蓿幼苗体内DHAR活性表现为青大1号>中兰2号>中苜1号>大业1号>甘农9号>WL232>甘农3号;在T3处理下,各紫花苜蓿幼苗中DHAR活性表现为青大1号>中苜1号>中兰2号>大业1号>WL232>甘农9号>甘农3号。这说明连续的长时间低温处理使紫花苜蓿幼苗中活性氧大量聚集,破坏了苜蓿的细胞膜,苜蓿体内的DHAR响应低温胁迫。
3 讨论
3.1 低温胁迫对不同品种紫花苜蓿幼苗中AAO活性影响的探讨
抗坏血酸氧化酶活性与植物的生长发育与抗衰老有着密切的关系,尤其是以叶片为收获物的农作物,低温可以降低农作物呼吸速率,抑制抗坏血酸氧化酶的活性,减缓抗坏血酸降解速度,还可减缓冷害发生[5]。
此次试验结果表明,各紫花苜蓿幼苗体内AAO酶活性在低温胁迫24 h和48 h处理下增幅较大,此时苜蓿开始受到低温的迫害,苜蓿体内的抗氧化酶保护系统开始运作,产生AAO以抵抗低温的迫害。其中,青大1号紫花苜蓿在低温胁迫48 h和72 h处理下增幅骤然增加,说明随着低温胁迫时间的增加,苜蓿幼苗受伤严重,体内抗氧化酶系统加大运作力度产生大量的AAO,以减少低温引起的伤害,且低温胁迫时间越长,抗坏血酸氧化酶活性在青大1号紫花苜蓿体内愈高。由此可见,青大1号紫花苜蓿对低温的响应比较好,比较适合种植在高寒地区,能够很好地抵御冷害。
3.2 低温胁迫对不同品种紫花苜蓿幼苗中APX活性影响的探讨
酶活性极易受到环境的影响,在低温胁迫下,活性氧在苜蓿幼苗体内快速累积,导致脂膜过氧化,细胞受到损伤,此时苜蓿抗氧化酶系统中的APX可以迅速有效清除活性氧,减轻低温对植物的迫害[6-7]。此次试验结果表明,在0~24 h低温胁迫下,紫花苜蓿幼苗体内APX活性增幅最大,幼苗体内APX对低温胁迫的保护性应激反应极为敏感,在24 h时幼苗体内抗氧化酶系统加大运作力度产生大量的APX,以减轻低温对苜蓿造成的伤害。在24~48 h低温胁迫下,紫花苜蓿幼苗体内APX活性升高,但增幅下降。低温处理时间越长,苜蓿幼苗体内APX活性越高,其体内的抗氧化酶系统越活跃,说明APX是苜蓿幼苗体内用来抵抗低温伤害的抗氧化酶系统中重要的一种保护酶。但随着低温胁迫时间的延长,幼苗体内会积累大量的O2-·和H2O2,会攻击紫花苜蓿的植物膜,导致并加速冷害的发生,使APX失活,不利于植物抵抗寒冷。此次试验中,青大1号紫花苜蓿在低温胁迫下表现较好。
3.3 低温胁迫对不同品种紫花苜蓿幼苗中DHAR活性影响的探讨
DHAR存在于叶绿体、线粒体和细胞质中[8-9]。根据文献报道,低温锻炼可使植物体内的AsA含量随着DHAR活性的增强而增加[10-12]。在长期低温胁迫处理下,紫花苜蓿体内会聚集大量活性氧,导致细胞膜损伤,从而使植物的抗寒性变弱。在良好的环境下,植物通常将活性氧维持在较低水平;而在周围环境不利的情况下,如此次试验低温胁迫环境下,植物细胞代谢失调,体内活性氧水平升高,对细胞结构造成潜在威胁。而DHAR是一种非常重要的酶,可以清除植物体内的活性氧,对逆境有着很好的响应。此次试验结果表明,在0~72 h低温胁迫下,紫花苜蓿体内DHAR活性总体先上升后下降。在低温胁迫24 h后,DHAR迅速在体内积累,在低温胁迫48 h时,DHAR酶活性上升程度较为明显,之后又在低温胁迫72 h后下降。不同品种、不同处理时间,紫花苜蓿幼苗体内DHAR活性都要高于CK,但品种间的DHAR活性差异性不显著,其中青大1号紫花苜蓿幼苗体内DHAR活性最强,甘农3号紫花苜蓿幼苗体内DHAR活性最弱。
4 结论
此次试验分析了不同品种紫花苜蓿在低温胁迫下生理生化指标的变化,研究了不同品种紫花苜蓿的生理生化指标与其抗寒性的关系。结果表明,青大1号紫花苜蓿对低温的响应比较好,体内的AAO、APX、DHAR活性增强,可有效清除由低温带来的活性氧,使细胞膜损伤程度下降,比较适合在高寒地区
种植。
参考文献:
[1] 蒋志刚,李立立,胡一鸣,等.青藏高原有蹄类动物多样性和特有性:演化与保护[J].生物多样性,2018,26(2):158-170.
[2] 张镱锂,吴雪,祁威,等.青藏高原自然保护区特征与保护成效简析[J].资源科学,2015,37(7):1455-1464.
[3] 段保宁,张晶晶.苜蓿产业发展现状及展望[J].今日畜牧兽医,2019,35(6):74-75.
[4] 郭正刚,张自和,王锁民,等.不同紫花苜蓿品种在黄土高原丘陵区适应性的研究[J].草业学报,2003,12(4):45-50.
[5] 洪绂曾.中国草业战略研究的必要性和迫切性[J].草地学报,2005,13(1):1-4.
[6] 王英哲,徐博,徐安凯,等.14个紫花苜蓿品种的引种和生产性能比较评价[J].中国农学通报,2015,31(11):38-44.
[7] 王运涛,杨志敏,李广有,等.6个苜蓿品种在冀西北地区的生产性能[J].草业科学,2014,31(6):1141-1146.
[8] 徐丽君,杨桂霞,陈宝瑞,等.不同苜蓿(品)种营养价值的比较[J].草业科学,2013,30(4):566-570.
[9] 杨红善,常根柱,周学辉,等.苜蓿引进品种半干旱、半湿润区适应性试验[J].西北农业学报,2011,20(1):86-90.
[10] 薛琪.8个紫花苜蓿品种抗旱、抗寒性分析研究[D].杨凌:西北农林科技大学,2017.
[11] 刘佳月.紫花苜蓿与黄花苜蓿抗旱转录组学研究[D].北京:中国农业科学院,2018.
[12] 段明.低温胁迫下番茄类囊体膜抗坏血酸过氧化物酶基因的表达和功能研究[D].泰安:山东农业大学,2012.
(责任编辑:张春雨)
