二氧化碳捕集技术发展现状
2023-07-16金文龙
姜 鑫, 金文龙, 铁 宇
(北京市燃气集团研究院, 北京 100011)
1 概述
2019年,全球人类活动排放的二氧化碳为390×108t,其中,中国排放量为100×108t左右。在世界范围内,化石能源消费相关二氧化碳排放量在全部排放量中的比例从1990年的70%上升至2020年的75%左右[1]。根据预测,到2030年之前,全球依然将以化石燃料为主要能源[2-3]。为有效控制温室气体特别是二氧化碳的排放,需要开展二氧化碳捕集工作。根据吸收材料不同,二氧化碳捕集技术分为固体吸附法、化学吸收法、膜分离法等。
2 固体吸附法
固体吸附法是利用CO2分子与吸附剂表面形成范德华力,或者与吸附剂中的极性离子形成作用力达到吸附分离的目的。固体吸附法工作温度范围较宽(最高可达700 ℃),CO2吸附量较大,脱附方便,吸附剂材料稳定性较高,一般不产生挥发或者有毒物质[4]。吸附剂选择一般从以下几个方面考虑:二氧化碳吸附量大、吸附-脱附速率快、可以重复利用、对待吸附气体中含有的其他杂质要求低、可吸附CO2体积分数范围宽、价格低廉等。常见的固体吸附材料有碳类吸附材料、沸石、金属类吸附材料等。
2.1 碳类吸附材料
碳类吸附材料一般由碳和其他物质构成,该类吸附材料主要通过物理吸附的方式,将CO2吸附分离,常见的碳类吸附材料有活性炭、碳纳米管、碳分子筛和石墨烯等。不同类型的碳类吸附材料在实验室条件下的吸附能力见表1。
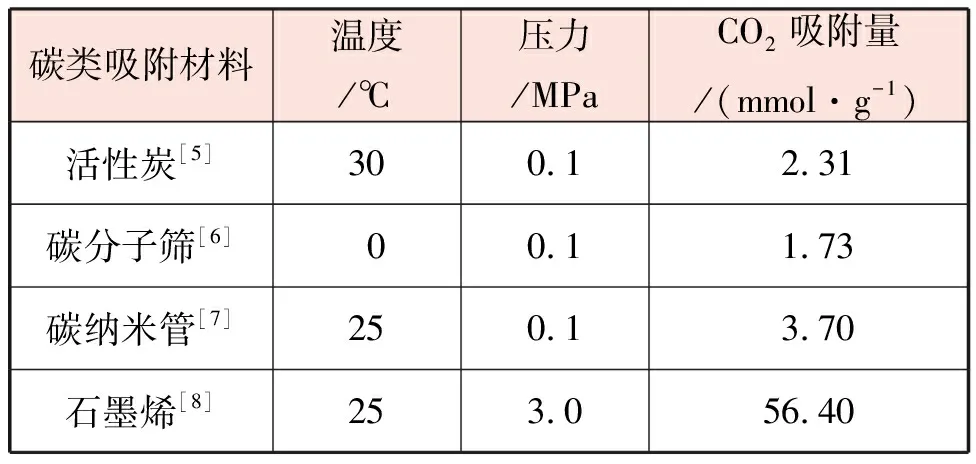
表1 不同类型的碳类吸附材料在实验室条件下的吸附能力
碳类吸附材料加工方便,材料成本较低,但是主要靠范德华力完成吸附过程,所以受温度影响较大,当温度高于60 ℃时,吸附能力明显减弱。
2.2 沸石
沸石是一类具有骨架结构的微孔材料,一般为带结晶水的碱金属或碱土金属的硅铝酸盐。CO2通过这种材料微孔的时候,会与碱金属阳离子之间产生强静电作用,从而发生吸附作用。不同沸石对二氧化碳吸收能力对比见表2。

表2 不同沸石对二氧化碳吸收能力对比
尽管沸石对CO2有较好的吸附和脱附能力,但是沸石的脱附温度一般高于300 ℃[12],而且若CO2中有水,沸石会优先吸附水分子,将造成微孔堵塞,从而大大影响CO2的吸附效果[13]。
2.3 金属类吸附材料
金属类吸附材料利用金属类材料的碱性与酸性CO2发生作用,达到吸附的目的。根据材料不同,分为金属有机骨架材料、金属氧化物及其盐类等。
金属有机骨架材料是一种多孔材料,具有晶体结构、很高的比表面积和孔隙度。Vo等人[14]以铁等为原料制备的金属有机骨架材料的比表面积为200 m2/g,在25 ℃、101 kPa的条件下,实验室测试该材料对CO2的吸附量为3.10 mmol/g。Kang等人[15]制备的氧化锆金属有机骨架材料比表面积为2 320 m2/g,在24.8 ℃、101 kPa的条件下,CO2吸附量为1.06 mmol/g。金属有机骨架材料对CO2分压要求较高,材料制备过程复杂,成本较高。
具有CO2吸附功能的金属氧化物,一般为碱金属或碱土金属类的氧化物,该类氧化物本身具有较强的碱性,可以与CO2发生化学反应,达到吸附的目的。Zhu等人[16]制备的K-LDOS金属氧化物吸附材料,在400 ℃、0.1 MPa的条件下,CO2的吸附量为0.722 mmol/g。金属氧化物及其盐类对CO2的吸收能力较强,但是能耗较高,特别是CO2脱附过程,一般需要在400~800 ℃下进行,需要消耗大量的能量。
3 化学吸收法
化学吸收法主要利用吸收剂的化学活性与CO2发生化学反应,生成介稳化合物,然后改变外界条件如温度、压力等,使生成物分解并释放CO2,达到捕集CO2的目的,解吸后的吸收剂可以再循环使用[17]。常用的化学吸收剂一般为碱性液体,如醇胺、氨水和钾碱溶液等。
3.1 醇胺类
醇胺类是最常用的化学吸收剂,分为单乙醇胺(MEA),二乙醇胺(MDEA)和混合乙醇胺等。
MEA 吸收CO2是可逆反应,温度在20~40 ℃时反应正向进行,为放热反应。当温度达到104 ℃时,反应则逆向进行,释放出吸收的CO2,MEA溶液再生[18]。MEA相对其他醇胺类吸收剂吸收速率较快,但是由于产物稳定性较高,需要在较高的温度下完成CO2的解吸,捕集过程能耗较高。此外,由于MEA本身的腐蚀性较强,对设备要求也比较高。
MDEA是一种叔胺,稳定性较高,不易发生降解,与CO2反应后生成氨基甲酸盐,产物稳定性较差,在较低的温度可以实现分解,因此,MDEA的再生温度比较低。但是MDEA吸收速率缓慢,不利于CO2快速吸收。
由于单一组分的醇胺存在不同的缺陷,因此国内外学者也在研究混合类吸收剂,如Nwaoha等人[19]探究了以MEA为主体,添加哌嗪改善MEA溶液脱除CO2的性能,在313 K下,该混合溶液与5 kmol/m3的MEA溶液相比,吸收容量增加大约30%,而且解析速率也比单一MEA快。根据Khan等人[20]的研究,将哌嗪加入到MDEA溶液作为吸收剂吸收电厂烟气中的CO2,实验结果表明,混合吸收剂的吸收性能明显增强,MDEA溶液吸收速率得以提升。Archane等人[21]在MDEA中加入聚乙二醇(PEG)作为CO2混合吸收剂,研究发现PEG的浓度增加会导致CO2的吸附量减少,但解吸能耗降低。
3.2 热钾碱法
热钾碱法是一种应用比较早的CO2吸收方法,其原理是在90~110 ℃并且加压的条件下,高浓度的碳酸钾水溶液与CO2发生反应,生成碳酸氢钾,对碳酸氢钾溶液降压处理后,可以再生得到碳酸钾,同时分离CO2。碳酸钾浓度越高,CO2的吸收能力越强,吸收速率越快。三氧化二砷、硼酸或磷酸、呱嗦等可以提高吸收和解吸速率,其中效果最好的是三氧化二砷。三氧化二砷剧毒,对操作工况要求非常严格,目前已被取代。同时碳酸钾溶液的腐蚀性较强,对设备的防腐要求较高。
3.3 氨法
氨法吸收CO2原理是利用氨的弱碱性,与CO2反应生成碳酸铵或者碳酸氢铵。氨法吸收CO2与MEA相比,能耗低,吸收速率快,而且腐蚀性较低。氨可以吸收烟气中的二氧化硫和氮氧化合物,在吸收CO2的同时可以降低其他污染物的排放,但是这也为后续分离CO2和吸收剂再生带来一定的麻烦。此外,氨的挥发性较高,也限制了其应用。
4 膜分离法
膜分离法是一种常见的气体分离方式,其原理是利用混合气体中各组分与膜接触的物理化学性质的差异,从而使某一种组分最先从膜的一侧转移到膜的另一侧。膜分离法脱除CO2具有能耗低、设备尺寸小、操作和维护简单、兼容性强等优势。但是膜分离CO2也会受到烟气压力、CO2浓度、烟气中NOx等组分影响[22]。常见的膜有无机膜、有机膜和复合膜。
无机膜可以在高温、高压的条件下工作,具有机械强度大、热稳定性好、化学性质稳定、容易再生、使用寿命长且能耐各种酸碱性介质等优点。同时,也有可塑性差、易破损、价格昂贵等缺点[23]。
有机聚合体膜单位体积的过滤面积较大,容易装配,但是不能在较高的温度(大于150 ℃)和腐蚀环境中使用[24]。常用的有机膜有聚酰亚胺膜、聚砜膜等。Maya等人[25]采用共聚的方法改性了一种含有环氧乙烯的聚酰亚胺,经200 ℃热处理后,CO2的渗透速率增加了2.4倍,但是对N2的选择性降低了10%。Barooah等人[26]在聚醚砜膜中加入聚乙烯醇和丙二醇等得到的膜材料,CO2渗透系数达到0.061 7×10-10cm3/(cm2·s·Pa),CO2/N2选择性(2种气体渗透系数的比值)是370。
复合膜可以综合不同膜的优点,提高CO2的选择性。连少翰等人[27]对不同复合膜的CO2分离性能进行了对比,见表3。

表3 不同复合膜的CO2分离性能对比
5 结语
对于固体吸附法,常规吸附剂吸附和脱附能力受温度影响比较大,如沸石类吸收剂,脱附温度高于300 ℃,能耗较高;对于碱金属类吸附剂,脱附过程对温度要求更高,能耗也更高。
化学吸收法可以在比较温和的条件下完成二氧化碳的吸收与解吸,但是存在化学试剂的腐蚀和毒性等问题,因此对安全性要求比较高。同时化学吸收剂的挥发和回收也加大了对污水处理等环境保护方面的要求。
膜分离法的能耗较低,但是规模较小,大规模分离二氧化碳有一定的困难,同时膜材料成本也相对较高,这些都限制了膜材料的应用。
二氧化碳捕集技术研究主要目标是降低捕集成本。不论采用何种材料作为捕集媒介,材料本身的成本要足够低,尽可能降低捕集、解吸、脱附过程的能耗。
