生物基可降解餐具中15种芳香胺迁移研究
2023-07-15孟恒立胡云姜水潘轶凡张维谊刘源
孟恒立,胡云,姜水,潘轶凡,张维谊,刘源
生物基可降解餐具中15种芳香胺迁移研究
孟恒立1,2,胡云3,姜水1,2,潘轶凡1,2,张维谊4,刘源1,2
(1.上海交通大学 农业与生物学院,上海 200240; 2.上海食品安全工程技术研究中心,上海 200240; 3.扬州市食品药品检验检测中心,江苏 扬州 225000; 4.上海市农产品质量安全中心,上海 200335)
研究可生物降解餐具中15种初级芳香胺(Primary aromatic amines,PAAs)的迁移行为。制备4种不同的食品模拟液用于迁移实验,基于超高效液相色谱−串联质谱(UPLC-MS/MS)技术进行定性定量分析,检测PAAs从可生物降解餐具到不同食品基质中的迁移量。UPLC-MS/MS的总运行时间为12 min,15种PAAs可以在7 min内分离。不同PAAs的检出限和定量限分别为0.2~3.0 μg/kg和0.5~9.9 μg/kg范围内,符合标准要求(10 μg/kg)。除1,5−二氨基萘和2,4−二甲基苯胺外,从可生物降解餐具迁移到不同食物基质的大多数PAAs的迁移浓度均小于最大残留限值。在使用过程中,可生物降解餐具内部的PAAs会迁移到食品基质中,对消费者的健康存在潜在危害。采用所建立的方法对可生物降解餐具中的PAAs迁移量进行检测,为降低食品安全风险提供技术支撑。
芳香胺;可生物降解餐具;食品基质;迁移;超高效液相色谱−串联质谱
近年来,随着生活节奏的加快,食品配送行业迅速崛起,新型冠状病毒(COVID−19)疫情也使得餐厅堂食概率变得更低[1],越来越多的消费者养成了外卖或打包的饮食习惯。食品接触材料作为容器、包装或者餐具会与食品发生接触[2],以前市场上大多使用不可降解或可降解率低的一次性塑料餐具,通常在使用后采用填埋和焚烧等方式处理[3]。近年来,针对环保型一次性可降解餐具的研究逐渐增多[4]。
由农副产品制成的可生物降解餐具成本低且可生物降解,受到越来越多的关注[5-6]。在众多有机化合物中,淀粉含量仅次于纤维素含量,它在自然界中的含量位居第二,广泛存在于大麦、小麦、马铃薯、玉米等植物中。通常将淀粉作为一种食品接触材料,用于可生物降解餐具的生产[7]。在食品接触材料加工过程中,通常会添加一些工业添加剂(如黏合剂、增塑剂和着色剂等),以控制最终材料的性能,达到满足实际需要的目的[8]。由于添加剂中可能含有某些成分,如光引发剂、芳香胺(PAAs)、苯胺(ANL)、间苯二胺(m-PDA)和 2,6−二氨基甲苯(2,6-TDA)等,因此可能会危害人体健康[9]。虽然可生物降解餐具用天然材料加工而成,但加工过程中的印刷、涂层、层压和整理等操作仍可能形成芳香胺,这主要是因聚氨酯黏合剂固化不完全,产生了芳香族异氰酸酯残留物[8]。加工不当或在恶劣条件下使用的多层包装材料可能导致PAAs迁移到食品基质中,从而对消费者的健康产生危害[10]。
根据世界卫生组织国际癌症研究机构(IARC)发布的信息,许多PAAs被列为人类致癌物,包括1级(对人类致癌)、2A级(对人类很可能致癌)、2B级(对人类可能致癌)和3级(对人类致癌性无法分类)[11-12]。考虑到PAAs存在影响人类健康的风险,许多国家或组织都制定了相关标准来规范食品接触材料的应用。中国国家食品安全标准(GB 9685—2016)[13]和欧盟委员会法规(No. 10/2011)[14]都对芳香胺的迁移提出了具体要求,其中,欧盟的标准是从食品接触材料中迁移到食品或食品模拟物中的PAAs应不超过0.01 mg/kg。近年来,一些地区对PAAs的要求越来越严格。根据欧盟委员会第1245/2020号法规要求,在检出限为0.002 mg/kg条件下,单独一种PAAs在食品或食品模拟物中不得被检出[15]。PAAs的鉴别和检测往往受到检测方法和仪器精度的影响,为了满足日益严格的监管要求,应开展更多测定迁移到食品基质中的PAAs的研究。
液相色谱串联质谱法(LC-MS/MS)是定性和定量分析食品基质中PAAs最常用的技术[16-18]。LC-MS/MS具有良好的分离性能和较高的灵敏度,可以同时分析复合基质中的多种PAAs[11, 19]。一般来说,在使用液相色谱的PAAs分析方法时,通常使用反相(RP)柱,柱子尺寸在50~150 mm之间,颗粒大小为1.7~5 μm[9, 11, 17-22]。由于超高效液相色谱(UPLC)的柱子颗粒尺寸更小(< 2.1 μm),分辨率更高,因此在分析PAAs时更受欢迎。
关于芳香胺迁移的研究大多只选择1种模拟食品基质,如水模拟物或者酸性水模拟物[11, 20-22]。考虑到食品接触材料在食品行业实际应用时,通常会与水相、油相、含醇水和含酸水等多种食品基质接触。文中的研究目的是建立一种基于超高效液相色谱−串联质谱(UPLC-MS/MS)的检测食品基质中PAAs的方法,研究不同PAAs从玉米淀粉制成的一次性可降解餐具向不同食品基质的迁移行为。
1 实验
1.1 试剂
主要试剂:1,3−二氨基苯(≥99%)、2,4−二甲基苯胺(≥98%)、4−氯苯胺(≥98%)、ο-tolidine(≥98%)、间氯苯胺(≥99%)、4−氨基联苯(≥98%)、3,4−二氯苯胺(≥98%)、2−氨基联苯(≥98%)、3,5−二氯苯胺(≥98%)、氨水(25%),以上试剂购自上海迈瑞尔化学技术有限公司;2,6−二氨基甲苯(≥98%)、对甲苯胺(≥99.7%)、甲醇(色谱级)、正己烷(色谱级),以上试剂购自上海阿拉丁生化科技股份有限公司;1,5−二氨基萘(≥98%)、2−甲氧基−5−三氟甲基苯胺(≥98%)、4,4'−硫代苯胺(≥98%),以上芳香胺试剂购自上海毕得医药科技有限公司;2−氨基−4−硝基甲苯标准品(≥98%),购自上海贤鼎生物科技有限公司;乙醇(≥98%),购自上海凌峰化学试剂有限公司。上述用于LC分析的试剂均为色谱纯级。15种PAAs试剂的化合物名称、简称、分子式、分子量和结构式等信息列于表1。
表1 芳香胺样品信息

Tab.1 Information of primary aromatic amine samples
注:致癌等级来自世界卫生组织国际癌症研究机构(IARC);“/”表示未被IARC列入致癌物。
1.2 仪器与设备
主要仪器与设备:二维超高效液相色谱−三重四极杆质谱联用仪(ACQUITY UPLC H−class/Xevo TQ−XS),美国Waters公司;NW10VF净水系统,成都浩康科技有限公司。
1.3 方法
1.3.1 溶液配制
在此研究中,所有PAAs标准储备溶液均为750 mg/L的甲醇溶液,然后将这些储备溶液稀释成一系列标准溶液。分别取0.5、1.0、2.5、5.0、10.0 mL储备溶液用甲醇稀释至25 mL,所制备的标准溶液的质量浓度分别为15、30、75、150 、300 mg/L。随后将这系列标准溶液稀释成质量浓度分别为0.10、0.20、0.50、1.00、2.00、15.00、30.00、75.00、150.00、300.00 μg/L的工作溶液。
1.3.2 样品制备
在此研究中,使用4种食品模拟液来模拟不同的食物类型,即水、含酒精的水、含酸的水和油。食品模拟液分别记为A(蒸馏水)、B(体积分数10%的酒精/水,)、C(体积分数3%的乙酸/水)和D(橄榄油,购自当地超市)。
将以玉米淀粉制成的可生物降解餐具切成矩形块(1.5 cm×4 cm),然后浸入不同的模拟食品溶液(20 mL)中保持2 h,以模拟实际使用条件,最后将浸泡后的A和B模拟溶液通过0.22 μm滤膜(聚四氟乙烯针头过滤器)过滤,并将1 mL过滤后的溶液放入进样瓶中进行分析。取1 mL浸泡后的模拟液C用氨水将其pH值调至7,然后用水将溶液的体积调至2 mL,用于UPL−CMS/MS 分析。油模拟食品溶液的处理步骤:将5 mL溶液D放入分液漏斗中,然后加入5 mL正己烷;振荡10 min后静置,得到萃取液;将萃取液通过0.22 μm滤膜,然后将1 mL过滤后的溶液放入进样瓶中进行分析。将样品重复处理5次。除非另有说明,所有步骤均在室温(25 ℃±1 ℃)下进行。
1.3.3 仪器分析
采用UPLC-MS/MS实现对PAAs的定性和定量分析。LC条件:使用BEH Phenyl色谱柱(2.1 mm × 100 mm,1.7 μm)分离PAAs,柱温为40 ℃,进样量为1 μL,流速为0.30 mL/min。流动相分别为含有0.07%(体积分数)甲酸的甲醇溶液(流动相A)和水(流动相 B)。梯度洗脱程序:0~1.0 min,流动相A 99%;1.0~3.0 min,流动相A从99%降至70%;3.0~7.0 min,流动相A从99%降至0%;7.0~9.5 min,流动相A 0%;9.5~9.6 min,流动相A从0%提高到99%;9.6~12.0 min,流动相A 99%。总运行时间为12 min。
MS条件:正电喷雾离子源(ESI+),离子源温度为150 ℃;毛细管电压为0.5和0.6 kV;脱溶剂的温度为500 ℃,脱溶剂的气体流量为1 000 L/h;锥孔电压为20 V,锥孔气体流量为150 L/h;碰撞气体流量为0.12 mL/min;采用多反应离子监测模式(MRM)。 PAAs的保留时间、特征离子、碰撞能量、锥孔电压、离子选择通道等见表2。
表2 不同芳香胺的仪器分析参数
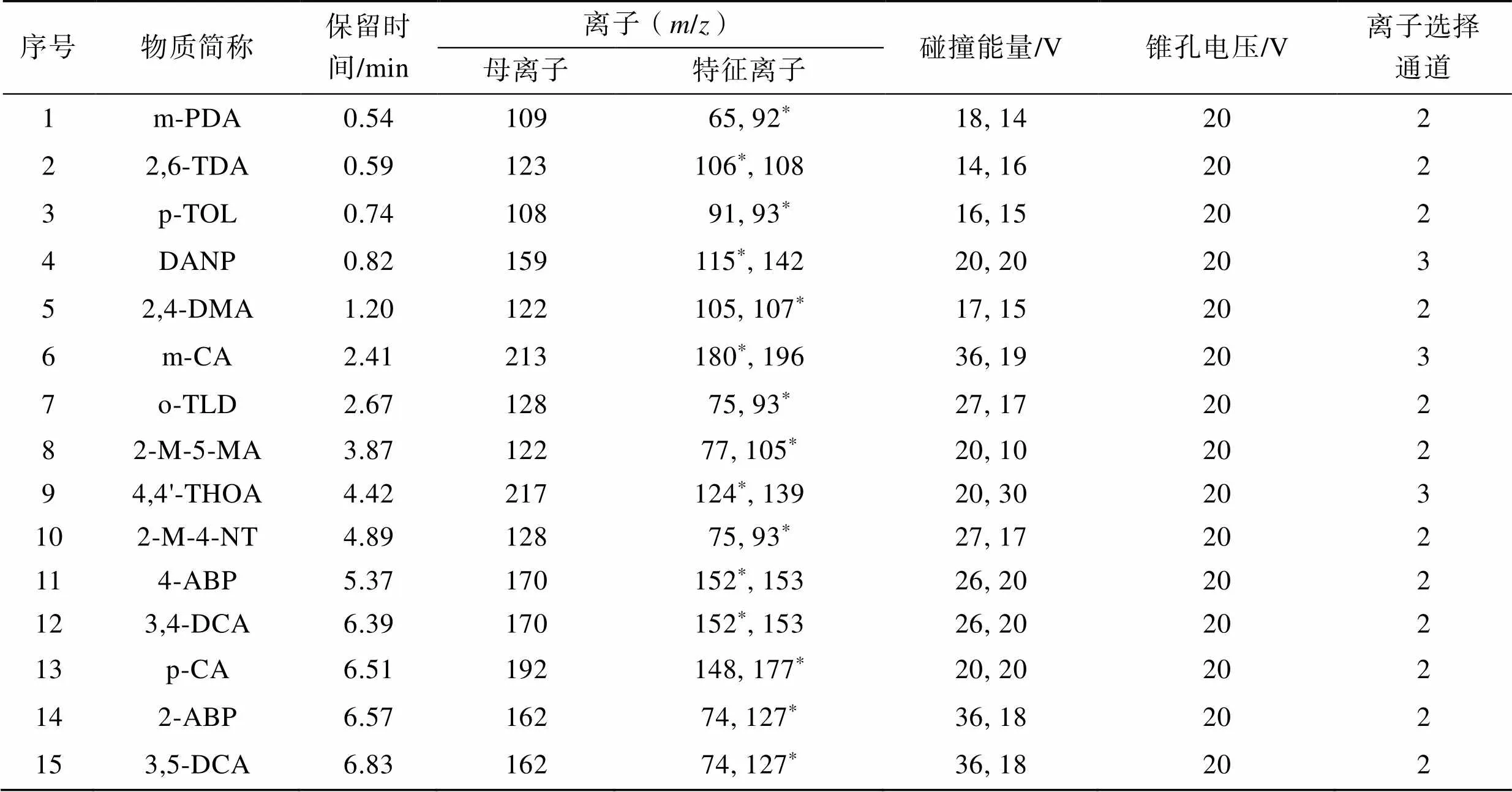
Tab.2 Instrumental analysis parameters of different PAAs
注:“*”表示用于定性定量分析的特征离子。
1.4 芳香胺迁移量计算
PAAs的定量分析采用外标法。分别以PAAs的浓度和峰面积作为自变量和因变量,得到PAAs的标准曲线。拟合方程见式(1)。

式中:为色谱图中每种 PAAs的峰面积;为每种PAAs的质量浓度,μg/L;、分别为线性方程的斜率和截距。
不同食品模拟物溶液中PAAs的浓度按式(2)计算。

式中:为模拟溶液中PAAs的质量浓度,μg/L;为色谱图中每个PAAs 的峰面积;、分别为线性方程的斜率和截距。
每种PAAs的迁移量按式(3)计算。
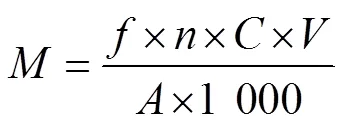
式中:为PAAs的迁移量,μg/kg;为不同单位的换算系数,这里取=6 dm2/kg;为稀释倍数;为模拟溶液中PAAs的质量浓度,μg/L;为所用模拟液的体积,mL;为使用餐具的表面积,dm2。
这里将受试餐具完全浸入模拟溶液中,以双面计算表面积。采用SPSS v18.0软件进行ANOVA和主成分分析(PCA)。
2 结果与分析
2.1 仪器分析条件优化
该方法旨在同时检测15种PAAs,在食品接触材料中通常可以检测到多种PAAs[9, 17]。此外,不同样品中PAAs的浓度各不相同,需要普适性更高的检测方法[23]。优化色谱条件的重要目的是增加不同化合物之间的保留时间间隔,以鉴定不同的PAAs。作为重要的极性有机溶剂,甲醇和乙腈通常被用作反相液相色谱的流动相[21, 24-25]。乙腈的洗脱效率强于甲醇,导致不同PAAs之间的保留时间间隔相对较小。由此,这里使用甲醇代替乙腈作为流动相来分离PAAs。此外,由于含有甲酸的水溶液不能很好地分离不同的PAAs,所以这里使用甲酸的甲醇溶液作为流动相。根据色谱柱的特点,以含有体积分数0.07%甲酸的甲醇溶液为有机流动相(流动相A),以水为流动相B。15种不同 PAAs标准品的UPLC−MS/MS色谱图如图1所示。

图1 15种PAAs标准品的色谱图
2.2 检测方法性能评估
通过外标法验证了所用检测方法的性能。检测方法的检测限(LOD)和定量限(LOQ)分别根据信噪比3和10确定。列出了从可生物降解餐具迁移到食品模拟物中的PAAs的线性范围、线性拟合方程、LOD、LOQ及回收率,见表3。
由表3可知,在0.1~300 μg/L内的回归系数(2)均在0.991 1(DANP)~0.999 9(2,4-DMA)范围内,说明标准曲线线性较好。部分PAAs(o-TLD和4,4'-THOA等)回归曲线的回归系数比之前的研究结果更好[26]。此外,采用文中方法可以通过保留时间实现15种PAAs的分离。
15种PAAs的LOD和LOQ分别在0.2~3.0 μg/kg和0.5~9.9 μg/kg范围内。DANP的LOD 和 LOQ均最高(分别为3.0、9.9 μg/kg)。将单位从μg/kg转换为μg/L(0.50 μg/L和1.65 μg/L)后,这里DANP的LOD和LOQ约是已发表文献结果(1.38 μg/L和4.60 μg/L)的1/3[27]。通过比较其他PAAs(如 2,6-TDA、m-PDA、4-ABP)时也可获得类似结论,表明文中方法的检测精度较高,检测性能可以接受。此外,该方法中15种PAAs的LOD均符合中国食品安全国家标准(10 μg/kg)的要求。
通过测得的浓度与加标样品的浓度之比来计算回收率,在模拟物A中加入了3个质量浓度水平的PAAs(15、75、150 μg/L),计算得到的平均回收率(=3)和相对标准偏差(RSD)如表3所示。所有PAAs的回收率均在74.1%(DANP)~114.1%(2,6-TDA)范围内,RSD值均小于5.7%(m-CA)。文中方法的PAAs回收率与已发表文献中食品基质的PAAs检测结果相近[28],且远高于部分已发表文献的结果[11, 26, 29]。
2.3 样品分析
使用1.3建立的方法,检测从可生物降解餐具中迁移到4种食品模拟溶液中的PAAs。为了模拟餐具的实际使用情况,这里采用了4种食品模拟溶液(即水、乙醇溶液、乙酸溶液和油),均为常用的食品模拟物[9, 30-31]。在4种模拟溶液中测得PAAs的质量浓度和迁移量如表4所示。
考虑到致癌性,IARC分类中具有更高致癌性的PAAs(即4-ABP、o-TLD、2M-5-MA、4,4'-THOA、p-CA)在油模拟液(50.305 μg/kg)、酸溶液(49.106 μg/kg)、水(47.590 μg/kg)和乙醇溶液(45.542 μg/kg)中的总迁移浓度均无显著差异。此外,包括p-CA在内的一些化合物在乙醇溶液中的迁移行为会减弱,这与已发表文献的结果一致[32]。
为了进一步分析不同模拟溶液之间的差异,根据PAAs的浓度进行主成分分析(PCA),PCA结果如图2所示。根据PCA结果,前2个主成分(PC1和PC2)占79.96%的变异度,这表明PAAs浓度中包含的信息在PCA图中得到了较好体现。可以得出结论,PAAs在溶液A中的迁移可以通过p-TOL、p-CA和3,5-DCA来表征,表明这些PAAs在模拟液A中表现出不同的迁移特征。同样,模拟液C和D中PAAs的迁移可以通过DANP、o-TLD来表征。溶液B的样点分布与其他模拟液相距较远,说明溶液B呈现出不同的迁移特性。根据表4可知,溶液B中PAAs的迁移量普遍低于其他模拟物,溶液B中绝大部分PAAs的迁移量最低。
表3 文中方法检测PAAs的线性范围、线性拟合方程、LOD、LOQ及回收率
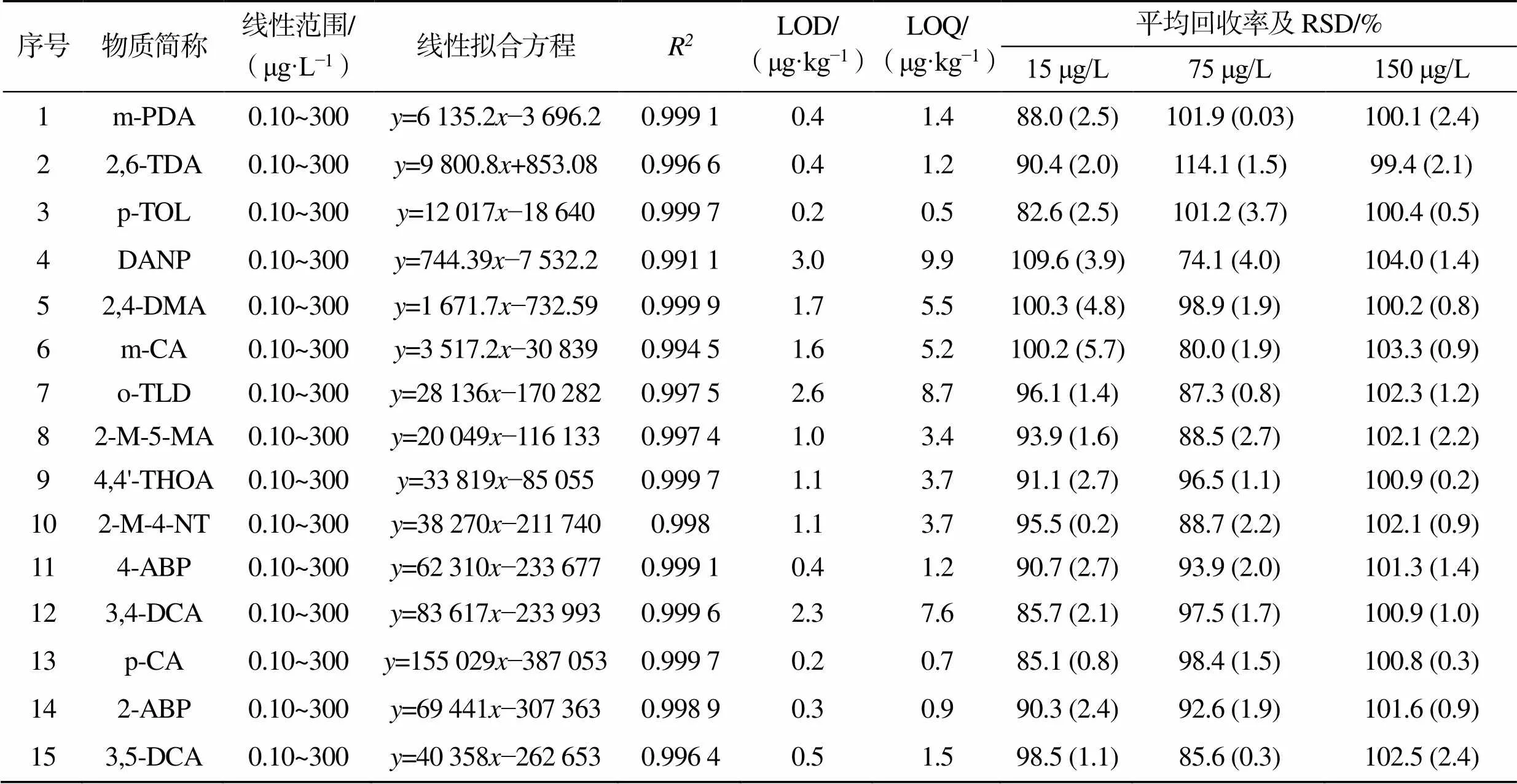
Tab.3 Linearity ranges, linear fitting equations, LODs, LOQs and recoveries of PAAs detected with methods mentioned in the paper
表4 4种食品模拟液中的PAAs浓度和迁移量

Tab.4 Concentrations and migrations of PAAs obtained in four simulant solutions
注:模拟溶液A、B、C、D分别为蒸馏水、酒精(10%)/水、醋酸(3%)/水、橄榄油;结果用平均值±标准差表示;“/”表示浓度低于LOQ;同一行不同的上标(a、b、c、d)表示具有统计学差异(<0.05)。
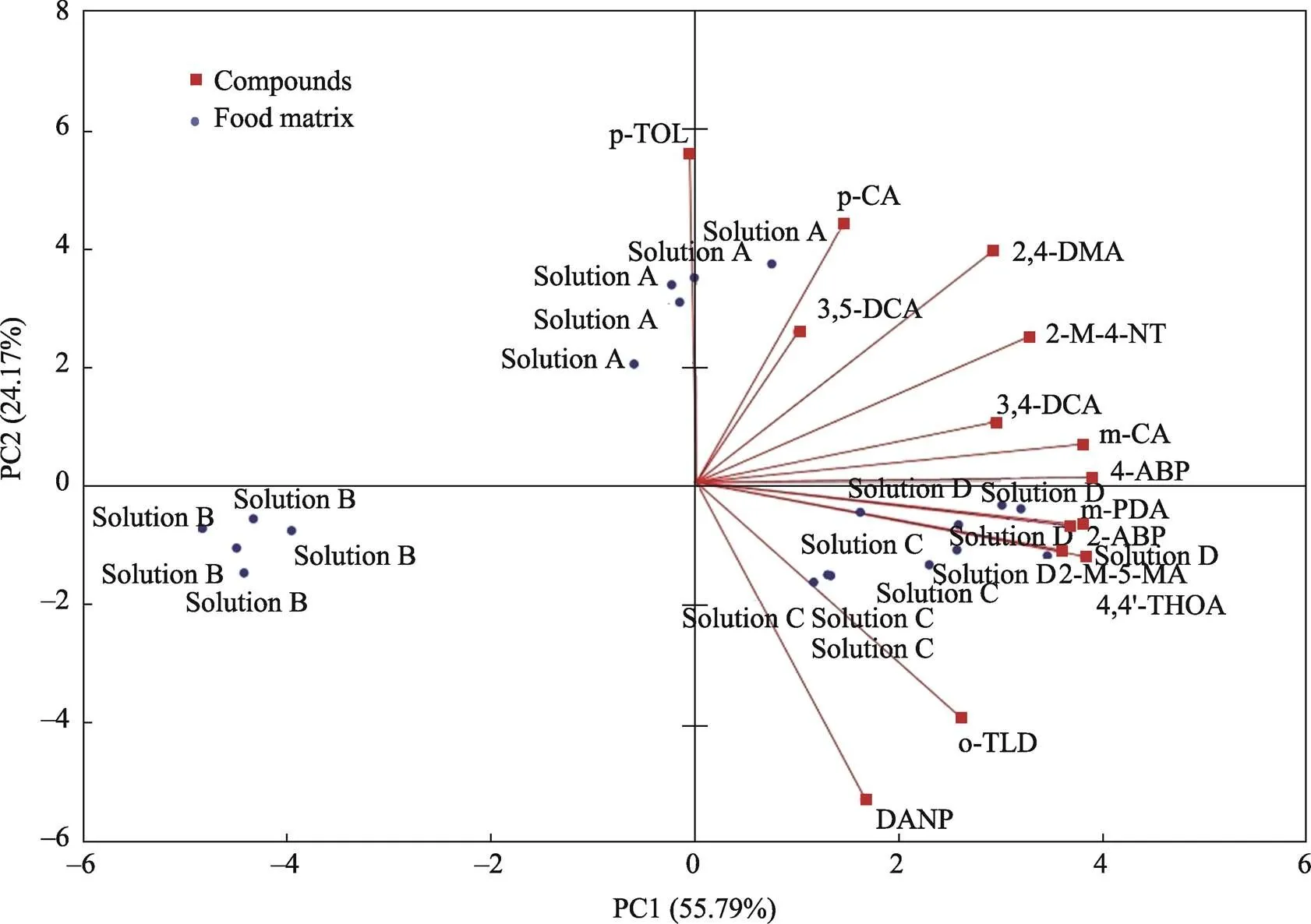
图2 不同模拟液中PAAs浓度的主成分分析
根据欧盟委员会的规定,在食品或食品模拟物中PAAs的检出限为0.01 mg/kg[14]。这里除DANP(1,5−二氨基萘)和2,4-DMA(2,4−二甲基苯胺)外,其余PAAs从可生物降解餐具迁移到不同食品模拟物的浓度均小于0.01 mg/kg,符合欧盟委员会的规定。由于4种食品模拟物中所有15种PAAs的迁移浓度之和均大于浓度限值,因此这里使用的餐具并未完全达到标准要求,需要进一步完善可生物降解餐具的加工工艺。另一方面,消费者可以通过减少一次性餐具的使用频率和使用时间,将食品安全风险降至最低。
3 结语
建立了基于UPLC−MS/MS的食品基质中15种PAAs的鉴定检测方法,并将此方法应用于PAAs从可生物降解餐具到不同模拟物的迁移。UPLC−MS/MS的总运行时间为12 min,15种PAAs可在7 min内被分离。15种PAAs的LOD和LOQ分别在0.2~3.0 μg/kg和0.5~9.9 μg/kg范围内,符合法规要求(10 μg/kg)。结果表明,除DANP(1,5−二氨基萘)和2,4−DMA(2,4−二甲基苯胺)外,大多数的PAAs从可生物降解餐具迁移到不同食品基质的浓度均小于规定浓度。在使用过程中,可生物降解餐具内的PAAs能够迁移到食品基质中,具有潜在的食品风险,因此应进一步加强市场上食品包装材料中芳香胺迁移的检测与监管,从而降低包装材料对消费者健康的风险。
[1] MARTINO F, BROOKS R, BROWNE J, et al. The Nature and Extent of Online Marketing by Big Food and Big Alcohol during the COVID-19 Pandemic in Australia: Content Analysis Study[J]. JMIR Public Health and Surveillance, 2021, 7(3): e25202.
[2] PAPAPANAGIOTOU E P. Serious Notifications on Food Contact Materials in the EU RASFF[J]. Veterinary Sciences, 2021, 8(4): 56.
[3] SUN Qing, YI A-lan, NI Hong-gang. Evaluating Scenarios for Carbon Reduction Using Different Tableware in China[J]. Science of the Total Environment, 2021, 791: 148279.
[4] OLT J, MAKSAROV V V, SOOTS K, et al. Technology for the Production of Environment Friendly Tableware[J]. Environmental and Climate Technologies, 2020, 24(2): 57-66.
[5] LIU Chao, LUAN Peng-cheng, LI Qiang, et al. Biodegradable, Hygienic, and Compostable Tableware from Hybrid Sugarcane and Bamboo Fibers as Plastic Alternative[J]. Matter, 2020, 3(6): 2066-2079.
[6] CAI Jia-fang, PAN Ao-dong, LI Yi-lin, et al. A Novel Strategy for Enhancing Anaerobic Biodegradation of an Anthraquinone Dye Reactive Blue 19 with Resuscitation-Promoting Factors[J]. Chemosphere, 2021, 263: 127922.
[7] YU Xue-peng, CHEN Long, JIN Zheng-yu, et al. Research Progress of Starch-Based Biodegradable Materials: A Review[J]. Journal of Materials Science, 2021, 56(19): 11187-11208.
[8] CAMPANELLA G, GHAANI M, QUETTI G, et al. On the Origin of Primary Aromatic Amines in Food Packaging Materials[J]. Trends in Food Science & Technology, 2015, 46(1): 137-143.
[9] SANCHIS Y, COSCOLLÀ C, YUSÀ V. Comprehensive Analysis of Photoinitiators and Primary Aromatic Amines in Food Contact Materials Using Liquid Chromatography High-Resolution Mass Spectrometry[J]. Talanta, 2019, 191: 109-118.
[10] CHMIELEWSKI J, CHMIELEWSKI J, GWOREK B, et al. Primary Aromatic Amines (Paas) as a Threat to the Health of Consumers[J]. Journal of Elementology, 2021, 26(2): 463-473.
[11] PEREZ M Â F, PADULA M, MOITINHO D, et al. Primary Aromatic Amines in Kitchenware: Determination by Liquid Chromatography-Tandem Mass Spectrometry[J]. Journal of Chromatography A, 2019, 1602: 217-227.
[12] IARC Monographs Working Group on the Evaluation of Carcinogenic Risks to Humans.IARC Monographs on the Evaluation of Carcinogenic Risks to Humans[J]. World Health Organization, 2010, 99(6):1.
[13] GB 9685—2016, 食品安全国家标准食品接触材料及制品用添加剂使用标准[S].
GB 9685-2016, National Food Safety Standard - Standard for Uses of Additives in Food Contact Materials and Their Products[S].
[14] EU No. 10/2011, Plastic Materials and Articles Intended to Come into Contact with Food[S].
[15] EU No. 2020/1245, Amending and Correcting Regulation (EU) No. 10/2011 on Plastic Materials and Articles Intended to Come into Contact with Food[S].
[16] SANCHIS Y, YUSÀ V, COSCOLLÀ C. Analytical Strategies for Organic Food Packaging Contaminants[J]. Journal of Chromatography A, 2017, 1490: 22-46.
[17] SANCHIS Y, COSCOLLÀ C, ROCA M, et al. Target Analysis of Primary Aromatic Amines Combined with a Comprehensive Screening of Migrating Substances in Kitchen Utensils by Liquid Chromatography-High Resolution Mass Spectrometry[J]. Talanta, 2015, 138: 290-297.
[18] KHAN M R, NAUSHAD M, ALOTHMAN Z A, et al. Solid Phase Extraction and Ultra Performance Liquid Chromatography-Tandem Mass Spectrometric Identification of Carcinogenic/Mutagenic Heterocyclic Amines in Cooked Camel Meat[J]. RSC Advances, 2015, 5(4): 2479-2485.
[19] CHINTHAKINDI S, KANNAN K. A Liquid Chromatography-Tandem Mass Spectrometry Method for the Analysis of Primary Aromatic Amines in Human Urine[J]. Journal of Chromatography B, 2021, 1180: 122888.
[20] BREDE C, SKJEVRAK I, HERIKSTAD H. Determination of Primary Aromatic Amines in Water Food Simulant Using Solid-Phase Analytical Derivatization Followed by Gas Chromatography Coupled with Mass Spectrometry[J]. Journal of Chromatography A, 2003, 983(1/2): 35-42.
[21] CANALES R, GUIÑEZ M, BAZÁN C, et al. Determining Heterocyclic Aromatic Amines in Aqueous Samples: A Novel Dispersive Liquid-Liquid Micro-Extraction Method Based on Solidification of Floating Organic Drop and Ultrasound Assisted back Extraction Followed by UPLC- MS/MS[J]. Talanta, 2017, 174: 548-555.
[22] DEVREUX V, COMBET S, CLABAUX E, et al. From Pigments to Coloured Napkins: Comparative Analyses of Primary Aromatic Amines in Cold Water Extracts of Printed Tissues by LC-HRMS and LC-MS/MS[J]. Food Additives & Contaminants Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2020, 37(11): 1985-2010.
[23] PEREZ M Â F, DANIEL D, PADULA M, et al. Determination of Primary Aromatic Amines from Cooking Utensils by Capillary Electrophoresis-Tandem Mass Spectrometry[J]. Food Chemistry, 2021, 362: 129902.
[24] CHANG C C, KAO T H, ZHANG De-quan, et al. Application of QuEChERS Coupled with HPLC-DAD-ESI- MS/MS for Determination of Heterocyclic Amines in Commercial Meat Products[J]. Food Analytical Methods, 2018, 11(11): 3243-3256.
[25] CHEN Jing, HE Zhi-yong, QIN Fang, et al. Formation of Free and Protein-Bound Heterocyclic Amines in Roast Beef Patties Assessed by UPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2017, 65(22): 4493-4499.
[26] LAMBERTINI F, DI LALLO V, CATELLANI D, et al. Reliable Liquid Chromatography-Mass Spectrometry Method for Investigation of Primary Aromatic Amines Migration from Food Packaging and during Industrial Curing of Multilayer Plastic Laminates[J]. Journal of Mass Spectrometry, 2014, 49(9): 870-877.
[27] YAVUZ O, VALZACCHI S, HOEKSTRA E, et al. Determination of Primary Aromatic Amines in Cold Water Extract of Coloured Paper Napkin Samples by Liquid Chromatography-Tandem Mass Spectrometry[J]. Food Additives & Contaminants: Part A, 2016, 33(6): 1072-1079.
[28] DONG Hao, XIAN Yan-ping, LI Hai-xia, et al. Analysis of Heterocyclic Aromatic Amine Profiles in Chinese Traditional Bacon and Sausage Based on Ultrahigh-Performance Liquid Chromatography-Quadrupole- Orbitrap High-Resolution Mass Spectrometry (UHPLC- Q-Orbitrap-HRMS)[J]. Food Chemistry, 2020, 310: 125937.
[29] LIN Qin-bao, CAI Long-fei, WU Shao-jing, et al. Determination of Four Types of Hazardous Chemicals in Food Contact Materials by UHPLC-MS/MS[J]. Packaging Technology and Science, 2015, 28(5): 461-474.
[30] SZABÓ B S, JAKAB P P, HEGEDŰS J, et al. Determination of 24 Primary Aromatic Amines in Aqueous Food Simulants by Combining Solid Phase Extraction and Salting-out Assisted Liquid-Liquid Extraction with Liquid Chromatography Tandem Mass Spectrometry[J]. Microchemical Journal, 2021, 164: 105927.
[31] SANLLORENTE S, SARABIA L A, ORTIZ M C. Migration Kinetics of Primary Aromatic Amines from Polyamide Kitchenware: Easy and Fast Screening Procedure Using Fluorescence[J]. Talanta, 2016, 160: 46-55.
[32] OUYANG Xiao-kun, LUO Yu-yang, WANG Yang-guang, et al. Validation a Solid-Phase Extraction-HPLC Method for Determining the Migration Behaviour of Five Aromatic Amines from Packaging Bags into Seafood Simulants[J]. Food Additives & Contaminants: Part A, 2014, 31(9): 1598-1604.
Migration of 15 Primary Aromatic Amines from Biodegradable Tableware
MENG Heng-li1,2,HU Yun3,JIANG Shui1,2,PAN Yi-fan1,2,ZHANG Wei-yi4,LIU Yuan1,2
(1. School of Agriculture & Biology, Shanghai Jiao Tong University, Shanghai 200240, China; 2. Shanghai Engineering Research Center of Food Safety, Shanghai 200240, China; 3. Yangzhou Center for Food and Drug Control, Jiangsu Yangzhou 225000, China; 4. Shanghai Center of Agri-products Quality and Safety, Shanghai 200335, China)
The work aims to study the migration behavior of 15 primary aromatic amines (PAAs) in biodegradable tableware. Four different food simulant solutions were prepared for migration experiments. Qualitative and quantitative analyses were performed based on ultrahigh-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) to detect the migration of PAAs from biodegradable tableware to different food matrices. The total run time of UPLC-MS/MS was 12 min, and 15 PAAs could be separated within 7 min. The LODs and LOQs of different PAAs were between 0.2-3.0 μg/kg and 0.5-9.9 μg/kg, respectively, which met the requirement of legislation (10 μg/kg). The migration concentrations of most of PAAs migrated from the biode-gradable tableware to different food matrices were smaller than the required concentration except for the 1,5-diaminonaphthalene and 2,4-dimethylaniline. The PAAs in biodegradable tableware can migrate to food matrices during the usage, which is potentially harmful to consumers. The established method provides scientific support for reducing food safety risks by detecting PAAs migration amount in biodegradable tableware.
primary aromatic amine; biodegradable tableware; food matrices; migration; ultra-high-performance liquid chromatography-tandem mass spectrometry
TB487
A
1001-3563(2023)13-0166-09
10.19554/j.cnki.1001-3563.2023.13.020
2022−11−22
江苏省市场监督管理局科技计划(KJ207546);扬州市重点研发项目(现代农业)(YZ2020047)
孟恒立(1999—),男,硕士生,主攻食品感知科学。
姜水(1989—),男,博士,助理研究员,主要研究方向为食品感知科学。
责任编辑:彭颋
