高效分子排阻色谱法测定涉药品不良反应注射用曲克芦丁中多糖和蛋白类大分子物质
2023-07-14于德志李会轻
张 琪,于德志,高 倩,李会轻,杨 钊
(山东省青岛市食品药品检验研究院·国家药品监督管理局海洋中药质量研究与评价重点实验室,山东 青岛 266071)
曲克芦丁是在槐米等植物部位提取的芦丁经羟乙基化制成的半合成黄酮类化合物,常用于抑制红细胞和血小板凝聚,防止血栓形成,改善微循环,增加血氧含量,促进新血管形成及侧支循环建立,保护血管内皮细胞,降低毛细血管通透性[1-2]等,也常用于治疗缺血性脑血管静脉炎及血管通透性增高所致水肿、骨关节炎等症[3-4]。临床应用时监测到3 批注射用曲克芦丁的药品不良反应(ADR)聚集性信号,患者均有寒战、发热(体温最高39.3 ℃)等临床表现,并偶见血压降低等过敏性休克。监管部门怀疑该品种存在热原反应风险,但按其现行质量标准[5]检验,细菌内毒素低于标准规定限度,且其他质量标准项目均符合规定。故对3 批涉ADR和3 批正常注射用曲克芦丁制剂进行了一系列质量安全性再评价。先进行了内毒素动态浊度法研究,3 批涉ADR 样品中有2 批的内毒素含量高于同测的3 批正常样品的10 倍,且接近限值,质量风险差异明显[6]。在此基础上,基于ADR 报告提及的过敏性休克及呼吸困难症状,进行了2020 年版《中国药典(四部)》豚鼠主动过敏反应研究[7],结果均为阴性。考虑到该方法灵敏度较差,又采用了较高灵敏度的直接多肽反应试验(DPRA)[8]对本次涉ADR 制剂进行了致敏性预测研究,结果均为阴性。DPRA 多用于预测小分子致敏,存在一定局限性,且有研究报道中药注射剂在输液过程中有微粒增加嫌疑,而微粒异物也是热原样反应和过敏反应等发生的原因[9-11]。曲克芦丁的制备具有天然产物来源特性,使其易残留大分子物质,故本研究中建立了高效分子排阻色谱(HPSEC)法对涉ADR 注射用曲克芦丁中多糖和蛋白类大分子物质进行筛查,以分析ADR 发生原因。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1100 series 型高效液相色谱仪(美国Agilent公司),配有示差折光检测器和紫外检测器;BT125D 型电子天平(赛多利斯科学仪器<北京>有限公司);CF16RXⅡ型多用途离心机(日本Hitachi公司)。
1.2 试药
注射用曲克芦丁(规格为每支0.1 g,涉ADR 批号分别为ADR-007,ADR-206,ADR-407,正常批号分别为NORM-106,NORM-107,NORM-207),曲克芦丁原料药(批号为YL-417),四羟乙基芦丁(单独制备,批号为4Q-016),均由国内A 公司提供;曲克芦丁原料药(国内B公司,批号为XD-081);右旋糖酐对照品[批号为140637 - 646 - 201203,D6(Mp 64 650),D7(Mp 135 350),D8(Mp 300 600)],核糖核酸酶A(批号为140653 - 201806,Mp 13 700),人胰岛素(批号为140654-201806,Mp 5 808),胸腺肽α1(批号为140655-201806,Mp 3 108),生长抑素(批号为140656-201806,Mp 1 638),均购自中国食品药品检定研究院;牛血清白蛋白(BSA,Solar Life Science,批号为929F052,相对分子质量为66 000);乙腈、三氟乙酸(美国Thermo Fisher公司);甘露醇(国药集团化学试剂有限公司)。
2 方法与结果
2.1 多糖检测
2.1.1 色谱条件
色谱柱:TSKgel G4000PWXL 凝胶柱(300 mm ×7.8 mm,10 μm);检测器:示差折光检测器;流动相:纯化水;流速:0.5 mL/ min;柱温:35 ℃;进样量:10 μL(对照品溶液),50 μL(供试品溶液)。
2.1.2 溶液制备
对照品溶液:取右旋糖酐对照品(D6,D7,D8)适量,精密称定,分别加水制成质量浓度为1 mg/mL 的溶液,备用。
供试品溶液:取样品1支,加水3 mL使溶解,取1 mL,置3 000 Da 超滤离心管中,离心(转速为7 450 r/ min,温度为19 ℃)40 min,取出离心管,去除下层液体,上层液体用3~5 mL水冲洗(用移液枪吹打混匀),再离心35~40 min,重复2~3次,直至下层液体Molish反应呈阴性,将上层超滤管中的残留液体用水定容至5 mL,待测。
2.1.3 方法学考察
线性关系考察:吸取2.1.2 项下对照品溶液适量,按2.1.1 项下色谱条件进样测定,记录色谱图,结果右旋糖酐对照品(D6,D7,D8)保留时间(tR)分别为17.690,16.481,15.473 min。以对照品相对分子质量的对数(Y)为纵坐标、tR(X)为横坐标进行线性回归,得回归方程Y= - 3.316 3X+ 33.594,R2= 0.994 5。结果表明,右旋糖酐的相对分子质量在64 650~300 600 范围内与tR线性关系良好。
检测限确定:取右旋糖酐对照品(D6)适量,精密称定,加水制成质量浓度为0.102 mg/mL 的溶液,逐级稀释,按2.1.1项下色谱条件进样测定,以信噪比(S/N)为3∶1时的进样量确定检测限。结果检测限为0.102 μg。
精密度试验:取2.1.2项下右旋糖酐对照品(D6)溶液适量,按2.1.1项下色谱条件重复进样测定6次,记录tR。结果的RSD为1.49%(n=6),表明仪器精密度良好。
稳定性试验:取2.1.2 项下右旋糖酐对照品(D6)溶液适量,分别于0,2,4,6,8,12 h时按2.1.1项下色谱条件进样测定,记录tR。结果的RSD为1.76%(n=6),表明待测溶液在12 h内稳定性良好。
2.1.4 样品中多糖测定
分别取涉ADR(批号分别为ADR-007,ADR-206,ADR-407)和正常(批号分别为NORM-106,NORM-107,NORM-207)样品,按2.1.2 项下方法制备供试品溶液,按2.1.1 项下色谱条件进样测定,记录tR和峰面积。结果6批制剂均在15.5 min出现1个吸收峰,经比较发现该样品峰与右旋糖酐对照品(D8)吸收峰(tR=15.473 min,峰面积为223 345.0)的位置基本一致,表明样品中所含多糖类大分子物质的相对分子质量约为300 000。从样品的tR和峰面积看(表1),涉ADR 样品与正常样品的数据无明显差异,表明涉ADR样品发生质量安全风险的原因与多糖类大分子物质无关。同法测定甘露醇,发现于15.5 min出现1个吸收峰,与样品峰基本重合,可见该峰很有可能由辅料甘露醇引入。涉ADR 样品(批号为ADR-206)、正常样品(批号为NORM-106)、甘露醇、右旋糖酐对照品(D8)的HPLC图见图1。
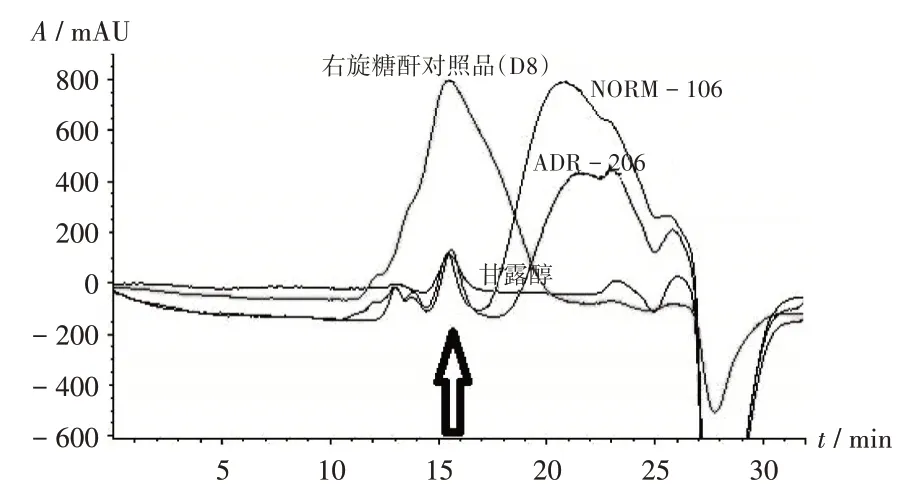
图1 涉ADR样品(批号为ADR-206)、正常样品(批号为NORM-106)、甘露醇及右旋糖酐对照品(D8)高效液相色谱图Fig.1 HPLC chromatogram of ADR-related samples(batch number:ADR-206),normal samples(batch number:NORM-106),dannitol and dextran(D8)reference substance
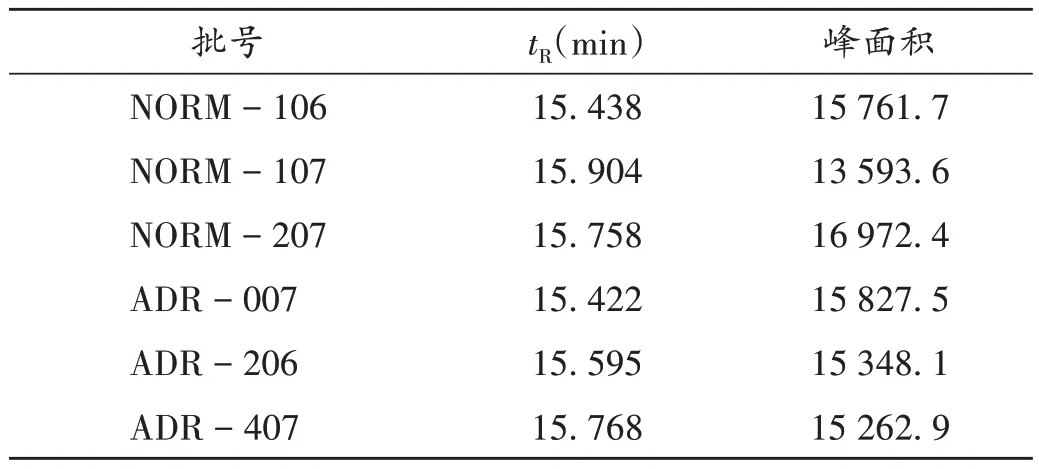
表1 涉ADR样品、正常样品的保留时间和峰面积Tab.1 Retention time and peak area of ADR - related and normal samples
2.2 蛋白检测
2.2.1 色谱条件
色谱柱:TSKgel G2000SWXL 凝胶柱(300 mm ×7.8 mm,10 μm);流动相:乙腈-水-三氟乙酸(45∶55∶0.05,V/V/V);流速:0.8 mL/ min;检测器:紫外检测器;检测波长:214 nm;进样量:10 μL(对照品溶液),50 μL(供试品溶液)。
2.2.2 溶液制备
对照品溶液:分别取生长抑素、胸腺肽α1、人胰岛素、核糖核酸酶A 各1 mg,精密称定,分别置5 mL 容量瓶中,加水溶解并定容,摇匀,即得。取BSA 1 mg,精密称定,加水制成质量浓度为0.1 mg/mL的溶液。
供试品溶液:取样品1支,加水3 mL使溶解,取1 mL,置3 000 Da 超滤离心管中,离心(转速为7 450 r/ min,温度为19 ℃)40 min,上层液体约剩余400 μL,加水3~5 mL 冲洗(用移液枪吹打混匀),弃去下层液体,再离心35~40 min,重复2~3 次,直至下层液体Molish 反应阴性,将上层超滤管中的残留液体定容至5 mL,即得。
2.2.3 方法学考察
线性关系考察:吸取2.2.2 项下对照品溶液各适量,加水稀释成一定浓度的系列对照品溶液,按2.2.1项下色谱条件进样测定,记录色谱图。结果BSA、核糖核酸酶A、人胰岛素、胸腺肽α1、生长抑素的tR分别为6.927,8.141,9.003,9.811,10.252 min。以对照品相对分子质量的对数(Y)为纵坐标、tR为横坐标进行线性回归,得回归方程Y= - 2.129 3X+ 17.100 1,R2= 0.991 7。结果表明,蛋白类大分子物质的相对分子质量在1 638~66 000范围内与tR线性关系良好。
检测限确定:取生长抑素对照品,精密称定,加水制成质量浓度为0.177 mg/ mL 的溶液,混匀,逐级稀释,按2.2.1项下色谱条件进样测定,记录色谱图,以信噪比(S/N)为3∶1时的进样量确定检测限。结果检测限为0.003 6 μg。
精密度试验:精密量取质量浓度为1 mg/mL 的核糖核酸酶A 对照品溶液,按2.2.1 项下色谱条件重复进样测定6 次,记录tR。结果的RSD为0.34%(n=6),表明仪器精密度良好。
稳定性试验:精密吸取质量浓度为1 mg/mL 的人胰岛素对照品溶液,分别于0,2,4,6,8,12 h 时按2.2.1项下色谱条件进样测定,记录tR。结果的RSD为0.42%(n=6),表明待测溶液在12 h内稳定性良好。
2.2.4 样品中蛋白测定
分别取涉ADR(批号分别为ADR-007,ADR-206,ADR-407)和正常(批号分别为NORM-106,NORM-107,NORM-207)样品,按2.2.2 项下方法制备供试品溶液,按2.2.1 项下色谱条件进样测定,记录色谱图(图2),涉ADR的3批样品的吸收峰面积均显著高于3批正常样品,核糖核酸酶A对照品的tR为8.141 min,峰面积为3 139.041 3。由表2 可知,涉ADR 样品中蛋白类大分子物质的含量为正常样品的3倍,样品中所含蛋白类大分子物质的吸收峰与核糖核酸酶A对照品峰tR相近,推测涉ADR 样品中蛋白类大分子物质的相对分子质量约为13 700。

S. 核糖核酸酶A对照品溶液 A - F. 供试品溶液(批号分别为ADR - 007,ADR-206,ADR-407,NORM-106,NORM-107,NORM-207)图2 高效液相色谱图S.Ribonuclease A reference solution A-F.Test solution(batch numbers:ADR - 007,ADR-206,ADR-407,NORM-106,NORM-107,and NORM-207,respectively)Fig.2 HPLC chromatograms
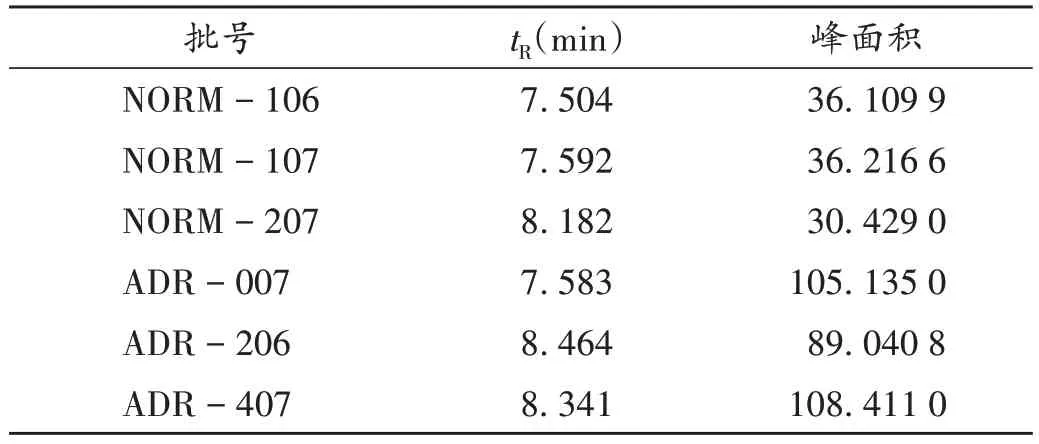
表2 涉ADR样品、正常样品的保留时间和峰面积Tab.2 Retention time(tR)and peak area of ADR - related and normal samples
为进一步考察注射用曲克芦丁制剂原辅料中蛋白类大分子物质的含量,取2 批(批号分别为YL - 417,XD-081)原料药、1批四羟乙基芦丁(批号为4Q-016),加入甘露醇和BSA 对照品,依法制备供试品溶液,按2.2.1 项下色谱条件进样测定,记录色谱图(图3)、tR及峰面积(表3)。可见,制剂对应原料厂家的曲克芦丁原料药中蛋白类大分子物质的含量远高于同测第三方厂家的20 倍;四羟乙基芦丁中蛋白类大分子物质的含量远低于曲克芦丁原料药,可能与单独小批量生产质量控制严格有关;甘露醇同条件下蛋白类大分子物质的含量也极低,此处无参考价值。从吸收峰tR来看,2 批曲克芦丁原料药及四羟乙基芦丁中吸收峰位置的蛋白类大分子物质的相对分子质量均小于BSA的66 000,大于核糖核酸酶A的13 700。

A.BSA B. 核糖核酸酶A对照品 C,D. 曲克芦丁原料药(批号分别为YL-417,XD-081) E. 甘露醇 F. 四羟乙基芦丁(批号为4Q-016)图3 原辅料与对照品溶液高效液相色谱图A.BSA B.Ribonuclease A reference substance C,D.Raw material of troxerutin(batch number:YL-417,XD-081) E.Mannitol F.Tetrahydroxyethyl rutin(batch number:4Q-016)Fig.3 HPLC chromatograms of raw materials and reference solution

表3 原辅料与对照品的保留时间和峰面积Tab.3 Retention time(tR)and peak area of materials and reference materials
3 讨论
注射用曲克芦丁为中药注射剂,其主成分曲克芦丁有天然产物来源特性,制备过程中易引入大分子物质。大分子物质通过静脉直接进入体内后有足够时间与免疫细胞直接接触而激活免疫反应,形成抗原,且分子量越大,抗原性越强。注射用曲克芦丁制剂有效成分曲克芦丁相对分子质量为742.69,辅料甘露醇相对分子质量为182.172,均小于1 000,而该品种现行法定质量标准中无大分子物质质控指标,不排除涉ADR 批次注射用曲克芦丁过敏性休克等为致敏作用引发的可能性,故本研究中对该制剂及其原辅料中大分子物质进行了测定与分析。
首先,采用HPSEC 法测得注射用曲克芦丁涉ADR样品中所含蛋白类大分子物质明显高于正常样品,其相对分子质量大于13 700,远大于主成分和辅料的相对分子质量,按峰面积算约为正常样品含量的3 倍。进一步对原辅料大分子物质进行分析发现,涉ADR 样品对应原料厂家提供的曲克芦丁原料药蛋白类大分子物质含量远高于第三方厂家提供原料药的20 倍,且其相对分子质量在13 700~66 000 范围内。综合考虑,可基本确认注射用曲克芦丁制剂发生ADR 的原因为产品中蛋白类大分子物质含量偏高所致,且含量偏高可能由其原料药导致,同时生产中活性炭及微孔滤芯等关键环节大分子物质去除工艺也存在缺陷。绝大多数蛋白质是很好的抗原[12],但大分子蛋白可升高组胺等活性介质水平而诱发过敏[13-14]。结合前期研究涉ADR 样品中细菌内毒素含量偏高,不排除样品中测得大分子蛋白质结构可能类似内毒素,引发热原或类热原效应。
药品生产各环节的质量控制和验证都是极关键的步骤。大分子物质的控制必须保证入厂原辅料质量把关、生产工艺品控关键点应有效。注射剂大分子物质临床应用时直接进入血液,极可能导致速发型超敏反应[15],但高分子杂质具有高度不均一性和不确定性,且其本身不稳定,去除和定量均存在难度。针对产生该状况的原因,原辅料入厂质量把关及生产工艺中各环节关键点的质量控制至关重要。原辅料入厂时应建立适宜大分子物质的测试方法,严把质量关;实际生产过程中,活性炭吸附[16]或两级微孔超滤系统[17]是去除大分子物质的主要环节,故应关注生产环节活性炭吸附率是否达标或去除干净[18],超滤是否及时更换或有无漏点,验证工作是否满足质控要求。着力改进、优化生产工艺流程对去除大分子物质、减少注射剂过敏反应有积极意义[19],生产中宜对中间产品和终端产品就大分子物质建立适宜的测试方法进行质量把控或风险评估。
