苗药杆努尽烟对慢性阻塞性肺疾病大鼠糖皮质激素耐药作用的分子机制*
2023-07-13占雅婷雷昆彧刘娇娇吴宁
占雅婷, 雷昆彧, 刘娇娇, 吴宁*
(贵州医科大学 基础医学院化学与生物化学实验室, 贵州 贵阳 550025)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是目前世界上影响人类生活质量的4大慢性病之一[1-2]。糖皮质激素(glucocorticoid, GC)作为一种高效的抗炎药物,广泛应用于COPD的临床治疗,但部分病人出现了不敏感现象而导致疗效不佳[3]。近年来随着对GC药物耐药机制研究的不断深入,P38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase, P38MAPK)信号通路被认为在GC抵抗中承担不可或缺的桥梁作用,相关的上下游因子及基因位点参与调控GC抵抗[4-7]。一方面,P38MAPK信号通路与GC受体(GC receptor, GR)相互调节介导炎症因子的激活[8];另一方面,P38MAPK信号通路影响GC对GR的敏感性[9-13]。近年来,植物化学物质和传统化疗药物的组合疗法逐渐应用于COPD患者的耐GC治疗,且有一定的疗效[14]。杆努尽烟是贵州苗族地区治疗COPD的传统药物,应用历史悠久、疗效独特、毒副作用小,尚处于经验用药阶段[15]。课题组前期研究已经证明,杆努尽烟可通过调节P38MAPK上游的Toll样受体4-髓样分化因子88(toll-like receptor4-myeloid differentiation factor88, TLR4-MyD88)介导相关炎症通路,减少炎症因子的分泌,降低气道炎症反应[16-19]。本研究采用杆努尽烟、地塞米松及两者联合用药对COPD大鼠进行对比治疗,观察大鼠肺组织的病理变化、白细胞介素-2(interleukin-2, IL-2)含量及P38MAPK、热休克蛋白90(heat shock protein90, HSP90)、GR-α mRNA及蛋白质的表达,探究苗药杆努尽烟对COPD大鼠GC治疗的敏感性的潜在作用机制,为该药的开发利用提供一定的实验基础。
1 材料与方法
1.1 实验材料
1.1.1动物及药物来源 50只清洁Specific Pathogen Free(SPF)级、7~8周龄Sprague-Dawley(SD)大鼠,雌雄各半,体质量(200±20)g,由学校动物中心提供[SYXF(黔)2018-0001];杆努尽烟全草采摘于凯里市炉山镇,经贵州省中医药大学潘炉台教授鉴定属植物吊石苣苔(LysionotusPauciflorusMaxim.),地塞米松磷酸钠注射液(贵州天地药业,国药准字H52020477)。
1.1.2主要试剂及仪器 遵义牌香烟,脂多糖(lipopolysaccharide, LPS;美国Sigma),热休克蛋白90(heat shock protein, HSP90)兔抗大鼠一抗、β-action(华安生物),GR-α兔抗大鼠一抗、P38MAPK兔抗大鼠一抗,辣根过氧化物酶(horseradish peroxidase, HRP)标记山羊抗兔免疫球蛋白G(immunoglobulin G, IgG)二抗(美国Bioworld公司);实时荧光定量PCR仪(美国ABI stepone plus),超微量紫外可见光分光光度计(美国ThermoNanoDrop/ND2000),BOX F3凝胶成像系统(英国Syngene/G),RA-2000全自动生化分析仪(美国Technicon),涡旋震荡仪(美国Scientific Industries),高压消毒锅(日本HIRAYAMA),台式高速离心机(美国Thermo),超速离心机(美国Optima XPN-100)。
1.2 实验方法
1.2.1苗药杆努尽烟水提液的制备 SD大鼠与人用药体表面积换算得需制取8 g/kg的杆努尽烟水提物。称取杆努尽烟全草1 kg,纱布包裹,置于恒温水浴箱,水至淹没药材,90 ℃连续提取10 h;收集、过滤、旋蒸水提液,浓缩成1 kg/L的杆努尽烟水提物,分装药液于4 ℃冰箱储藏[19]。
1.2.2大鼠分组及COPD大鼠模型的建立 SD大鼠采用随机分为对照组、模型组、杆努尽烟组、地塞米松组及联合用药组,10只/组,适应性饲养14 d,对照组置于正常无烟环境中常规饲养,后4组大鼠置于自制被动吸烟染毒箱(50 cm×40 cm×30 cm,上壁留有通气孔、将10 mL针筒改装为体外吸烟装置),采用烟熏结合LPS气管注射法复制COPD大鼠模型[20-21];造模需28 d,第1天和第14天以8%水合氯醛(0.05 mL/kg)腹腔内注射麻醉大鼠,气道内注射200 g/L LPS溶液0.2 mL,当天不予香烟烟熏,其余时间烟熏30 min/次(每箱放置4个进烟口),2次/d、早晚各1次;造模结束后,每组取2只大鼠肺部标本制作苏木精-伊红染色法(hematoxylin-eosin staining, HE)切片,在光学显微镜下,观察完整的中小支气管横断面,切片见部分支气管、肺泡坏死,上皮细胞坏死脱落于管腔,胞核溶解,坏死区见炎性细胞浸润,以淋巴细胞为主,伴少量纤维组织增生,提示造模成功[22]。
1.2.3给药干预 各组大鼠适应性喂养14 d、开始造模时即给予干预:对照组大鼠不作任何处理,正常饲养;模型组大鼠用生理盐水灌胃,1次/d、2 mL/只,共28 d;杆努尽烟组大鼠用杆努尽烟水提液灌胃,1次/d,8 g/kg,共28 d;地塞米松组大鼠雾化吸入地塞米松,1次/d、0.1 mg/只,共28 d;联合用药组大鼠用杆努尽烟灌胃联合地塞米松雾化吸入,杆努尽烟8 g/kg、地塞米松0.1 mL/只,共28 d。
1.3 观察指标
1.3.1呼吸系统症状观察及肺组织的收集 观察实验过程中5组大鼠呼吸系统症状,包括有无喘息、咳嗽、体质量减轻、活动量减少及毛发光泽度下降等。5组大鼠腹腔注射麻醉剂水合氯醛后心脏取血,血液样本旋转离心制得血清,用于酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测;取血后注射过量麻醉剂处死,取肺组织,用生理盐水冲洗后,左肺上叶固定于10%甲醛,右肺经液氮处理后置于-80 ℃冰箱保存,用于后续指标检测。
1.3.2大鼠肺组织切片组织学变化 取“1.3.1”项下各组大鼠肺门根部取组织2 g固定于4%多聚甲醛溶液,经脱水、修剪、包埋、切片、HE染色、封片后镜检。
1.3.3大鼠肺组织中IL-2含量 取“1.3.1”项下各组大鼠新鲜肺组织50 mg,剪碎,加磷酸缓冲盐溶液(phosphate buffer saline, PBS)于研磨器中充分研磨,4 ℃的条件下5 000 r/min离心10 min,取上清液,按照ELISA试剂盒说明书检测IL-2表达水平。
1.3.4大鼠肺组织P38MAPK、GR-α及HSP90mRNA表达 取“1.3.1”项下各组大鼠肺组织样本后,制备肺组织匀浆,提取总RNA,对RNA浓度的测定及逆转录;逆转录的DNA进行PCR扩增,凝胶电泳后进行凝胶图像分析;TRIZOL法提取主动脉总RNA,提取的RNA通过B-500超微量分光光度计测定其浓度和纯度,通过凝胶电泳测定RNA完整度;使用逆转录试剂盒以RNA为模板合成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),其中,孵育条件为42 ℃ 2 min、50 ℃ 15 min,终止反应条件为85 ℃ 5 s,设计引物和引物序列见表1。Real-time PCR反应条件为5 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s、40个循环,95 ℃ 15 s,60 ℃,95 ℃ 15 s;反应完成后,测定扩增循环数(cycle threshold,Ct)、熔融曲线(每个样品重复检测3次);以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,用2-ΔΔCt法计算各基因的相对表达量;PCR扩增后,凝胶电泳后进行凝胶图像分析。

表1 GR-α、P38MAPK、HSP90及GAPDH引物序列Tab.1 Primer sequences of GR-α, P38 MAPK, HSP90 and GAPDH
1.3.5大鼠肺组织P38MAPK、GR-α及HSP90蛋白表达 取“1.2.4”项下各组大鼠肺组织20 mg充分淹没于裂解液200 μg,二辛可宁酸含量测定(bicinchoninic acid assay,BCA)蛋白浓度检测定量蛋白浓度;取总蛋白40 μg,5×样品缓冲液配平上样液,沸水浴10 min;配置10%分离胶、5%浓缩胶,凝固胶后拔出梳齿上样;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate poly acrylamide gel electrophoresis, SDS-PAGE)电泳,浓缩胶45 min、80 V,分离胶60 min、120 V;根据分子量大小进行切胶,聚偏二氟乙烯膜(polyvinylidenefluoride,PVDF)膜转膜,90 min、120 mA恒流;5%三羟甲基氨基甲烷缓冲盐水与补间液(tris buffered saline with tween,TBST)加至脱脂奶粉封闭1 h,4 ℃一抗孵育过夜;1×TBST漂洗液洗PVDF膜6次,5 min/次,加二抗配制液,摇床孵育2 h;取膜,回收二抗,1×TBST溶液洗涤6次,5 min/次;PVDF膜置于增强型化学发光剂(enhanced chemiluminescence,ECL)液中,用凝胶成像系统显影并分析条带灰度值,比较各目的条带与β-action的蛋白相对表达量。
1.4 统计学分析
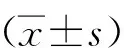
2 结果
2.1 呼吸系统症状
与对照组相比,杆努尽烟组、地塞米松组、模型组及联合用药组大鼠均有不同程度的喘息、咳嗽、精神状态不佳,其中联合用药组呼吸系统症状最轻。
2.2 大鼠肺组织的特征
给药28 d结束时,对照组大鼠肺组织见各级支气管结构正常,支气管纤毛上皮排列整齐,肺泡上皮细胞正常,肺间质未见明显纤维组织增生及炎性浸润;模型组大鼠肺组织见支气管结构受损,管腔狭窄,局部肺泡隔轻微增厚,支气管上皮细胞脱落,管腔内可见脱落细胞碎片,支气管或血管周围可见大量淋巴细胞浸润;杆努尽烟组大鼠肺组织见支气管结构轻度变形,上皮细胞少量脱落,炎细胞增生情况缓解;地塞米松组大鼠肺组织支气管结构改变,部分纤毛上皮脱落,少量淋巴细胞和泡沫细胞浸润;联合用药组大鼠肺组织见支气管上皮细胞脱落有所改善,炎细胞增生情况缓解。见图1。
注:绿色箭头表示炎细胞浸润,黄色箭头表示泡沫细胞。图1 各组大鼠肺组织切片(HE,×100)Fig.1 Lung tissue sections of rat in each group(HE,×100)
2.3 血清IL-2含量
ELISA法检测结果显示(表2),模型组、杆努尽烟组、地塞米松组和联合用药组大鼠血清IL-2含量均较对照组明显升高(P<0.01),其中,联合用药组IL-2指标最接近对照组水平;与模型组相比,杆努尽烟组、地塞米松组大鼠血清IL-2含量均降低(P<0.05)。

表2 各组大鼠血清中IL-2水平Tab.2 Serum IL-2 levels of rat in each
2.4 肺组织中P38MAPK、GR-α及HSP90 mRNA的表达
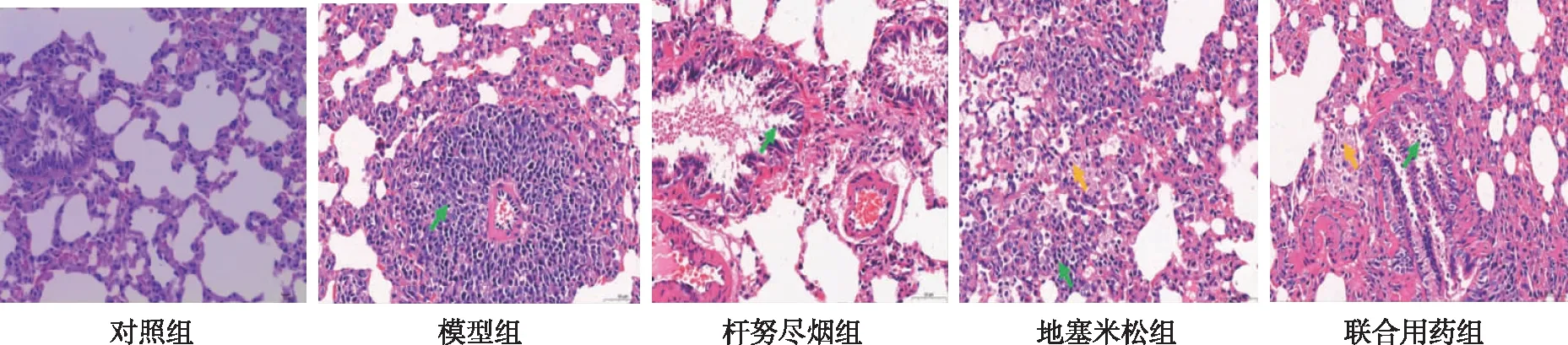
给药第28天时,与对照组比较,其余各组大鼠肺组织中P38MAPK、GR-α及HSP90 mRNA表达升高(P<0.05) ,以模型组增加最为明显;与模型组相比,各给药组大鼠肺组织P38MAPK、GR-α及HSP90 mRNA表达有不同程度降低(P<0.05),其中以联合用药组降幅最大。见图2。
注:(1)与对照组比较,P<0.05;(2)与模型组比较,P<0.05。图2 各组大鼠肺组织P38MAPK、GR-α及HSP90mRNA表达Fig.2 Expression of P38MAPK, GR-α, and HSP90 mRNA in rat lung tissues in each group
2.5 肺组织中P38MAPK、GR-α及HSP90蛋白的表达
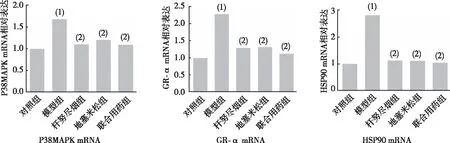
Western blot法检测结果显示(图3),与对照组相比,模型组、杆努尽烟组、地塞米松组及联合用药组大鼠肺组织中P38MAPK、GR-α表达均上升,其中联合用药组最接近对照组水平(P<0.05);与模型组相比,杆努尽烟组、地塞米松组及联合用药组大鼠肺组织HSP90蛋白表达均接近对照组,其中联合用药组相对表达最少(P<0.05)。
注:A为Western blot法检测结果,B为Western blot法定量结果;(1)与对照组比较,P<0.05;(2)与模型组比较,P<0.05。图3 各组大鼠肺组织P38MAPK、GR-α及HSP90蛋白表达Fig.3 Protein expression of P38 MAPK, GR-α, and HSP90 in rat lung tissues in each group
3 讨论
临床中,GC药物因具有强大的抗炎作用,而被广泛应用于慢性气道炎症的治疗,发挥其抗炎、抗免疫的作用[5, 10]。但是部分患者存在对激素不敏感或抵抗现象,不利于疾病的治疗和病情的控制。P38MAPK信号通路可被广泛炎症因子激活,其是促炎细胞因子转录和翻译分子水平上关键的信号调节通路,这使得P38MAPK同路的不成组成部分称为治疗自身免疫性和炎症性疾病的潜在靶点[11-12,23]。人类GR的丝氨酸226号位处有一个共识的P38MAPK磷酸化序列,这可能是P38MAPK信号通路对GR的直接影响位点。
贵州省苗药资源丰富,苗族习惯用杆努尽烟治疗COPD,疗效显著,且苗药具有对成分、多靶点、多途径及低毒副作用等特点[15]。现代药理学研究表明,杆努尽烟中含有黄酮类、苯乙醇类、β-谷甾醇及熊果酸等有机化学成分,有良好的抗炎止咳作用[19,24]。本研究在前期研究的基础上[18-19],进一步探究杆努尽烟是否通过P38MAPK信号通路途径改善GC对COPD疗效,并为其临床应用提供理论支持和基础数据。
本研究结果显示,联合药物组治疗后,大鼠肺部病理状态得到一定的改善,支气管上皮细胞脱落减少,炎症细胞数有所下降;与杆努尽烟组和GC组相比,联合用药组大鼠肺组织匀浆中P38MAPK表达下调,GR-α、IL-2表达升高(P<0.05),提示杆努尽烟能降低P38MAPK的表达含量,并抑制IL-2的分泌,在一定程度上局限炎症蔓延,提高COPD大鼠GC治疗的敏感性。据此推测,杆努尽烟可能是通过干预IL-2的分泌、抑制P38MAPK的活性、增加GR与HSP90等解离及自身构像的改变启动核转位信号,进而增加激素和脱氧核糖核苷酸-GC效应元件(deoxyribonucleic acid-glucocorticoidresponseelement,DNA-GRE)的结合稳定性、核转移能力及与上游信号因子(如转录因子)之间的相互作用能力。
综上所述,P38MAPK信号通路的过度激活是降低GC敏感性的主要信号通路之一;多种炎症因子通过激活P38MAPK信号通路,调控细胞内核转位信号,导致GC抵抗。因此,调节细胞内P38MAPK可能是克服GC抵抗的重要方法。值得注意的是,在本研究中苗药杆努尽烟与GC联合治疗COPD大鼠,可以减少大鼠肺组织IL-2分泌、下调P38MAPK水平、提高GR-α和HSP90水平。因此,可以认为杆努尽烟对GC产生允许作用,增加其对GC敏感性,抑制急性发病期气道炎症的进展,发挥协同治疗作用。两者联合使用有望成为克服GC治疗不敏感型COPD患者的有力策略。
