番茄SlLCY-B2及其启动子的分子特征和sgRNA分析
2023-07-13刘江娜张西英李荣霞张小伟白云凤张爱萍
刘江娜,张西英,李荣霞,张小伟,白云凤,张爱萍
(新疆生产建设兵团第六师农业科学研究所,新疆五家渠 831300)
0 引 言
【研究意义】番茄(Solanumlycopersicum)果实色泽鲜艳,营养丰富。番茄果实中的番茄红素含量主要受合成和代谢双向调控。植物体内分别存在催化番茄红素生成β环的LCY-B和ε环的LCY-E的2种番茄红素环化酶,其参与番茄红素的环化反应,是番茄红素向胡萝卜素转化的2个关键酶[1]。番茄红素合成之后,在2种番茄红素环化酶的作用下,进入2条代谢途径,一条是通过β-番茄红素环化酶LCY-B(lycopene-β-cyclase)催化,把2个β-紫罗兰酮环(β-ionone ring)加到番茄红素的2个末端,形成β-胡萝卜素,进入β-分支;另一条途径是LCY-B和ε-番茄红素环化酶LCY-E(lycopene ɛ-cyclase)共同催化,把一个β-紫罗兰酮环和一个ɛ环(ɛ-ring)分别加到番茄红素两端,形成α-胡萝卜素,进入α-分支。番茄有2个LCY-B基因,调控番茄红素的代谢[2]。LCY-B1基因位于4号染色体,LCY-B2位于6号染色体。【前人研究进展】将番茄LCY-B反义基因[3]或RNAi基因[4]导入番茄,可提高果实的番茄红素含量。将LCY-BRNAi基因和LCY-ERNAi基因同时导入番茄,转基因植株果实的番茄红素含量可达到野生型的3倍[5]。反义基因或RNAi基因能抑制番茄红素环化酶的活性,降低番茄红素的降解。【本研究切入点】近年来以多种新型高效的DNA靶向内切酶为基础建立的基因编辑技术[6],可以对植物靶基因进行定点突变、删除[7]。【拟解决的关键问题】分析番茄SlLCY-B2基因的分子特征和sgRNAs的分布及特异性,以及SlLCY-B2启动子区的顺式作用元件和sgRNAs的分布,为利用CRISPR/Cas9技术调控SlLCY-B2的表达提供参考。
1 材料与方法
1.1 材 料
1.1.1SlLCY-B2多肽特性及保守结构域分析
用Novopro在线工具(https://www.novopro.cn/tools/calc_peptide_property.html)分析多肽特性,利用NCBI搜索蛋白质序列及其保守结构域,BlastP比较该家族的多态性。
1.1.2 基因组结构
利用NCBI核酸数据库查询获得SlLCY-B2的cDNA,以此作query,搜索番茄基因组数据库得到相应的gDNA序列,比对SlLCY-B2的基因组结构。
1.1.3 数字表达谱的建立
以番茄功能基因组数据库网站(http://ted.bti.cornell.edu/cgi-bin/)中RNA-seq data的数据作基础,建立SlLCY-B2基于RNA-seq的数字表达谱。
1.2 方 法
1.2.1 sgRNA的设计和选择
根据CRISPR-Cas9靶点设计原则,利用CRISPRdirect (https://crispr.dbcls.jp/)[8]筛选SlLCY-B2 及其启动子区域的sgRNA序列,即3'端有PAM元件的20个连续的碱基序列,PAM元件设定为NGG,sgRNA的结构为5'-(N)20NGG-3',N为任意核苷酸。
1.2.2 基于 RNA-seq的SlLCY-B2数字表达谱
以番茄功能基因组RNA-seq 数据库为基础,分析SlLCY-B2(TC118853)在不同组织以及不同生长时期的的表达模式。SlLCY-B2在成熟绿果中表达量最高,在4~6周龄植株的顶端分生组织中有较低水平表达,而在植株不同时期的根茎叶等部位均无表达。SlSCY-B与果实性状相关。图1

注:1.果实,子房; 2.未成熟绿果; 3.成熟绿果; 4.破色期果实; 5.成熟红果; 6.花蕾(0~3 mm); 7.花蕾(3~8 mm); 8.开花前花蕾(8 mm); 9.开放的花; 10.发育阶段花的混合物; 11.野生番茄花粉; 12.感染假单胞菌叶片;13.抗假单胞菌叶片;14.混合诱导叶片;15.植株的顶端分生组织(4~6周龄植株); 16.植株顶端分生组织(8周龄植株);17.花前根;18.挂果期根;19.营养匮乏的根;20.完全吸涨5 d后的胚根;21.完全吸涨7 d后的幼苗;22.休眠种子; 23.愈伤组织;24.悬浮培养物;25.冠瘿。PRKM: 每百万reads中来自于特定基因每千碱基长度的reads数
1.2.3SlLCY-B2启动子顺式作用元件
根据SlLCY-B2 gDNA所在染色体信息,获取SlLCY-B2 基因上游-1500 bp 的启动子序列。利用 PlantCare 服务器(http://bioinformatics.psb.ugent/webtools/plantcare/html/search_CARE.html)[9]对SlLCY-B2启动子序列进行顺式作用元件分析。
2 结果和分析
2.1 SlLCY-B2分子特征
研究表明,番茄SlLCY-B2不含内含子,CDS长度1 497 nt,位于6号染色体(GenBank Accession: HG975518.1)的42292820~42291324 nt之间,编码498 aa。SlLCY-B2分子量56 456.86 g/mol,分子式C2538H4024N692O708S28,理论等电点pI 为8.97,GRAVY(疏水性的算术平均值)为-0.17,属于亲水蛋白。该蛋白含有典型的LCY保守域,并含有NADB-Rossmann superfamily特征结构,属于NADB-Rossmann超基因家族。图2

图2 SlLCY-B2保守域
2.2 SlLCY-B2 sgRNA分析
研究表明,设定CRISPR/Cas9系统sgRNA的PAM为NGG,搜索到SlLCY-B2上分布145条sgRNA,其中正链99条,负链46条。剔除16条含有TTTTs序列,在其余的129条sgRNA中,有21条其邻近PAM 12 nt 的种子序列在番茄全基因组上是唯一序列,特异性高,可在利用CRISPR/Cas9系统进行基因编辑时优先选择。图3
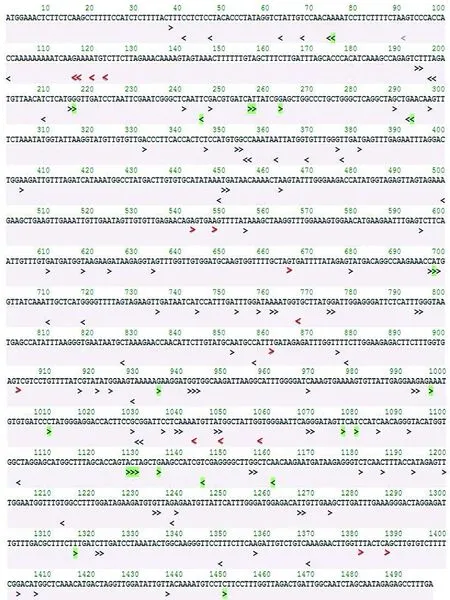
注:绿色>示这些sgRNAs位于外显子绿色示sgRNA邻近PAM 12 nt的种子序列在番茄全基因组上是唯一序列;黑色>色示该sgRNA邻近PAM 12 nt 的种子序列在其它染色体的1个位点上有与其匹配的序列;红色<表示这些sgRNAs横跨2个外显子邻接处或含有含连续的TTTT,选用pol III启动子尽力避免选用这些sgRNA序列
2.3 SlLCY-B2启动子顺式作用元件及sgRNA
研究表明,该启动子除了具有典型的TATA-box和CAAT-box核心启动子元件外,还包含了5个光应答元件和3个激素响应元件,另有7个其他环境响应元件。表1

表1 SlLCY-B2启动子顺式作用元件
设定sgRNA的PAM为NGG,SlLCY-B2启动子区域分布112条sgRNA,其中正链分布69条,互补链分布43条,剔除15条含有TTTTs的序列,尚有97条可供选择,有9条其邻近PAM 12 nt 的种子序列在番茄全基因组上是唯一序列,特异性较好,且比较均匀地分布在启动子区域,其中位于起始密码子上游580~602 nt 的高特异性sgRNA(CCTGCCGTCCATGCACTGACTAC)含有顺式调控元件A-box (ccgtcc),利用该sgRNA进行基因编辑,可验证A-box的功能。特异性较好的sgRNA和启动子包含的各种顺式作用元件均分散在启动子区域,预示可利用双sgRNA编辑删除启动子上的特定片段或元件,为原位突变研究启动子上的特定片段或元件对果实番茄红素含量的影响提供了可能。图4
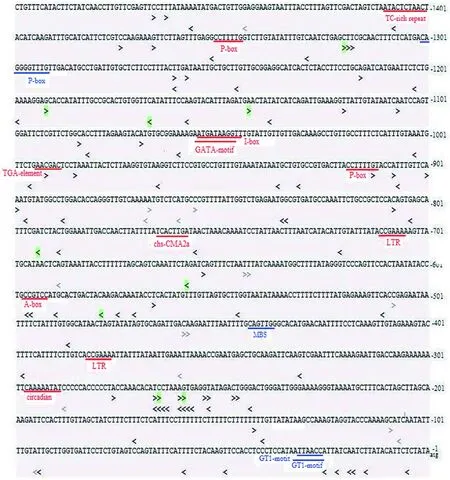
注:sgRNA: 绿色>示这些sgRNAs位于外显子绿色示sgRNA邻近PAM 12 nt 的种子序列在番茄全基因组上是唯一序列;黑色>示该sgRNA邻近PAM 12 nt 的种子序列在其它染色体的1个位点上有与其匹配的序列;灰色>表示这些sgRNAs横跨2个外显子邻接处或含有含连续的TTTT,选用pol III启动子尽力避免选用这些sgRNA序列。顺式作用元件:红色下划线示顺式作用元件位于正链,蓝色下划线示元件位于负链
3 讨 论
番茄红素在植物体内合成后,可在番茄红素环化酶LCY-B和LCY-E的催化下进入代谢途径。LCY-B基因过表达可促进番茄红素代谢,降低番茄红素含量[2],而用RNAi转基因抑制LCY-B的表达,可提高番茄红素含量[5]。利用新近发展的CRISPR/Cas9基因编辑技术对番茄中与番茄红素合成和代谢相关的基因进行多位点编辑,也可提高番茄红素含量[7]。随着 CRISPR/Cas9技术的成熟、完善,通过基因编辑抑制番茄红素的代谢,提高其积累将是番茄品质育种的重要手段。
在CRISPR/Cas9系统中,规避脱靶效应和提高编辑效率是关键。sgRNA长度一般设计为20 nt,而番茄基因组长度达950 Mb[10,11],易在基因组的非目标区段出现与sgRNA匹配序列,导致Cas9核酸酶错切割。Cas9还可能切割与sgRNA不完全匹配的序列[1,12]。科学设计、选择sgRNA,最大限度降低脱靶风险是CRISPR/Cas9 系统面临的一大挑战。CRISPRdirect在线分析表明,番茄SlLCY-B2有21条其邻近PAM 12 nt 的种子序列,在番茄全基因组上是唯一序列,特异性高,可有效降低脱靶风险。
sgRNA 是 CRISPR/Cas9体系的重要组件,不同sgRNA编辑效率差异很大[13,14]。在基因编辑过程中,sgRNA与DNA靶位点结合,引导核酸酶在靶位点切断DNA链,sgRNA与靶标位点的结合能力直接影响编辑效率[14]。sgRNA的碱基组成和位置也会影响编辑效率[15],如sgRNA 3’末端第20位碱基为G和第16位碱基为C时,编辑效率较高,第20位碱基为C和第16位碱基为G时,编辑效率较低。另外设定PAM为NGG时,CGG编辑效率较高。不同的PAM序列也会影响编辑效率,如NGG>NGA>NAG[16]。
基因表达产物取决于编码序列,表达的时空量则由启动子调控。利用CRISPR/Cas9突变相关基因的启动子而不是这些基因本身,能够实现对数量性状的精细调节,微调基因表达而不是剔除或灭活其编码的蛋白[17]。Rodriguez等[18]利用CRISPR/Cas9技术对启动子区域进行基因组编辑,实现对番茄产量性状(果实大小、花序分枝和株型)的精细调控 。对水稻Wx基因启动子上的关键顺式作用元件进行基因编辑,创制了多个可微调直链淀粉含量和蒸煮食味品质的新Wx等位基因[19,20],对启动子进行基因编辑可以适度调节目的基因的表达。番茄SlLCY-B2启动子区存在诸多顺式作用元件,推测SlLCY-B2的转录水平可能受到多种因素的调控。对SlLCY-B2 启动子进行定点突变或顺式作用元件的删除,可能是调控果实番茄红素含量的新途径。
4 结 论
SlLCY-B2位于番茄6号染色体,编码498 个氨基酸,gDNA不含内含子,呈果实特异性表达。SlLCY-B2分布145条sgRNA,其中21条有高特异性。SlLCY-B2上游-1 500 bp 启动子序列分布15个顺式作用元件和112条sgRNA。对SlLCY-B2和其启动子区进行基因编辑,可调控SlLCY-B2的表达,将提高番茄红素含量。
