双源CT双能量参数联合薄层CT参数对肺腺癌病理类型的诊断价值
2023-07-12程宏明龚新占
程宏明,龚新占
(信阳市中医院 放射科,河南 信阳 464000)
肺腺癌的治疗方式有手术、放化疗、靶向治疗等,临床治疗中常需先确定患者的病理分型,而后再选取合适的治疗方式,以期有效控制癌细胞扩散,减轻患者痛苦,延长生存时间[1-2]。穿刺活检是临床明确肺腺癌病理分型的金标准,准确性非常高,但部分患者因家庭或身体原因,无法耐受穿刺活检,故需探寻其他辅助方法鉴别诊断,为后续治疗提供依据[3]。
双源CT双能量成像技术是目前临床上辅助诊断肺腺癌病理分型的主要方法,可通过双源CT发射 2种不同能量的X射线来准确获得癌变组织的特性,而后通过双能量成像技术使病灶的边缘和浸润范围描绘的更清晰,可有助于医护人员根据输出的静脉期40 keV下CT值、碘浓度等参数对肺腺癌类型进行判断[4-5]。但双源CT双能量成像技术在微小病变的识别上确存在一定缺陷,故其诊断结果可能存在一定偏颇。薄层CT是一种CT重建方式,可通过薄层显示图像,可发现患者肺内微小病变,与双源CT双能量成像联用,或可提高对肺腺癌病理分型的诊断准确性。但国内外关于双源CT双能量联合薄层CT诊断肺腺癌病理类型研究较少。基于此,本研究探讨双源CT双能量成像联合薄层CT对肺腺癌病理分型的诊断价值。
1 对象与方法
1.1 研究对象纳入信阳市中医院于2021年9月至2022年6月收治的肺腺癌患者作为研究对象,所有患者均对本次研究知情并签署同意书。纳入标准:(1)符合《肺癌筛查与管理中国专家共识》[6]中肺腺癌的诊断标准;(2)CT检查前未接受手术或化疗治疗;(3)愿意接受病理活检。排除标准:(1)存在其他恶性肿瘤;(2)精神亢奋,无法配合完成CT检查;(3)存在严重凝血功能障碍;(4)存在严重心脏疾病;(5)在支气管哮喘急性发病期;(6)存在肺部严重病变,如肺结核。根据纳入排除标准纳入90例肺腺癌患者,其中男59例,女31例;年龄48~63岁,平均(56.23±3.34)岁;体重48~71 kg,平均(60.12±4.14)kg。
1.2 研究方法
1.2.1双源CT双能量成像 (1)碘对比剂过敏试验:由经过培训的医护人员取碘对比剂0.1 mL做皮内试验,观察20 min,患者无变态反应后开始CT检查。(2)检查前:告知患者于检查开始前半小时内摄入约1 000 mL清水,并指导患者练习屏气,确保检查可顺利进行。(3)体位:患者取仰卧位,双臂举过头顶,给予头臂支架适当支撑患者头部和手臂,确保舒适度。(4)图像采集:使用64层双源CT扫描仪(产自德国西门子公司,SOMATOM Definition型)进行双源CT双能量成像检查,扫描范围为肺尖至肺底,于患者深呼气后屏气时扫描。调整仪器的矩阵大小为512×512,探测器宽度为32 mm×0.6 mm,利用高分辨算法重建层厚1.25 mm,层距0.8 mm,螺距设置0.5 mm,选择双源liver vnc序列,并将模式调整为DE模式,使仪器的A、B两管可同时采集患者的肺部图像信息。通过双筒高压注射器(SCT211,Medrad,INC,America)通过患者肘部中间的静脉注入碘对比剂,注射完成后继续注入30 mL生理盐水,于注入对比剂后25 s进行动脉期图像采集,于30 s时进行静脉期图像采集。(6)图像分析:记录测量过程中碘浓度值,并将上述得到的高分辨率CT螺旋图像,在MMWP工作站进行图像处理,测量动脉期和静脉期40、80、120、160 keV对应的肺部肿块CT值。
1.2.2薄层CT重建 将原始CT图像传输至金仕达卫宁放射报告系统中进行薄层高分辨率图像重建,设置重建层厚1.25 mm,重建矩阵512×512,重建层距0.8 mm,窗宽1 500 HU,窗位-600 HU,后由2位具有5 a经验的影像学诊断主治医师采用双盲法对重建好的薄层CT图像进行分析,分别取1个具有代表性的层面进行测量,得到CT值。最终CT值为2位医生所得CT值的平均数。
1.2.3病理检查 于影像学检查第2天对所有患者进行CT引导下穿刺活检,将活检中取得的病灶内部样本以体积分数10%甲醛固定组织标本后送检,以明确肺腺癌病理分型。根据2011年国际美国癌症研究协会制定的分型标准[7],将肺腺癌分为原位腺癌(adenocarcinoma in situ,AIS)、微浸润性腺癌(minimally invasive adenocarcinoma,MIA)、浸润性腺癌(invasive adenocarcinoma,IAC)3种。AIS,局灶性结节,肿瘤直径≤3 cm,癌细胞单纯贴壁生长;MIA,孤立性,肿瘤直径≤3 cm,癌细胞浸润成分最大径≤5 mm;AC,任意视野下,均可见癌细胞浸润。
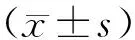
2 结果
2.1 病理检查结果经病理检查确诊,90例肺腺癌患者中AIS型10例,占比为11.11%;MIA型29例,占比为32.22%;IAC型51例,占比为56.67%。
2.2 临床资料3组性别、体重、年龄、既往吸烟史、家族遗传史、病灶部位比较,差异无统计学意义(P>0.05)。见表1。

表1 3组临床资料比较
2.3 不同病理类型患者双源CT双能量成像、薄层CT结果比较静脉期40 keV下CT值和薄层CT值比较,AIS>MIA>IAC;碘浓度比较,AIS
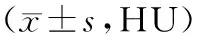
表2 双源CT双能量成像、薄层CT结果比较
2.4 双源CT双能量参数联合薄层CT参数与肺腺癌病理类型的关系经点二列相关性分析结果显示,静脉期40 keV CT值、薄层CT值、碘浓度与肺腺癌病理类型间呈正相关(r>0,P<0.05)。见表3。
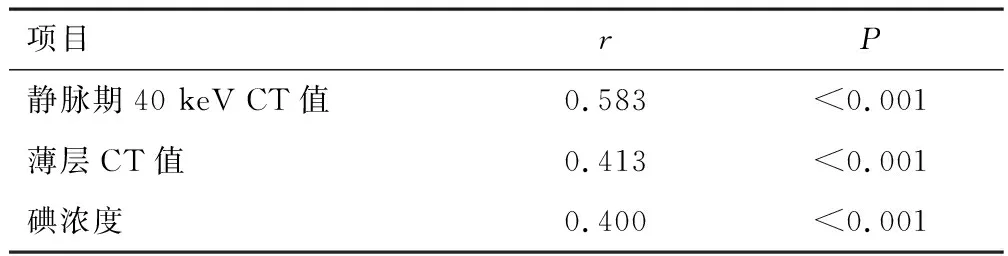
表3 双源CT双能量参数联合薄层CT参数与肺腺癌病理类型的关系
2.5 双源CT双能量成像、薄层CT评估肺腺癌病理分型的ROC曲线将肺腺癌病理分型作为状态变量(AIS+MIA=0,IAC=1),将差异有统计学意义的双源CT双能量成像和薄层CT参数作为检验变量;绘制ROC曲线,结果显示,静脉期40 keV CT值、碘浓度、薄层CT及联合评估肺腺癌病理分型的AUC值分别为0.835、0.729、0.743、0.892,具有一定评估价值,且联合评估价值最高。见表4。

表4 双源CT双能量成像、薄层CT评估肺腺癌病理分型的ROC曲线
3 讨论
肺腺癌的病理类型为AIS、MIA、IAC 3种,因3种病理分型形态差异不明显且征象间重叠性很大,故常规影像学对其诊断性较低[8]。双源CT双能量成像可在评估肺腺癌病理分型征象的基础上,添加既往影像学没有的定量评估,可解决不同病理分型间征象重叠性的问题;薄层CT则通过降低图像层厚的方式,精准识别不同病理分型间的形态差异。因此,推测将两者联合使用,可提高对肺腺癌3种病理分型的诊断准确率。
从本研究结果可看出,3组患者在静脉期40 keV能量下的CT值间差异最明显,提示静脉期40 keV下的CT值可有助于诊断肺腺癌病理分型。因为双源CT双能量成像技术是由两套球管在不同能量下独立发射X射线来得到多个单能量图像,后通过重建技术将得到的单能量图像融合,用以识别病灶直径大小和性质[9-10]。有研究指出,针对肺腺癌,在低能量水平下,双球管发射出的X射线穿透力最强,得到的图像组织对比度较高,使病灶与人体健康组织对比提升,从而提高对不同病理分型诊断的准确性[11-12]。因此,在能量40 keV时的CT值差异最大。此外,因不同病理分型下的肿瘤细胞大都以静脉新生血管为主,故在静脉期40 keV能量下测量的CT值差异有明显区别,这与朱剑等[13]研究结果近似。值得注意的是,双源CT双能量成像结果中的碘浓度值也可通过显示患者病灶部位的血供来评估癌细胞浸润的范围及识别肺部隐散性病变,继而帮助医生更好诊断肺腺癌病理分型。
肺腺癌3种病理分型间主要通过肿瘤直径、性质和浸润范围来进行区分,但对于早期AIS和IAC,因其直径较小,即使是低能量水平下的双源CT双能量技术也无法精准识别。而薄层CT的扫描厚度在1.25 mm及以下,分辨率极高,可识别5 mm以下的病灶,减少漏诊率,将其与双源CT双能量成像技术联用,可弥补其对微小病灶识别的缺陷[14-15]。进一步分析本研究结果,发现双源CT双能量成像联合薄层CT在AIS/MIA和IAC的诊断价值确比单独进行两检查高,证实了上述推测的可行性。分析其原因,随着肺腺癌病理分型等级的提高,癌细胞的细胞质基质比越大,细胞排列错综复杂,异型性越明显[16]。双源CT双能量成像联合薄层CT可在扫描层厚变薄的基础上,根据异型细胞在不同能量下的灰度、强度、峰度和偏度来识别微小病灶或仅仅轻微分化的肿瘤细胞,使其呈现出不同的CT值,有助于医生根据CT值差异来明确病灶的性质、侵及范围、大小等信息,并根据这些资料来进一步区分肺腺癌不同病理分型,为后续治疗方案的制定提供有力支持。
综上所述,双源CT双能量成像联合评估肺腺癌病理分型具有较高诊断价值,临床中可加以应用,以提高影像学诊断肺腺癌病理分型的准确率。
