痛风煎联合苯溴马隆治疗间歇期痛风性关节炎的临床研究*
2023-07-12窦娟娟胡永鹏杨毛吉田新蕊
窦娟娟,胡永鹏,杨毛吉,田新蕊
(甘肃省第二人民医院,甘肃 兰州 730030)
痛风性关节炎(gouty arthritis,GA)主要指由于高尿酸(hyperuricemia)导致的尿酸盐结晶沉积在关节及关节周围组织引起的关节炎性疾病,好发于第一跖趾关节,其次为踝、膝等关节,具有较高的发病率和致残率,长期危害患者的生命健康。据调查,欧美国家的痛风患病率为1.4%~3.9%[1-2],而随着我国经济水平的提高和人民生活改善,我国痛风患病率上升至0.86%~2.20%[3-4]。GA急性期转为慢性期后,尿毒症、缺血性心脏病、脑血管疾病及恶性肿瘤等并发症也随之而来,而西药针对GA的治疗虽然取得了长足的进展,但同时存在肝肾功能损害等副作用。因此,如何更好地防治GA,降低治疗毒副作用及慢性并发症的发生率是目前亟待解决的医疗难题之一,也是当下学者们研究的热点之一[5-7]。中医药防治痛风疗效颇佳,且现代药理学研究[8-9]证实,诸多中药的有效成分能够保护肝脏与肾脏,降低西药的毒副作用。因此本研究总结多年临床诊治GA的经验,发现采用痛风煎联合苯溴马隆治疗间歇期GA可取得令人满意的疗效。本研究以苯溴马隆为对照药物,通过随机、单盲及前瞻性平行对照临床研究,评价痛风煎联合苯溴马隆治疗间歇期GA的疗效和安全性,为其临床应用提供依据,现报告如下。
1 资料与方法
1.1 诊断标准 西医诊断标准符合2015年美国风湿病学会(ACR)及欧洲抗风湿病联盟(EULAR)公布的痛风诊断标准[1];中医诊断标准符合中华中医药学会风湿病分会发布的痛风和高尿酸血症病证结合诊疗指南标准[10]。
1.2 纳入标准 (1)符合痛风诊断指南标准;(2)年龄20~75岁;(3)病程3年以上;(4)过去1年内急性发作次数≥8次;(5)痛风急性发作72 h内就诊;(6)此次观察前1周内未服用消炎止痛等非甾体抗炎药及影响尿酸代谢药物;(7)能配合临床试验观察及按期随访者,并且签署知情同意书。
1.3 排除标准 (1)合并有严重的心、肝、肺、肾等器官的内科疾病;(2)患者因严重的关节僵硬及变形丧失基本劳动能力;(3)患者以往有胃溃疡病史或开始本次治疗前1个月有发生过胃溃疡疾病;(4)患者有精神病史或治疗依从性较差。
1.4 剔除、脱落标准 对本研究中干预药物有过敏反应或其他严重不良反应者经过痛风煎+苯溴马隆或苯溴马隆药物治疗期间,尿酸(BUA)、血沉(ESR)、C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-8(IL-8)、病情视觉模拟评分(VAS)、中医证候积分、谷草转氨酶(AST)、谷丙转氨酶(ALT)、肌酐(Scr)等相关指标未明显改变或出现反向升高时,应中止试验,不可纳入本次实验统计;治疗期间发生严重疾病,不能继续进行者。符合以上任何一条即予剔除或脱落。
1.5 研究对象 收集2020年6月至2021年6月期间就诊于甘肃省第二人民医院风湿病科的间歇期痛风性关节炎患者128例,采用随机数表将患者随机分为治疗组和对照组,每组64例。所有患者均符合纳入标准,并通过本院伦理委员会审核批准(伦理编号:2020-016-01)。
1.6 治疗方法 两组患者均给予健康宣教:禁止饮酒,低嘌呤、低脂饮食,足量饮水(≥2 000 mL/d);避免关节受凉、外伤及过度疲劳等诱发因素;避免影响尿酸代谢与排泄的药物。
对照组:苯溴马隆(尤诺,常州康普药业有限公司,国药准字:H19990335,50 mg/片),初始小剂量服用,每次口服50 mg,1次/d,用药1周后检测血尿酸,如果血尿酸仍高于360 μmol/L,增加剂量至100 mg,待血尿酸低于360 μmol/L改为50 mg/d。
治疗组:痛风煎联合苯溴马隆。痛风煎(广东一方制药有限公司,产品许可证号:粤20160214)组成:白术15 g,苍术10 g,萆薢10 g,车前草10 g,薏苡仁15 g,土茯苓15 g,桂枝6 g,川牛膝6 g。上述药物均为颗粒剂,开水冲服,2次/d,每服用5 d间歇2 d以提高患者依从性。苯溴马隆(尤诺,常州康普药业有限公司,国药准字:H19990335,50 mg/片),服用方法同对照组。
1.7 观察指标及疗效评价
1.7.1 实验室指标 抽取患者清晨空腹静脉血5 mL,取上层清液进行冻存,备用。我院检验科检测血BUA、CRP、ESR等;抽取患者膝关节滑液2 mL,采用酶联吸附法(ELISA)测定TNF-α、IL-8、IL-1β水平。TNF-α ELISA试剂盒购自上海西唐生物科技有限公司,IL-8、IL-1β ELISA试剂盒购自武汉默沙克生物科技有限公司。操作过程参照ELISA试剂盒说明书进行。
1.7.2 VAS积分、中医证候积分 VAS积分参照国际通用VAS评分方法进行评估。中医证候积分参照《中药新药临床研究指导原则(试行)》[11]拟定。(见表1)

表1 中医证候积分表
1.7.3 安全性指标 观察两组患者治疗前后AST、ALT、Scr等肝肾功能变化情况以评估其不良反应。
1.8 疗效标准 参照《中医病证诊断疗效标准》[12]拟定。临床控制:临床症状均完全消失,关节功能均完全恢复正常,中医证候积分减少≥90%;显效:主要临床症状消失,关节功能基本恢复正常,70%≤中医证候积分减少<90%;有效:临床症状基本消失,关节功能均得到改善,30%≤中医证候积分减少<70%;无效:临床症状、关节功能均无改善甚至有加重趋势,中医证候积分减少<30%。
1.9 统计学方法 采用SPSS 22.0统计软件进行数据处理,计量资料以“均数±标准差”(±s)表示,组间比较采用成组t检验,组内治疗前后比较采用配对t检验,不满足正态性的资料组间比较采用秩和检验;计数资料用例表示,组间比较采用χ2检验;重复测量计量资料比较采用重复测量资料方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 共脱落病例6例,剩余122例。治疗组62例,对照组60例,两组患者性别、年龄、病程等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。(见表2)
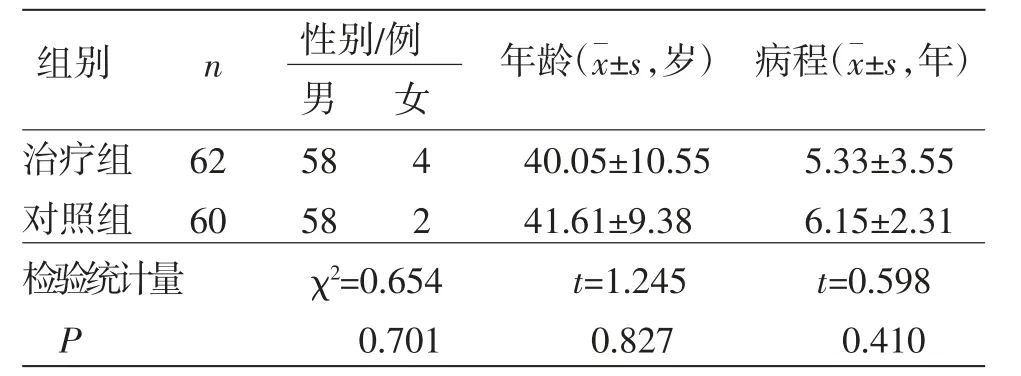
表2 两组患者基线资料比较
2.2 两组患者临床疗效比较 治疗组总有效率为96.77%(60/62),对照组总有效率为81.67%(49/60),治疗组疗效明显优于对照组(P<0.05)。(见表3)
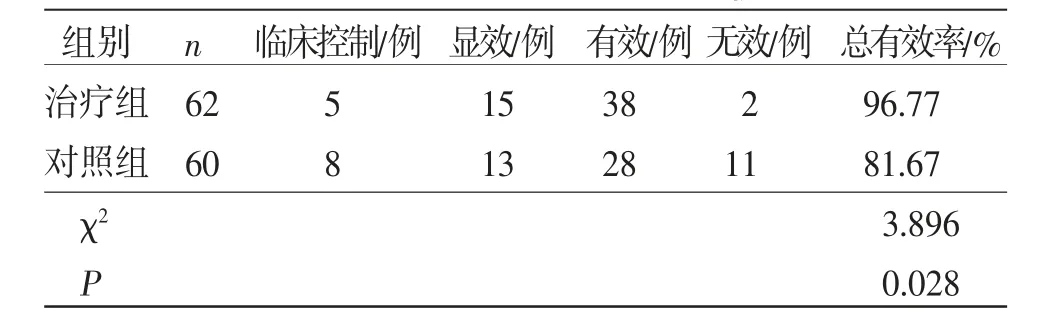
表3 两组患者临床疗效比较
2.3 两组患者治疗前后ESR、CRP、BUA比较 所有患者治疗前后ESR、CRP、BUA实验室指标相比较,差异有统计学意义(P<0.05),即存在时间效应,两组均如此;随着治疗周期的增加,两组患者ESR、CRP、BUA实验室指标逐步降低;治疗第1周、12周、24周、36周的ESR、CRP、BUA实验室指标的改善显著(P<0.05)。两组患者ESR、CRP、BUA总体比较,差异有统计学意义(P<0.05),即存在分组效应。与对照组比较,治疗组在治疗后第1周、12周、24周、36周的ESR、CRP、BUA实验室指标的改善显著(P<0.05)。时间因素与分组因素存在交互效应(P<0.05),即两组患者在治疗前后的ESR、CRP、BUA降低幅度不一致。(见表4)
表4 两组患者治疗前后ESR、CRP、BUA 比较 (±s)
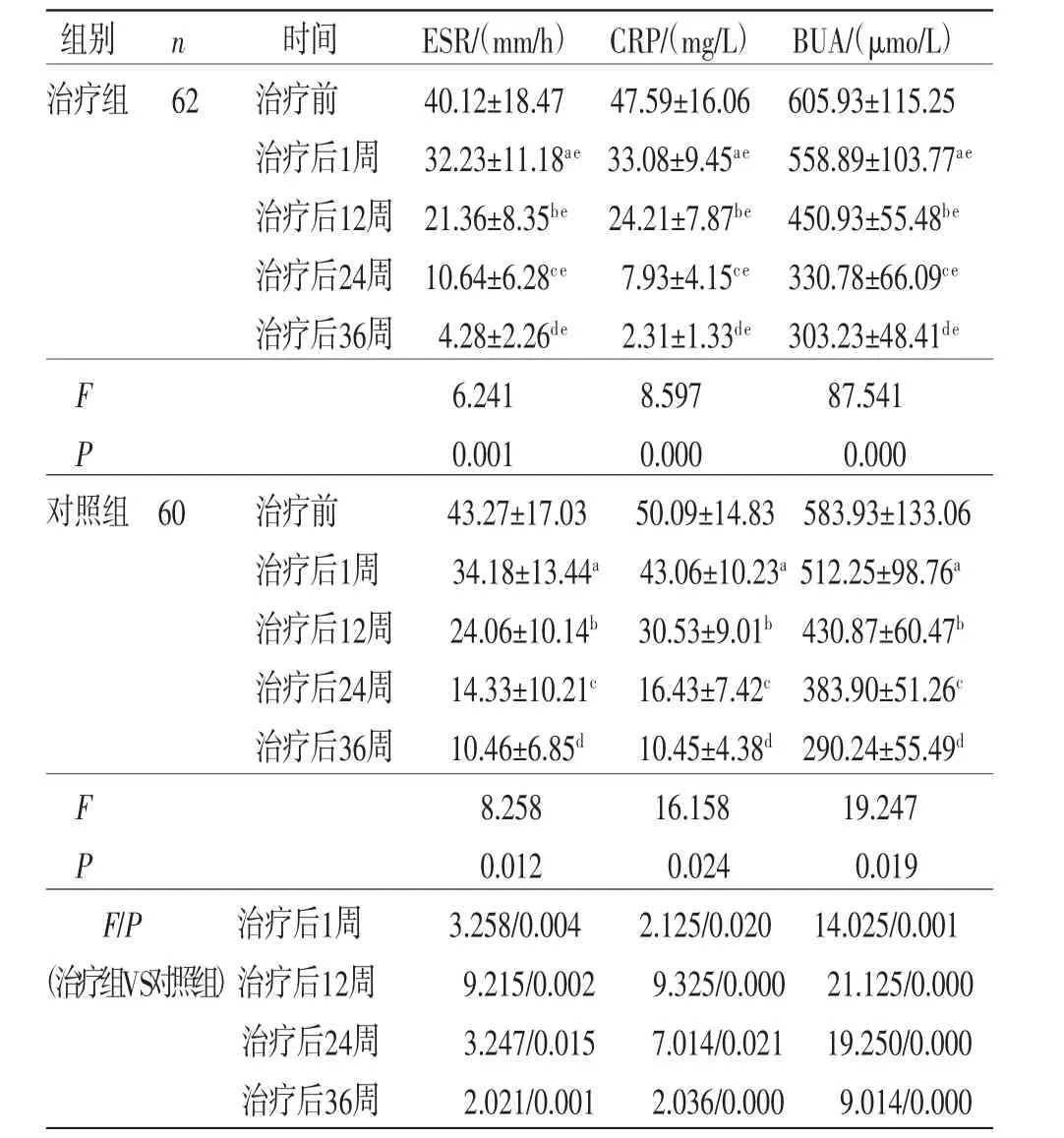
表4 两组患者治疗前后ESR、CRP、BUA 比较 (±s)
注:与治疗前比较,aP<0.01;与治疗后1周比较,bP<0.01;与治疗后12周比较,cP<0.01;与治疗后24周比较,dP<0.01;与对照组比较,eP<0.01。
组别n时间ESR/(mm/h) CRP/(mg/L) BUA/(μmo/L)治疗组 62治疗前40.12±18.47 47.59±16.06 605.93±115.25治疗后1周 32.23±11.18ae 33.08±9.45ae 558.89±103.77ae治疗后12周 21.36±8.35be 24.21±7.87be 450.93±55.48be治疗后24周 10.64±6.28ce7.93±4.15ce 330.78±66.09ce治疗后36周 4.28±2.26de2.31±1.33de 303.23±48.41de F 6.2418.59787.541 P 0.0010.0000.000对照组 60治疗前43.27±17.0350.09±14.83 583.93±133.06治疗后1周34.18±13.44a 43.06±10.23a 512.25±98.76a治疗后12周24.06±10.14b 30.53±9.01b 430.87±60.47b治疗后24周14.33±10.21c 16.43±7.42c 383.90±51.26c治疗后36周10.46±6.85d10.45±4.38d 290.24±55.49d F 8.25816.15819.247 P 0.0120.0240.019 F/P治疗后1周3.258/0.0042.125/0.020 14.025/0.001(治疗组VS对照组)治疗后12周9.215/0.0029.325/0.000 21.125/0.000治疗后24周3.247/0.0157.014/0.021 19.250/0.000治疗后36周2.021/0.0012.036/0.0009.014/0.000
2.4 两组患者关节液TNF-α、IL-1β及IL-8水平比较 所有患者治疗前后TNF-α、IL-1β及IL-8水平比较,差异有统计学意义(P<0.05),即存在时间效应,两组均如此;随着治疗周期的增加,两组患者TNF-α、IL-1β及IL-8水平显著降低,治疗第1周、12周、24周、36周的TNF-α、IL-1β及IL-8水平改善显著(P<0.05)。两组患者IL-1β及IL-8总体比较,差异有统计学意义(P<0.05),存在分组效应。与对照组比较,治疗组在治疗后第1周、12周、24周、36周的TNF-α、IL-1β及IL-8水平改善显著(P<0.05)。时间因素与分组因素存在交互效应(P<0.05),即两组患者治疗前后的TNF-α、IL-1β及IL-8降低幅度不一致。(见表5)
表5 两组患者治疗前后TNF-α、IL-1β 及IL-8 比较 (±s)
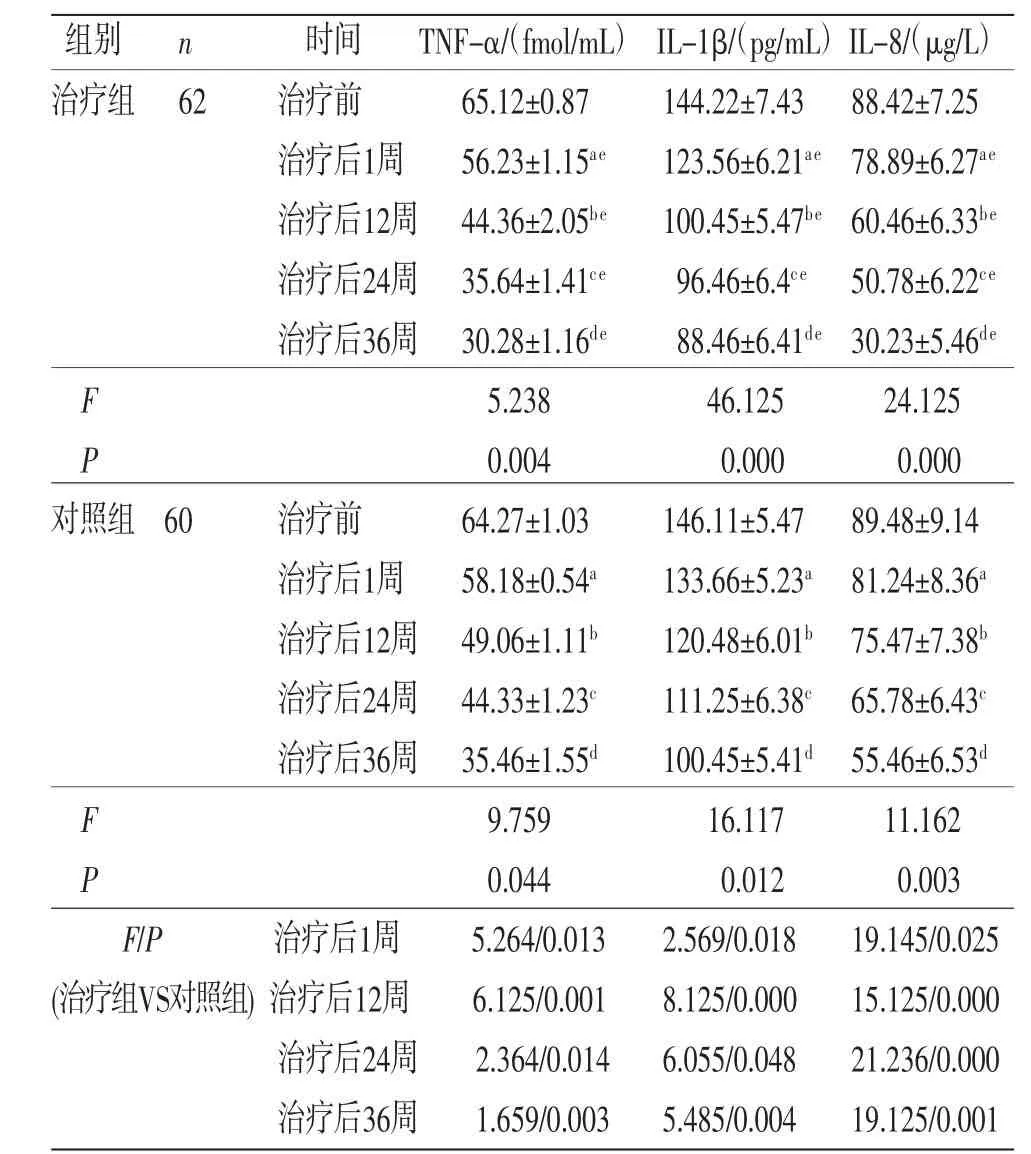
表5 两组患者治疗前后TNF-α、IL-1β 及IL-8 比较 (±s)
注:与治疗前比较,aP<0.01;与治疗后1周比较,bP<0.01;与治疗后12周比较,cP<0.01;与治疗后24周比较,dP<0.01;与对照组比较,eP<0.01。
组别n时间TNF-α/(fmol/mL) IL-1β/(pg/mL)IL-8/(μg/L)治疗组 62治疗前65.12±0.87144.22±7.43 88.42±7.25治疗后1周56.23±1.15ae123.56±6.21ae 78.89±6.27ae治疗后12周 44.36±2.05be100.45±5.47be 60.46±6.33be治疗后24周 35.64±1.41ce96.46±6.4ce 50.78±6.22ce治疗后36周 30.28±1.16de88.46±6.41de 30.23±5.46de F 5.23846.12524.125 P 0.0040.0000.000对照组 60治疗前64.27±1.03146.11±5.47 89.48±9.14治疗后1周58.18±0.54a133.66±5.23a 81.24±8.36a治疗后12周 49.06±1.11b120.48±6.01b 75.47±7.38b治疗后24周 44.33±1.23c111.25±6.38c 65.78±6.43c治疗后36周 35.46±1.55d100.45±5.41d 55.46±6.53d F 9.75916.11711.162 P 0.0440.0120.003 F/P治疗后1周5.264/0.0132.569/0.01819.145/0.025(治疗组VS对照组) 治疗后12周6.125/0.0018.125/0.00015.125/0.000治疗后24周2.364/0.0146.055/0.04821.236/0.000治疗后36周1.659/0.0035.485/0.00419.125/0.001
2.5 两组患者治疗前后中医证候积分及VAS评分比较 所有患者治疗前后中医证候积分及VAS评分比较,差异均有统计学意义(P<0.05),即存在时间效应,两组均如此;治疗第1周、12周、24周、36周中医证候积分及VAS评分显著降低,差异均有统计学意义(P<0.05)。两组患者中医证候积分、VAS评分总体比较,差异均有统计学意义(P<0.05),即存在分组效应。与对照组比较,治疗组在治疗后第1周、12周、24周、36周的中医证候积分及VAS评分显著降低(P<0.05)。时间因素与分组因素存在交互效应(P<0.05),即两组患者治疗前后中医证候积分、VAS评分下降幅度不一致。(见表6)
表6 两组患者治疗前后中医证候积分及VAS评分比较(±s,分)
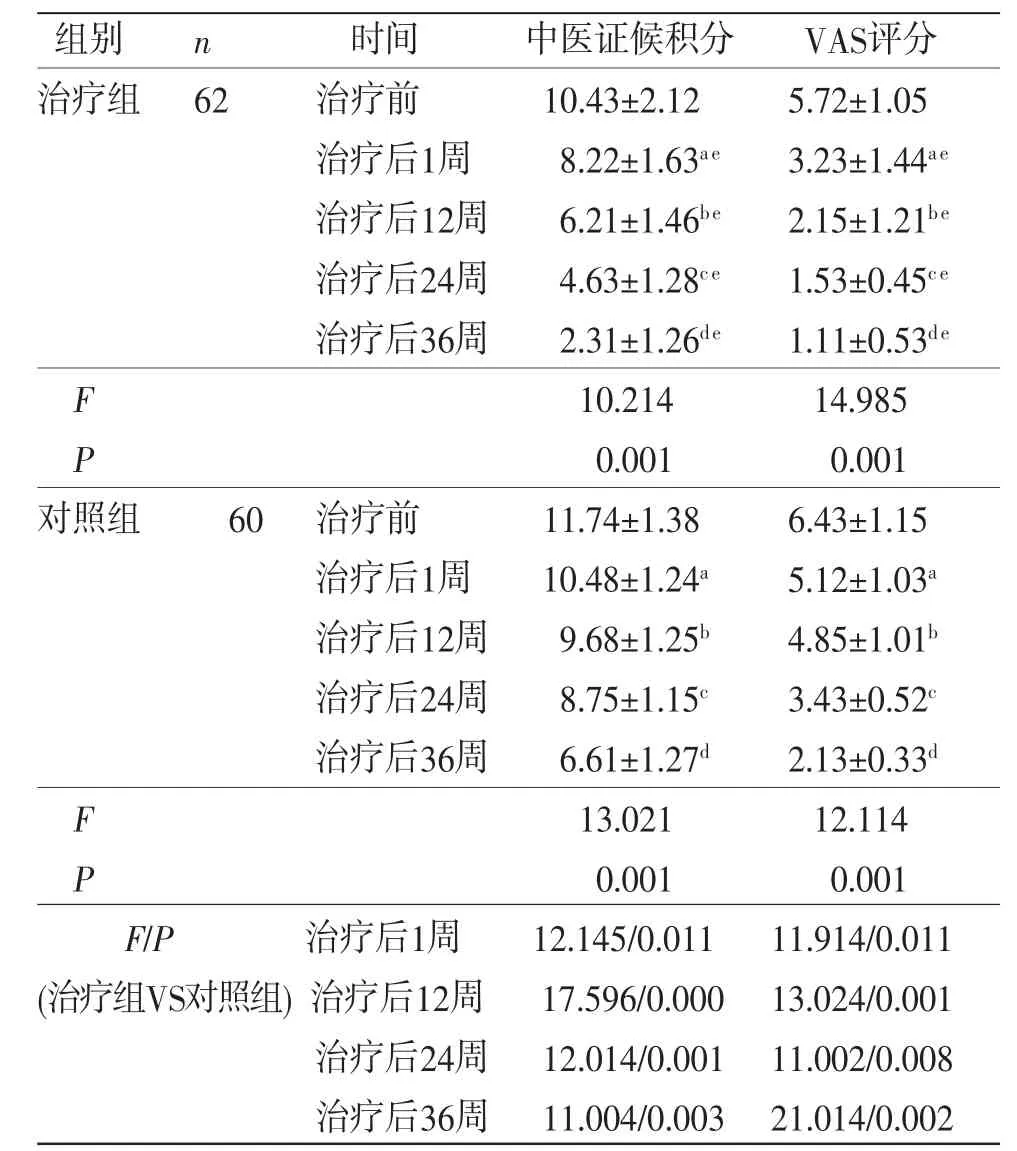
表6 两组患者治疗前后中医证候积分及VAS评分比较(±s,分)
注:与治疗前比较,aP<0.05;与治疗后1周比较,bP<0.05;与治疗后12周比较,cP<0.05;与治疗后24周比较,dP<0.05;与对照组比较,eP<0.01。
组别n时间中医证候积分VAS评分治疗组 62治疗前10.43±2.125.72±1.05治疗后1周8.22±1.63a e3.23±1.44a e治疗后12周6.21±1.46be2.15±1.21be治疗后24周4.63±1.28c e1.53±0.45c e治疗后36周2.31±1.26de1.11±0.53de F 10.21414.985 P 0.0010.001对照组60 治疗前11.74±1.386.43±1.15治疗后1周10.48±1.24a5.12±1.03a治疗后12周9.68±1.25b4.85±1.01b治疗后24周8.75±1.15c3.43±0.52c治疗后36周6.61±1.27d2.13±0.33d F 13.02112.114 P 0.0010.001 F/P治疗后1周12.145/0.01111.914/0.011(治疗组VS对照组) 治疗后12周17.596/0.000 13.024/0.001治疗后24周 12.014/0.001 11.002/0.008治疗后36周 11.004/0.003 21.014/0.002
2.6 两组患者安全性评价 所有患者治疗前后AST、ALT、Scr比较,差异均无统计学意义(P>0.05),即不存在时间效应,两组均如此;两组患者AST、ALT、Scr总体比较,差异有统计学意义(P<0.05),即存在分组效应。与对照组比较,治疗组患者AST、ALT、Scr明显下降,差异有统计学意义(P<0.05)。时间因素与分组因素不存在交互效应(P>0.05),即两组患者治疗前后AST、ALT、Scr变化幅度一致。(见表7)
表7 两组患者治疗前后AST、ALT、Scr 比较 (±s)
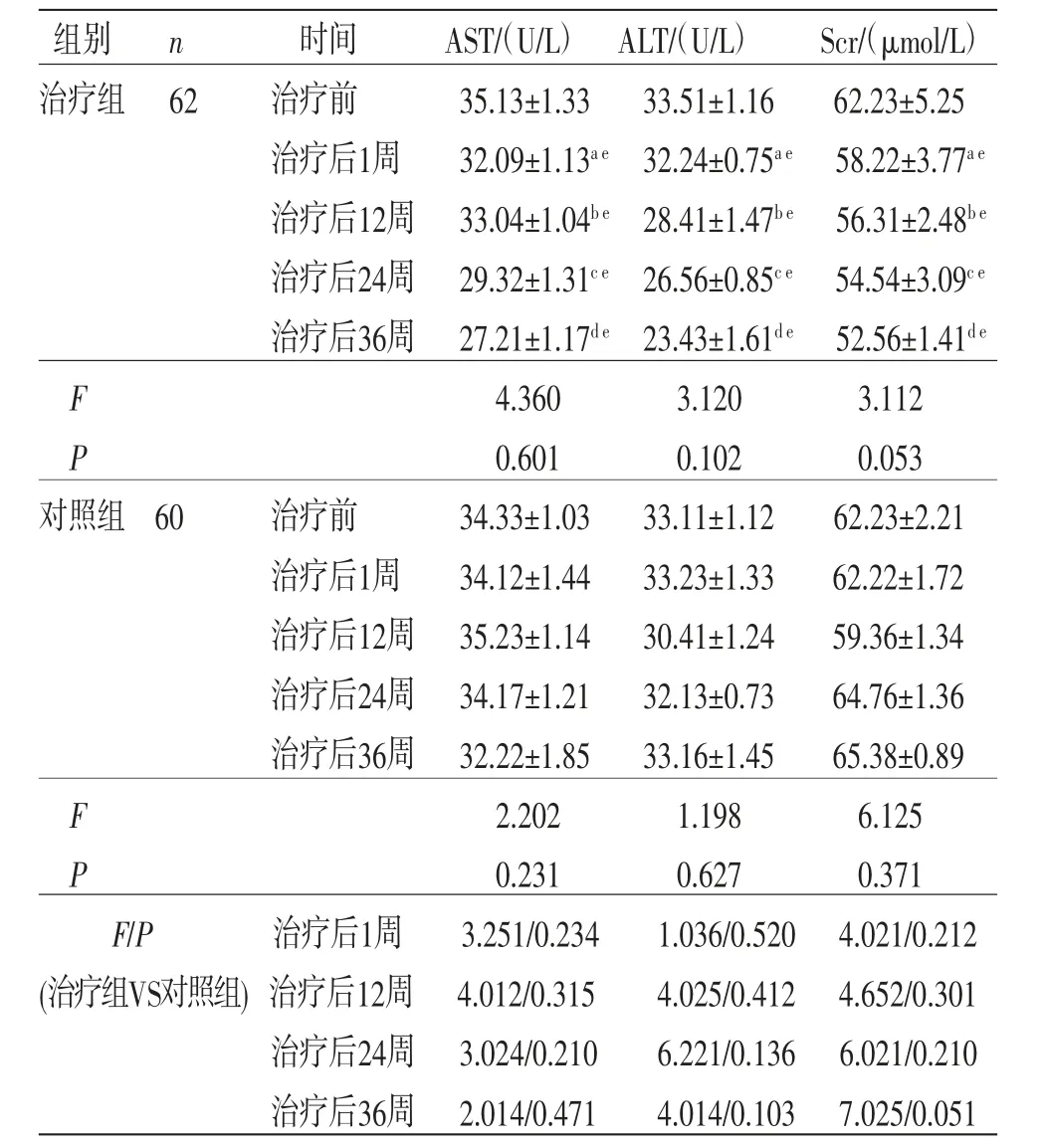
表7 两组患者治疗前后AST、ALT、Scr 比较 (±s)
注:与治疗前比较,aP>0.05;与治疗后1周比较,bP>0.05;与治疗后12周比较,cP>0.05;与治疗后24周比较,dP>0.05;与对照组比较,eP<0.05。
组别n时间AST/(U/L) ALT/(U/L)Scr/(μmol/L)治疗组 62治疗前35.13±1.3333.51±1.1662.23±5.25治疗后1周32.09±1.13a e 32.24±0.75a e 58.22±3.77a e治疗后12周 33.04±1.04b e 28.41±1.47b e 56.31±2.48b e治疗后24周 29.32±1.31c e 26.56±0.85c e 54.54±3.09c e治疗后36周 27.21±1.17d e 23.43±1.61d e 52.56±1.41d e F 4.3603.1203.112 P 0.6010.1020.053对照组 60治疗前34.33±1.0333.11±1.1262.23±2.21治疗后1周34.12±1.4433.23±1.3362.22±1.72治疗后12周 35.23±1.1430.41±1.2459.36±1.34治疗后24周 34.17±1.2132.13±0.7364.76±1.36治疗后36周 32.22±1.8533.16±1.4565.38±0.89 F 2.2021.1986.125 P 0.2310.6270.371 F/P治疗后1周3.251/0.2341.036/0.520 4.021/0.212(治疗组VS对照组) 治疗后12周 4.012/0.3154.025/0.412 4.652/0.301治疗后24周 3.024/0.2106.221/0.136 6.021/0.210治疗后36周 2.014/0.4714.014/0.103 7.025/0.051
3 讨论
GA是继高血压、糖尿病、高脂血症后的“第四高”,是一种慢性全身性疾病,可导致心脏、肝脏及肾脏等多个靶器官的损伤。现代医学研究[13-14]表明,痛风性关节炎临床症状的发生与嘌呤代谢障碍和/或高尿酸导致尿酸盐结晶沉积在关节或关节周围组织中高度相关,学者普遍认为其主要的发病机制是单钠尿酸盐结晶的异常沉积激活了多种免疫细胞并释放了诸多如IL-1β、TNF-α等炎症介质,加重关节组织炎症浸润。本研究检测间歇期痛风患者血液中CRP、ESR、BUA、TNF-α、IL-1β、IL-8等实验室指标,发现其水平呈明显升高,给予痛风煎联合苯溴马隆治疗后,患者尿酸沉积及炎症浸润状态减轻。同时治疗后的中医证候积分和VAS评分比较中,治疗组均优于对照组,患者各项症状均较治疗前明显改善。在安全性评价中,治疗组患者的肝肾功能损伤均低于对照组患者,说明痛风煎联合苯溴马隆具有改善痛风患者临床症状及病理状态的协同加强作用,并且能够降低苯溴马隆的毒副作用。
中医古籍对“痛风”的记载最早可追溯到元·朱丹溪《格致余论》中:“彼痛风者,大率因血受热已自沸腾,其后或涉冷水,或立湿地,或扇取凉,或卧当风。寒凉外抟,热血得寒,污浊凝涩,所以作痛。夜则痛甚,行于阴也。”痛风多由外感风寒湿热之邪侵袭血脉,致使血液凝滞,留于筋脉肌肉关节,瘀阻而发疼痛。清代名医吴谦在《医宗金鉴》中亦记载:“周痹亦在血脉之中……但患有定处……近世曰痛风,曰流火,曰历节风。”清·喻嘉言《医门法律》曰:“痛风,一名白虎历节风,实即痛痹也……合桂枝、麻黄等药同用,即发表不远热之义。”
痛风煎源于四妙散。四妙散始见于清代医家张秉承所著的《成方便读》一书,由苍术、黄柏、牛膝、薏苡仁组成,原方主治湿热下注之痿证,后被医家用于治疗痛风[15-16]。痛风煎在四妙散的基础上加白术、土茯苓、萆薢、车前草、桂枝,去黄柏。该方以白术、苍术为君药,二者共奏健脾、燥湿、化痰之功,为治疗湿热痹证之要药;土茯苓、萆薢为臣,祛风清热除湿,分清别浊;佐以车前草、薏苡仁加强君药健脾利水渗湿之功;使以桂枝、牛膝活血化瘀,消肿通络止痛。诸药合用,健脾补肾,清热泄浊,祛瘀涤痰。现代药理研究表明,白术具有明显且持久的抗利尿作用,对胃肠系统有双向调节作用,能抗胃溃疡,有解痉、保肝、抗菌等药理作用[17-18]。苍术也具有抗胃溃疡、抗肝损伤作用,同时对尿酸盐的体外溶解有一定促进作用[19]。土茯苓醇提物大孔树脂分离的70%洗脱物能显著降低小鼠血尿酸含量[20]。研究还发现土茯苓总黄酮可通过调控p38/ERK MAPK信号通路改善膜性肾病大鼠炎症反应和细胞凋亡,抑制膜性肾病大鼠细胞上皮-间充质转化过程[21]。萆薢总皂苷可显著降低实验小鼠高尿酸血症模型的尿酸水平,并抑制炎症因子(IL-1β、IL-8、TNF-α等)的合成与释放,从而发挥防治痛风性关节炎的作用[22]。车前草提取物通过下调肾脏mURAT1 mRNA的表达而降低高尿酸血症小鼠血清尿酸水平,并且能够抑制肝脏黄嘌呤氧化酶与腺苷脱氨酶活性,对肝肾具有保护作用[23]。薏苡仁提取物可镇痛是因为对黄嘌呤氧化酶具有明显的抑制作用[24]。桂枝挥发油具有解热抗炎作用,能够缓解GA患者关节的红肿热痛[25]。从牛膝中所提取的生物碱具有抑制血小板聚集、扩张血管作用,能增加肾血流量,延缓慢性肾损害,具有镇静、镇痛作用,可改善痛风患者的疼痛体验和焦躁抑郁情绪[26]。近30年中医药治疗痛风临床用药规律数据挖掘研究[27]显示,白术、苍术、土茯苓、萆薢、薏苡仁、牛膝等中药使用频数较高,充分证明众多医家对上述中药治疗痛风性关节炎的作用有着高度的认可。
综上,西药治疗间歇期GA发挥的是单向靶点作用,虽然能够快速缓解患者临床症状,但存在一定的副作用,而中药方剂因为内部的配比及协同作用,能够从整体和全身出发,发挥多靶点的作用,抑制痛风性关节炎对身体多脏器的伤害。痛风煎联合苯溴马隆的中西医结合治疗,能够充分利用双方优势,协同有效地改善疾病相关中医证候,减轻关节肿胀及疼痛状况,降低尿酸沉积及机体炎症浸润,不良反应较少且远期预后良好。但中西医如何更好结合并充分利用其优势,仍然面临诸多挑战,在今后中医药诊疗GA过程中应当对行之有效的治疗方法更好地推广和应用,加强两者诊疗方面的深度结合。
