青藤碱通过MAPK/ERK/mTOR通路诱导自噬抑制人食管癌TE-1细胞增殖*
2023-07-12肖文涛叶玉海陈伟毅湖南医药学院湖南怀化418000
陈 耀,肖文涛,叶玉海,陈伟毅(湖南医药学院,湖南 怀化 418000)
食管癌是常见的消化道恶性肿瘤之一,全世界每年约有30万人死于食管癌。我国是世界上食管癌高发地区之一,每年平均病死约15万人[1]。化疗是治疗食管癌的主要方法之一,然而食管癌对化疗并不敏感,且耐药性很高。目前应用的多种药物总体疗效评价均不理想[2]。因此,积极寻找新的抗食管癌药物,对于改善食管癌的化疗效果、提高临床疗效具有重要作用。
青藤碱为青风藤及毛青藤的干燥藤茎中提取的生物碱单体,分子式为C19H23NO4。青藤碱具有抗炎、抗心律失常、抗血管新生等作用,主要用于治疗心律失常和类风湿关节炎等疾病[3]。最近研究表明青藤碱具有抗肿瘤作用,可以抑制多种肿瘤生长,如乳腺癌、肝癌、肺癌等[4-6],但青藤碱对食管癌的作用尚未明确,相关报道甚少。故本研究拟探讨青藤碱对人食管癌TE-1细胞增殖的影响,以期为青藤碱在临床上应用于抗食管癌治疗提供依据。
1 材料与方法
1.1 仪器与试剂 CKX53型光学显微镜、Ti2型荧光显微镜(日本Nikon公司);Forma Steri-Cycle型CO2细胞培养箱(美国赛默飞公司);EPOCH酶标仪(美国BioTek公司);CytoFLEX型流式细胞仪(德国Beckman公司);1658033型聚丙烯酰胺垂直电泳系统、凝胶成像系统(美国Bio-Rad公司)。
青藤碱(北京索莱宝科技有限公司,批号:SS8560);RPMI 1640(Thermo Fisher Scientific公司,批号:22400071);Hochest染色试剂(批号:CA1120)、DAPI染色试剂(批号:C0065)、ANNEXIN V-FITC/PI凋亡检测试剂盒(批号:CA1020)均购自北京索莱宝科技有限公司);LC3-Ⅰ抗体(批号:4599)、LC3-Ⅱ抗体(批号:2775)、Beclin-1抗体(批号:3738)、β-actin抗体(批号:4970)均购自美国CST公司;ERK1/2抗体(批号:ab201015)、p-ERK1/2抗体(批号:ab184699)、mTOR抗体(批号:ab109268)、p-mTOR抗体(批号:ab32028)均购自英国Abcam公司;HRP-labeled羊抗兔IgG(批号:A0201)、Cy3-labeled羊抗兔IgG(批号:A0516)均购自上海碧云天生物技术有限公司。
1.2 细胞 人食管癌TE-1细胞(中国科学院典型培养物保藏委员会细胞库,批号:TCHu 89)。
1.3 方法
1.3.1 细胞培养 人食管癌TE-1细胞用含10%胎牛血清的RPMI 1640培养基培养于37 ℃、5%CO2的细胞培养箱中,每隔48 h消化传代后开展实验。
1.3.2 预实验及分组 将处于对数生长期的食管癌TE-1细胞分为对照组、青藤碱50 mg/L组、青藤碱80 mg/L组、青藤碱100 mg/L组、青藤碱200 mg/L组、青藤碱300 mg/L组、青藤碱400 mg/L组、青藤碱800 mg/L组、青藤碱1 200 mg/L组,根据分组予以相应浓度青藤碱作用24 h后,采用光学显微镜观察细胞密度,发现青藤碱80 mg/L组和青藤碱100 mg/L组细胞密度与对照组比较,差异无统计学意义(P>0.05),青藤碱1 200 mg/L组细胞密度明显低于对照组(P<0.05),因此后续实验将青藤碱浓度设置为200、400、800 mg/L。将TE-1细胞分成对照组、青藤碱200 mg/L组、青藤碱400 mg/L组、青藤碱800 mg/L组。
1.3.3 Hochest染色检测活细胞数 将浓度为1×106个/mL的对数生长期TE-1细胞接种在6孔板中,2.5 mL/孔,待细胞铺满至板底约80%,根据分组予以相应药物处理24 h,吸去培养液,加入Hochest染色剂充分覆盖细胞孵育5 min,吸去染色剂,PBS洗3次,荧光显微镜观察并拍照。
1.3.4 CCK8检测细胞抑制率 将浓度为1×106个/mL的对数生长期TE-1细胞接种在96孔板中,100 μL/孔,待细胞完全贴壁后根据分组予以相应药物处理24、48、72h后,每孔加入10μL CCK8试剂继续孵育1 h,用酶标仪检测细胞在450 nm处的吸光度(OD值),并计算细胞抑制率。细胞抑制率=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.3.5 流式细胞术检测细胞凋亡 将浓度为1×106/mL的对数生长期TE-1细胞接种在6孔板中,2.5 mL/孔,待细胞铺满至板底约80%,根据分组予以相应药物处理24 h,胰酶消化收集细胞,Annexin V-FITC/PI双染进行染色标记,采用流式细胞仪检测细胞凋亡情况,以右下象限为细胞凋亡率。
1.3.6 透射电镜观察自噬小体形成 将浓度为5×106个/mL的对数生长期TE-1细胞接种在培养瓶中,5 mL/瓶,待细胞铺满至瓶底80%时,根据分组予以相应药物处理24 h,吸去培养液,4 ℃戊二醛固定液固定30 min,收集细胞于1.5 mL的EP管中,离心、脱水、包埋、超薄切片后,在透射电镜下观察自噬小体形成情况。
1.3.7 免疫荧光检测LC3表达 在6孔板内放入无菌盖玻片,将对数生长期的TE-1细胞接种于盖玻片上,根据分组予以相应药物处理24 h后,PBS洗3遍,多聚甲醛固定20 min,TritonX-100进行细胞通透,封闭20 min,加入一抗4 ℃过夜,再加入二抗室温孵育2 h,PBS洗3遍,加入DAPI染色5 min,封片,在荧光显微镜下观察拍照。
1.3.8 Western blotting检测LC3-Ⅰ、LC3-Ⅱ、Beclin-1、ERK1/2、p-ERK1/2、mTOR、p-mTOR蛋白相对表达量 根据分组予以相应药物处理24 h,用含有PMSF的细胞裂解液提取处理后的各组细胞中的总蛋白,BCA法测蛋白的浓度,对各组溶液进行定量处理,之后放在100 ℃金属浴加热10 min。配制5%的浓缩胶和12%的分离胶,将提取的蛋白加入SDS-PAGE胶样孔内,先设置80 V的电压待样品跑出一定量后转为120 V电泳;随后用半干转印仪以恒流1.5 A的条件转膜30 min,将蛋白转印到PVDF膜上,再使用5%脱脂奶粉进行常温封闭2 h,封闭结束后使用TBST洗膜分3次加入相应一抗进行孵育,孵育条件为4 ℃冰箱过夜,次日继续洗膜3次,加入相应二抗,在常温孵育2 h后洗膜3次;吸取适量的超敏发光液滴加到PVDF膜蛋白条带上,利用凝胶成像系统曝光,以β-actin为内参,用Quantity one软件进行灰度值分析。
1.4 统计学方法 采用SPSS 26.0软件进行统计分析,计量资料以(±s)表示,经检验均符合正态分布且方差齐性,组间比较采用单因素方差分析,两两比较采用Dunnett-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 青藤碱对TE-1细胞增殖的影响
2.1.1 各组细胞形态比较 与对照组比较,经200、400、800 mg/L青藤碱作用24 h后,细胞皱缩、变圆,贴壁细胞不断减少,漂浮细胞不断增多,表明青藤碱抑制细胞增殖。(见图1)
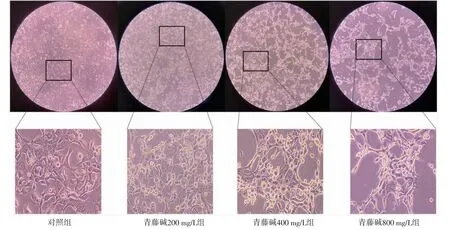
图1 青藤碱对TE-1 细胞增殖的影响 (×40,×400 截取)
2.1.2 各组TE-1活细胞数比较 青藤碱200、400、800 mg/L组活细胞数比例显著低于对照组(P<0.01),表明青藤碱能抑制TE-1细胞增殖。(见图2~3)

图2 Hochest 染色 (×100)

图3 各组TE-1 活细胞数比较 (±s,n=3)
2.1.3 各组TE-1细胞抑制率比较 青藤碱200、400、800 mg/L组TE-1细胞抑制率显著高于对照组(P<0.01),表明青藤碱能抑制TE-1细胞增殖。(见图4)

图4 各组TE-1 细胞抑制率比较 (±s,n=3)
2.2 青藤碱对TE-1细胞自噬、细胞凋亡的影响
2.2.1 各组TE-1细胞凋亡率比较 青藤碱200、400、800 mg/L组TE-1细胞凋亡率显著高于对照组(P<0.01),表明青藤碱能促进TE-1细胞凋亡。(见图5~6)

图5 各组细胞凋亡流式图

图6 各组TE-1 细胞凋亡率比较 (±s,n=3)
2.2.2 各组TE-1细胞内自噬小体数量比较 青藤碱200、400、800 mg/L组TE-1细胞内自噬小体数量明显多于对照组,表明青藤碱能诱导TE-1细胞自噬。(见图7)

图7 各组自噬小体形成情况
2.2.3 各组TE-1细胞LC3表达比较 青藤碱200、400、800 mg/L组TE-1细胞LC3表达显著高于对照组(P<0.01),表明青藤碱能诱导TE-1细胞表达LC3。(见图8~9)

图8 各组TE-1 细胞LC3 表达 (免疫荧光检测,×400)

图9 各组TE-1 细胞LC3 表达比较 (±s,n=3)
2.2.4 各组TE-1细胞LC3-Ⅰ、LC3-Ⅱ、Beclin-1蛋白相对表达量比较 青藤碱200、400、800 mg/L组TE-1细胞LC3-Ⅱ/LC3-Ⅰ比值、Beclin-1蛋白相对表达量均显著高于对照组(P<0.01),表明青藤碱诱导TE-1细胞自噬蛋白表达。(见图10~11)

图10 各组TE-1 细胞LC3-Ⅰ、LC3-Ⅱ、Beclin-1 蛋白表达Western blotting 图

图11 各组TE-1 细胞LC3-Ⅱ/LC3-Ⅰ比值、Beclin-1 蛋白相对表达量比较 (±s,n=3)
2.3 各组TE-1细胞ERK1/2、p-ERK1/2、mTOR、p-mTOR蛋白相对表达量比较 青藤碱200、400、800 mg/L组TE-1细胞p-ERK1/2/ERK1/2、p-mTOR/mTOR比值显著低于对照组(P<0.01),表明青藤碱能抑制TE-1细胞MAPK/ERK/mTOR通路激活。(见图12~13)

图12 各组TE-1 细胞ERK1/2、p-ERK1/2、mTOR、p-mTOR蛋白表达Western blotting 图

图13 各组TE-1 细胞p-ERK1/2/ERK1/2、p-mTOR/mTOR比值比较 (±s,n=3)
3 讨论
食管癌是我国常见恶性肿瘤之一,化疗是针对中晚期食管癌的重要治疗手段,但肿瘤耐药严重影响了食管癌化疗疗效和患者预后[7]。因此急需寻找新的抗食管癌药物提高临床疗效。青藤碱是从青风藤及毛青藤的干燥藤茎中提取的一种生物碱,临床多用于抗风湿治疗[8]。近年研究发现,青藤碱可以抑制多种肿瘤细胞生长[9],具有较好的抗肿瘤作用。但青藤碱是否具有抗食管癌作用尚未明确。
本研究发现,青藤碱可以抑制TE-1细胞增殖,诱导TE-1细胞凋亡。此外,青藤碱可以诱导TE-1细胞自噬,并抑制MAPK/ERK/mTOR通路激活。因此,青藤碱可以抑制TE-1细胞增殖,其机制与抑制MAPK/ERK/mTOR通路激活和诱导自噬有关。
青藤碱的抗肿瘤作用已在多种癌症中被证实。XU H等[10]研究表明,青藤碱可以通过下调LncRNA-HEIH表达来抑制膀胱癌细胞的增殖。QU X等[11]研究发现,青藤碱可以下调CDK1的表达来抑制卵巢癌细胞增殖。BAI S等[12]研究表明,青藤碱可以负调节α7烟碱乙酰胆碱受体,抑制肺癌细胞增殖。本研究发现,青藤碱可以抑制食管癌TE-1细胞增殖,与上述研究一致。
细胞凋亡是各种因素触发细胞内预存的死亡程序而导致的细胞死亡过程,其特征为线粒体膜电位丧失、细胞色素C释放到细胞质中及Caspase-9激活[13]。研究表明,诱导细胞凋亡有助于抗肿瘤治疗[14]。青藤碱可以诱导多种肿瘤细胞凋亡,如XU F等[15]研究表明青藤碱可以诱导前列腺癌细胞凋亡;ZHENG X等[16]研究表明青藤碱可以诱导胶质母细胞瘤细胞凋亡;前期研究[17]发现青藤碱可以诱导胰腺癌细胞凋亡。本研究发现,随着青藤碱的浓度不断升高,细胞凋亡率逐渐上升,表明青藤碱可以诱导食管癌细胞凋亡。
自噬是在相关基因的调控下,自噬细胞溶酶体依赖性地降解细胞内受损的细胞器及大分子物质的过程。适度自噬有利于肿瘤细胞生存,而过度自噬会导致肿瘤细胞出现自噬性死亡[18]。研究发现多种中药成分可以通过诱导肿瘤细胞自噬性死亡起到抗肿瘤效果[19]。青藤碱可以诱导胶质母细胞瘤[16]、黑色素瘤[20]、肾癌[21]等肿瘤自噬而发挥抗肿瘤作用。本研究发现,在青藤碱的作用下,食管癌TE-1细胞自噬水平及细胞凋亡率上升,表明青藤碱可能通过诱导自噬促进TE-1细胞产生自噬性死亡,从而抑制其增殖。
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号转导通路存在于大多数细胞内,该信号通路可将细胞外刺激信号转导至细胞及其核内,并引起细胞增殖、分化、转化及凋亡等一系列生物学反应[22]。MAPK/ERK/mTOR信号通路是MAPK信号通路中的主要信号通路,可激活mTOR,从而抑制自噬[23]。研究发现MAPK/ERK/mTOR通路在多种肿瘤中被异常激活,与肿瘤的发生、发展、转移和耐药密切相关[24]。本研究发现,青藤碱可以降低p-ERK1/2/ERK1/2、p-mTOR/mTOR比值,并促进自噬水平上升,表明青藤碱可能通过抑制MAPK/ERK/mTOR通路激活,从而诱导TE-1细胞自噬。
综上所述,青藤碱能抑制食管癌TE-1细胞增殖,其机制可能与抑制MAPK/ERK/mTOR通路激活诱导自噬有关。本研究为青藤碱应用于抗食管癌治疗提供了实验依据,同时也为探讨青藤碱的抗食管癌作用机制提供了一种新的思路。青藤碱作为一种中药材提取的生物碱,具有来源广泛、价格低廉、毒副作用小等优点,因此其临床应用前景非常广阔[25]。然而,本研究也存在不足,如:本研究只进行了细胞实验,未进行动物实验及临床研究,同时并未使用MAPK/ERK/mTOR通路激活剂对其进一步验证等。故后续研究应进一步完善研究内容。
