胶体中的化学
2023-07-12朱英洁
清晨,一缕晨光倾泻而下,在林间留下一条光亮的通路;卤水滴入豆浆,就能结成豆腐;黄河三角洲的形成,主要是含硅酸盐胶体的黄河水遇海水中的盐分发生了胶体的聚沉……这些现象都离不开胶体。胶体的性质多种多样,在生活中的应用也不胜枚举。

溶液、胶体和浊液的粒度比较示意图(1厘米=107纳米)
分散体系的划分
——什么是胶体?
在我们生活的环境中,多数物质是以两种或两种以上的纯净物以混合物的形式存在。一种或者几种物质(分散相)分散到另一种物质(分散介质)中所形成的混合物体系,叫作分散体系,例如盐水溶液,其中氯化钠(NaCl)为分散相,水(H2O)为分散介质。
根据分散相粒径的不同,分散体系可分成3类:粗分散体系(浊液),例如含有泥沙的黄河水,泥沙能够通过肉眼观察到,该体系不能稳定地存在,静止后泥沙会沉淀,与液体分离;胶体分散体系;分子分散体系(溶液),例如盐水,氯化钠可以稳定地分散在水中,静置一段时间后,上层的口感与底层仍然一样,说明浓度一致。
胶体的分散介质可以是固体、液体和气体,根据其状态不同,可以将胶体分为固溶胶、液溶胶和气溶胶。
丁达尔效应
——留下光的通路
当你在清晨途经林间小道时,可能会看到阳光透过树叶的间隙倾泻而下的美丽景象。“林间光束”涉及的原理是1869年英国科学家约翰·丁达尔提出的丁达尔效应,即:当一束光线透过胶体时,从入射光的垂直方向,可以观察到胶体中出现的一条光亮的“通路”。这里充当胶体的是林间的湿润空气所形成的气凝胶——雾气。

光束穿过溶液、胶体和浊液的示意图
我们周围的可见光波长范围为400~700纳米,大于胶体与溶液中的分散质粒子直径。当可见光与这些粒子相遇时,会环绕粒子而向其四周散射,形成散射光。我們肉眼可见的物体,它的尺寸往往远大于可见光的波长,只会发生反射与折射等。
对于溶液体系,由于其中的粒子尺寸很小,散射光的强度会明显减弱。相比之下,粒子尺寸稍大的胶体中光的散射作用更明显,从而体现为丁达尔效应。至于浊液,由于其粒子尺寸过大,光的传播被完全隔断,完全没有光“通路”出现。因此,经常通过丁达尔效应鉴别分散系是否为胶体。
胶体
——从原理到生活应用
胶体不带电,但单独的胶体粒子(简称胶粒)是带有电荷的,带有正电荷或负电荷的离子包裹在其外,形成多层核状结构,而胶粒具体是带正电还是负电取决于正负离子的比例。
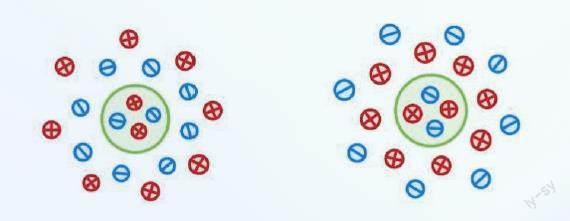
左为带正电的胶粒,右为带负电的胶粒(供图/朱英洁)
胶体能够稳定的原因,在于胶粒带有某种相同的电荷互相排斥,同时胶粒在三维空间的受力不平衡产生的无规则运动也促进了胶体的稳定,这种运动被称为布朗运动。需要注意的是,胶粒都具备布朗运动性质,但布朗运动不是胶体特有的性质,悬浮的颗粒也会在液体或气体中做永不停息的布朗运动。
由于胶粒的带电特性,使得胶体容易受到外来带电体或外加电场的影响。向胶体中加入其他电解质溶液或胶体时,其中的阴离子(带负电荷)或阳离子(带正电荷)会中和胶体粒子所带的相反电荷,使胶体粒子聚集成较大颗粒,从而形成沉淀并析出。这一现象称为聚沉,我们常见的卤水点豆腐、使用明矾吸附水中杂质达到净水效果,均是应用了胶体的这一特性。喜欢书法的读者要注意啦,墨水也是胶体,所以不同品类的墨水不要随意混合,易引起聚沉。
此外,由于胶粒带电,当我们把胶体接入电场后,带有电荷的胶粒会在电场的作用下向两极移动,不同电荷量的胶体移动速度也会不同,这一现象称为电泳。应用这一特性可以实现不同物质的分离。
我们生活的每一天都离不开胶体——大自然赐予的烟、云、雾和水晶,我们餐桌上的牛奶、豆浆,洗手后的肥皂水,有色玻璃制成的墨镜等。只有充分地了解,才能更好地利用。
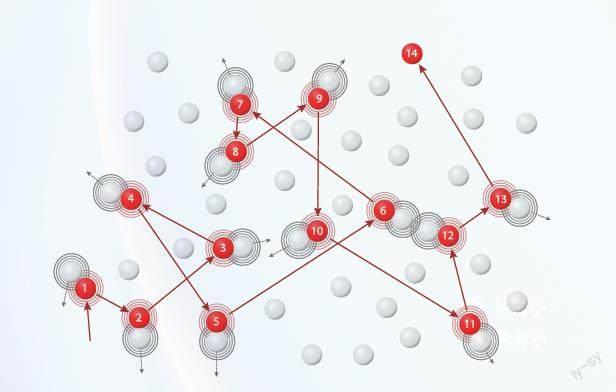
布朗运动示意图
(责任编辑 / 张丽静 美术编辑 / 周游)
