消化道炎性纤维性息肉的内镜诊疗情况及随访结果分析
2023-07-11庞雨馨何兴康孙蕾民
庞雨馨,何兴康,孙蕾民
(浙江大学医学院附属邵逸夫医院 消化内科,浙江 杭州 310016)
炎性纤维性息肉(inflammatory fibroid polyp,IFP)是一种罕见的间叶组织来源的良性肿瘤,主要发生于消化道,可累及消化道任何部位。在早期的IFP个案报道中,患者多因急腹症而采用手术治疗。随着内镜技术的发展,消化内镜逐渐成为IFP的重要诊治手段。内镜下常用的治疗方式有直接切除、内镜下黏膜切除术(endoscopic mucosal resection,EMR)、内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)。由于缺乏对IFP的内镜特点的认识,以及局部活检具有一定的漏检率,IFP易与其他黏膜或黏膜下病变混淆,造成误诊[1]。此外,IFP存在复发及浸润的可能[2-5]。本研究纳入了93例经内镜诊治的消化道IFP病例,分析其临床特征、内镜特点、治疗方式、随访结果,为IFP的内镜下诊断提供依据,并探讨不同内镜下治疗方式的安全性和有效性。
1 对象与方法
1.1 研究对象 选取我院2011年7月—2022年4月经消化内镜检查和治疗,术后病理明确诊断为炎性纤维性息肉的患者。排除标准:①病历资料不详实,未对IFP的部位、数量、大小、形态、治疗方式进行描述者;②内镜术后行手术治疗者;③失访者。本研究通过医院医学伦理委员会批准,所有患者知情同意。
1.2 资料收集 通过病历系统、内镜系统、病理系统收集患者的一般资料、病历信息、内镜资料及病理资料。在收集我院内镜随访记录的基础上,进行电话随访。
1.3 观察指标
1.3.1 内镜特点 ①息肉的部位:食管、胃(贲门、胃底、胃体、胃窦)、小肠(十二指肠、空肠、回肠)、结肠(升结肠、横结肠、降结肠、乙状结肠)、直肠。②息肉的大小:直径或最大径。③运用山田分型对息肉进行形态分类:Ⅰ型息肉呈丘状隆起,息肉隆起与黏膜间角>90°;Ⅱ型息肉呈半球形,息肉隆起与黏膜间角<90°;Ⅲ型息肉亚蒂,息肉与黏膜间角<90°;Ⅳ型息肉有蒂,长短不一。④表面状态。⑤生长状态:单发或多发。⑥超声内镜表现:病灶起源、回声特征、边界及各层次完整性。
1.3.2 治疗情况 ①内镜治疗方式。直接切除,包括活检钳、冷圈套器切除或圈套器电凝切除;EMR,于病变基底部黏膜下注射适量生理盐水抬高后,使用圈套器切除;ESD,标记病灶边缘后,黏膜下注射抬高,再利用各种电刀对病变进行黏膜下剥离。②并发症情况。术中出血,指术中操作引起的任何出血;术中穿孔,指手术操作直接导致的穿孔[6];迟发性出血,指术中充分止血、术后出现:A.呕血、黑便、头晕等症状,B.血红蛋白下降>20 g/L,C.血压下降>20 mmHg或心率增加>20次/分钟,D.胃镜检查提示术后溃疡出血(Forrest I,IIa-IIb型)或穿孔中的至少两项[7];迟发性穿孔,手术期间无穿孔,而术后突然出现腹膜或纵膈胸膜刺激症状,或术后腹部平片、胸腹部CT提示有游离气体存在[8-9]。③住院天数,包括住院总天数及术后住院天数。
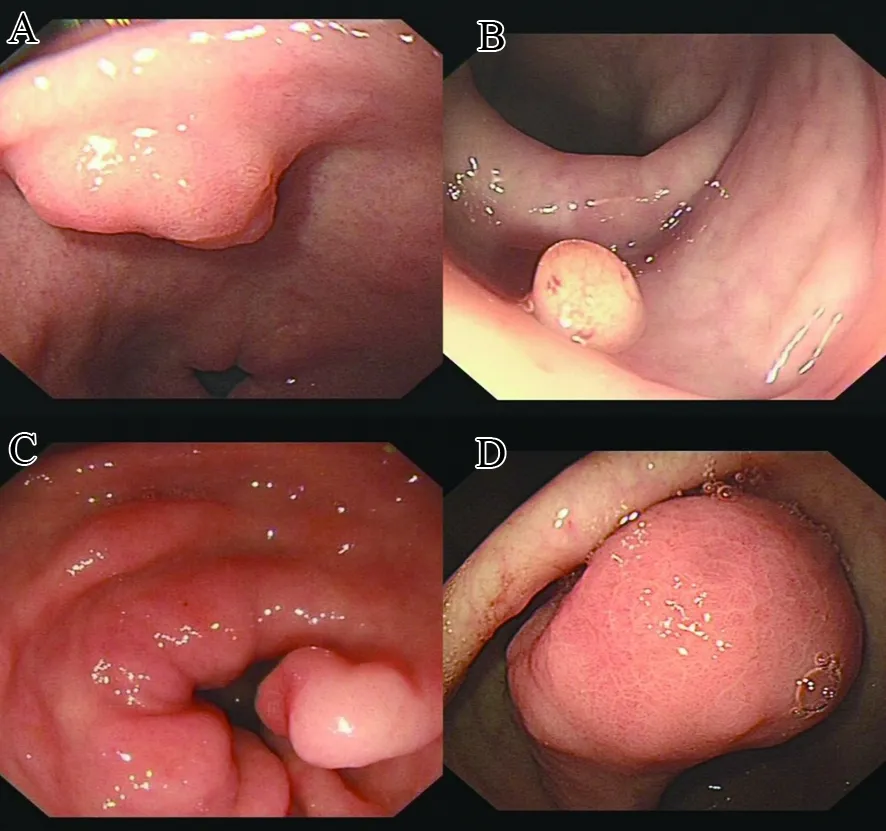
A.胃窦小弯见一山田Ⅰ型隆起,最大径约1 cm,形态不规则,表面粗糙;B.乙状结肠距肛15 cm可见一山田Ⅱ型隆起,大小约1 cm,椭球形,表面光滑,血管纹路明显;C.胃窦后壁见一山田Ⅲ型隆起,最大径约0.8 cm,形状不规则;D.幽门前区可见一山田Ⅳ型占位,最大径约6 cm,表面粗糙、糜烂。图1 普通内镜下息肉形态Figure 1 Morphology of polyps under common endoscope

A.起源于黏膜深层的低回声占位,回声均匀,边界清晰;B.起源于黏膜下层的低回声占位,混有偏高回声结构,边界欠清;C.起源于黏膜深层的中低回声结构,回声尚均匀,边界清晰;D.起源于黏膜深层的高回声肿块,回声不均匀,边界欠清,易误诊为脂肪瘤。图2 IFP超声内镜下表现Figure 2 Endoscopic ultrasonography of IFP

A.瘤细胞呈束状或旋涡状排列,伴大量炎细胞浸润(HE×40);B.肿瘤组织有丰富的血管,瘤细胞常围绕血管形成“洋葱皮”样结构,伴炎细胞浸润和间质水肿(HE×100);C.梭形细胞围绕血管形成“洋葱皮”样结构(HE×200);D.肿瘤组织CD34染色呈强阳性(×200)。图3 IFP组织病理学及免疫组织化学染色表现Figure 3 Histopathological and immunohistochemical staining of IFP
1.3.3 病理特点 描述 IFP的组织病理学、免疫组化特点。
1.3.4 随访结果 统计随访期间患者的复发情况。
1.4 统计学方法 采用SPSS 26.0统计软件进行统计学分析。计数资料用频率和百分比描述;正态分布的计量资料用均数±标准差描述,非正态分布的计量资料用中位数及四分位数范围描述。
2 结果
2.1 临床一般资料 共纳入研究对象93例,男性35人,女性58人,年龄41~82岁、平均(60.09±9.42)岁。34例合并高血压,7例合并糖尿病,5例有恶性肿瘤史,其中3例位于消化道。9例直系亲属有消化道癌症史。53例(57.0%)无症状于体检时发现,16例(17.2%)腹痛,10例(10.8%)腹胀或腹部不适,7例(7.5%)黑便或血便,3例(3.2%)纳差或恶心呕吐,2例(2.2%)反酸嗳气,1例(1.1%)大便不成形,1例(1.1%)肛口肿物脱出。
2.2 内镜特点
2.2.1 普通内镜 93例消化道IFP患者中,病灶位于食管下段1例(1.1%);胃69例(74.2%),其中贲门1例(1.1%),胃体8例(8.6%),胃窦60例(64.5%);小肠3例(3.2%),其中十二指肠1例(1.1%),回肠2例(2.2%);大肠20例(21.5%),其中升结肠1例(1.1%),横结肠6例(6.5%),降结肠2例(2.2%),乙状结肠4例(4.3%),直肠7例(7.5%)。病灶最大径<1.0 cm者32例(34.4%),1.0~<2.0 cm者34例(36.6%),2.0~<3.0 cm者17例(18.3%),3.0~6.0 cm者10例(10.8%)。单发85例(91.4%),多发8例,共计101个病灶。山田分型Ⅰ型的病灶51个(50.5%),Ⅱ型29个(28.7%),Ⅲ型10个(9.9%),Ⅳ型11个(10.9%),见图1。病灶呈扁平形13个(12.9%)、半球形35个(34.7%)、椭球形19个(18.8%)、球形6个(5.9%)、分叶状或其他不规则形状28个(27.7%);表面光滑完整31个(30.7%),粗糙、充血、糜烂58个(57.4%),溃疡、凹陷10个(9.9%),豹纹样变2个(2.0%)。
2.2.2 超声内镜 研究对象中25例行超声内镜检查,共计检查病灶26个。经两位消化内科医师重新阅片,最终确认病灶起源于黏膜层17个(65.4%),黏膜下层9个(34.6%);低回声13个,中等偏低回声7个,中等回声3个,高回声3个;回声均匀12个,不均匀14个;边界多清晰(21个,80.8%),见图2。病灶各层次均完整。超声内镜下,25例患者均被误诊,其中层次误判4例。1例直肠IFP在超声内镜下可探及动脉频谱,被误诊为早期肠癌;1例起源于黏膜下层的食管IFP被误诊为颗粒细胞瘤;1例起源于黏膜下层的胃IFP被误判为起源于黏膜肌层,被误诊为淋巴瘤;3例起源于黏膜深层的胃IFP被误判为起源于固有肌层,1例被误诊为神经鞘瘤,2例被误诊为平滑肌瘤;3例胃IFP起源于黏膜下层,低回声,回声不均匀,被误诊为异位胰腺;2例胃IFP分别起源于黏膜层和黏膜下层,高回声,被误诊为脂肪瘤;8例起源于黏膜层的IFP被误诊为胃息肉(6例)和炎性肿物(2例);余5例被误诊为胃肿物(性质待查)。
2.3 治疗情况 93例患者中,行内镜下直接切除42例,EMR治疗24例,ESD治疗27例。所有患者操作或手术一次成功。1例接受EMR治疗的患者术中创面少量出血,钛夹夹闭创面后血止;余患者均未出现出血、穿孔等并发症。住院患者中,中位住院总天数为4(1,7)天,中位术后住院天数为3(1,4)天。
2.4 病理特点 IFP光学显微镜下可见黏膜层或黏膜下层组织水肿,梭形细胞交错排列,伴小血管增生,不等量的淋巴浆细胞及嗜酸性粒细胞等浸润,常由梭形细胞围绕小血管形成“洋葱皮”样结构。细胞核呈梭形,核分裂象少或无(图3A-C)。胃IFP中,14例伴幽门螺杆菌感染。共37例完善免疫组织化学染色检查,35例行CD34检查,其中33例(94.3%)阳性(图3D);26例行CD117检查,2例散在阳性;19例行结蛋白(desmin)检查,2例平滑肌阳性;29例行S100检查,均为阴性;21例行平滑肌肌动蛋白(SMA)检查,3例呈弱阳性;23例行DOG-1蛋白染色,1例呈局灶阳性;19例行Ki-67检查,17例增殖活性<5%,2例增殖活性5%~10%。
2.5 随访结果 所有患者随访时间为6个月~11年,中位随访时间为52个月。复发1例,予内镜下圈套切除,恢复良好。余患者均无病灶复发。
3 讨论
IFP由Vanek[10]于1949年首先报道,Helwig等[11]于1953年首次将其命名为IFP。IFP的性质最初未得以明确,一般被认为是反应性炎症引起的组织增生。直到2008年,Schildhaus等[12]发现了IFP中存在广泛的PDGFRA基因突变,IFP开始被认为是一种肿瘤。2018年,Ricci等[13]提出IFP可能由一种分布广泛的间质细胞——特络细胞发展而来。IFP的病因仍未明确。
IFP好发于女性,本研究中男女比例约为1∶1.7;多发生于50~70岁。本研究中,大部分患者(57.0%)无症状,于内镜检查时偶然发现;有症状者以腹痛为主(17.2%);黑便或便血常由于IFP表面溃疡出血所致,常引起轻度贫血。以往的报道中,胃IFP占大多数,小肠为第二易受累及的器官,结肠为第三[14]。而本研究中,IFP最好发于胃,尤以胃窦多见,其次是大肠,小肠少见。这可能与临床上对小肠的内镜检查相对较少、检查不充分有关。大多数(89.2%)IFP最大径<3 cm,因此不易引起明显症状。大者可至6 cm。若大者累及小肠,易引起肠梗阻、肠套叠等急症,需手术治疗。大部分(91.4%)IFP为单发,这与以往个案报道一致。需注意的是,最早在1984年由Anthony等[15]报道了一种家族性、多发性、复发性的消化道IFP。由于患者常伴有体细胞PDGFRA基因突变,Ricci等[16]将其命名为“PDGFRA突变综合征”。患者常发生反复的肠梗阻或肠套叠,从而需接受多次手术治疗。虽然这种情况非常罕见,临床上仍需关注患者的IFP复发情况及家族史,尤其是IFP多发者,必要时进行PDGFRA基因检测,以期发现家族性IFP患者,进行密切的内镜随访,避免急症发生和频繁的手术。
本次研究显示,内镜下,IFP呈息肉样隆起,大部分无蒂,小部分可有亚蒂、短或长蒂,向腔内突出,形态多样;表面常粗糙、充血、糜烂。由于缺乏特异性,普通内镜下对病灶的辨别较困难。超声内镜下,2/3的病灶起源于黏膜层,多呈低回声,回声均匀或不均匀,边界常清晰。这与骆定海等[1]所报道的55.1%的病灶起源于黏膜下层的结果不相符,可能是由于本研究纳入了相当一部分仅直接切除得以确诊的病例,这些病例的病灶起源较浅。病灶侵犯固有肌层的情况罕见。本研究中,超声内镜下所有病例均被误诊;病变起源层次的误判率为15.4%。当肿瘤体积小、位置较深,伴有黏膜反应性增厚时,极易被误诊为普通息肉;黏膜下层可能受到肿瘤组织压迫而显示不清,此时若病灶呈低回声,易被误判为起源于黏膜肌层或固有肌层,与其他肿瘤混淆;当胃肿瘤来源于黏膜下层,呈不均匀回声,易被误诊为异位胰腺;来源于黏膜下层的高回声病灶易被误诊为脂肪瘤。当IFP起源于黏膜下层时,还需与胃肠道间质瘤(gastrointestinal stromal tumors,GISTs)进行鉴别,GISTs多为腔外生长,表现为起源于固有肌层的低回声实性肿块[17]。临床上可通过谨慎进行内镜操作和结果判读来降低误诊率。总之,IFP的内镜下诊断较困难,最终确诊仍需依靠病理组织学和免疫组织化学染色检查。
IFP病理特点为:低倍镜下,肿瘤组织位于黏膜层或黏膜下层,极少累及固有肌层及浆膜层;高倍镜下,间质疏松水肿,有突出的毛细血管网,常伴有嗜酸性粒细胞为主的炎细胞浸润,肿瘤细胞呈梭形、星形或多边形,常由梭形细胞围绕小血管形成“洋葱皮”样结构。IFP组织病理学特征具有一定特异性,符合其组织病理学特征即可作出诊断,有时可借助免疫组化和基因检测作进一步确诊及鉴别诊断。IFP的免疫组化特点为:CD34阳性,CD117、DOG-1、desmin、SMA、S100弱阳性或阴性,Ki-67<5%。据报道,约55.2%的IFP患者具有PDGFRA激活突变,其中以外显子12上的S566_E571delinsR点突变最多见[18]。
本研究中,内镜下直接切除、EMR和ESD均体现出良好的治疗安全性和便利性。随访结果显示,仅1例经直接切除的患者原部位复发,再次内镜下直接切除后未再发。这提示了,内镜下不同的治疗方式对IFP均具有良好的治疗效果。临床上可根据病灶的大小、深度、患者的治疗意愿选择合适的内镜治疗方式。此外,IFP与合并消化道肿瘤、消化道肿瘤家族史、远期消化道恶性肿瘤发生情况均无明显相关性,提示其为一种独立的良性肿瘤。
综上所述,IFP为一种病因未明的、可累及全消化道的、起源于黏膜层或黏膜下层的良性肿瘤。内镜下形态和超声内镜表现缺乏特异性,诊断主要依靠病理组织学,必要时辅以免疫组化和PDGFRA基因突变检测。内镜下不同的治疗方式均有良好的安全性、有效性。
