碳酸钙、碳酸钠与盐酸反应的实验探究
2023-07-11潘智阳吕春娇刘炳华
潘智阳 吕春娇 刘炳华

摘要:比较碳酸钠、碳酸钙性质及与盐酸反应的现象,发现其差异原因在于溶解性。利用pH传感器及液滴数传感器为测试手段,探究饱和碳酸钠溶液与不同浓度盐酸的反应,并从宏观、微观、符号、曲线四个角度分析反应现象,揭示盐酸与碳酸钠分步反应的实质。
关键词:碳酸钠;碳酸钙;盐酸;传感器;实验探究
文章编号:10056629(2023)06007604中图分类号:G633.8文献标识码:B
中学阶段各版本教材均涉及碳酸钠和碳酸钙性质的探究,都有与盐酸的反应,但实验方案均未具体标明所用盐酸的浓度,比如上海教育出版社2012年出版的初三化学教材(上)中描述为“稀盐酸”[1],江苏凤凰教育出版社2014年出版的高中化学教材(必修一)中描述为“浓盐酸”[2]。盐酸浓度究竟多少适宜呢?实验中我们发现不同浓度的盐酸分别与碳酸钙和碳酸钠反应时出现“异常”现象,盐酸浓度会直接影响实验结果,为此我们作了深入探究。
1 发现问题
在实验中发现,向两个分别装有碳酸钙粉末和碳酸钠粉末的烧杯中滴加0.1mol/L盐酸,发现只有碳酸钙产生气泡,而碳酸钠至完全溶解后也未观察到气泡,这似乎与“稀盐酸与碳酸钠反应最初不产生气泡,后来产生气泡”相违背!随后又分别用0.5mol/L和1.0mol/L的盐酸溶液加入碳酸钠、碳酸钙粉末中,发现两者均产生气泡。仅从化学式看,碳酸钙为CaCO3,碳酸钠为Na2CO3,均只有一个碳酸根,貌似与盐酸反应的结果应该一致。
2 分析问题
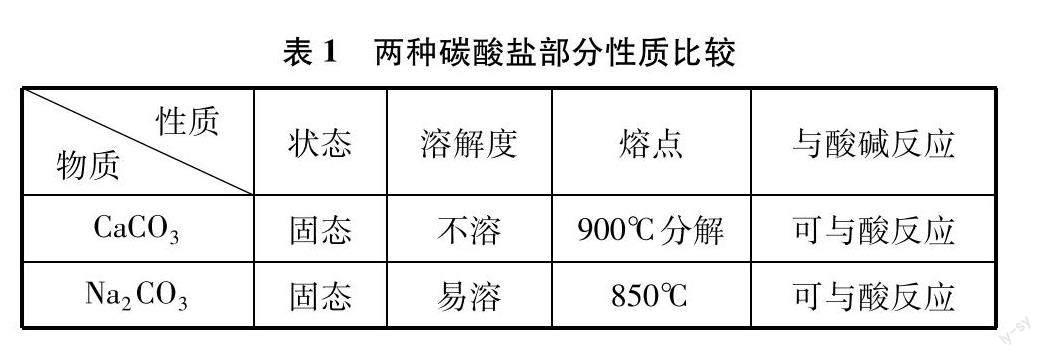
我们对碳酸钙和碳酸钠部分性质进行了比较,如表1所示。可见二者的状态、熔点、与酸碱反应的情况等几乎一致,但溶解度差异却很大,这可能是造成上述反应现象不同的原因。
当盐酸与碳酸钙粉末反应时,粉末会漂浮在溶液表层,在颗粒表面发生反应,产生的二氧化碳会直接逸出;而碳酸钠易溶于水,反应在溶液中进行,且在盐酸浓度很低情况下,反应生成的二氧化碳溶解在水中,不能大量逸出产生气泡。
分析相关文献发现,使用0.1mol/L的盐酸和碳酸鈉溶液互相滴加,均立即产生气泡[3]。使用的盐酸和碳酸钠溶液的浓度均为0.01mol/L,获得的pH、 CO2浓度变化的双纵坐标曲线与模拟曲线基本一致[4]。而我们选用不同浓度盐酸滴定碳酸钠粉末进行比较,发现产生二氧化碳需要大量低浓度盐酸,导致难以观察到气泡。
经上述分析,若保持碳酸钠溶液浓度不变,改变盐酸浓度,应当存在三种反应情况:
(1) 碳酸钠与盐酸反应很难观察到气泡;
(2) 碳酸钠与盐酸反应一开始不产生气泡,一段时间后明显产生气泡;
(3) 碳酸钠与盐酸反应一开始就能明显观察到气泡。
为此,笔者设计了三组实验,利用数字化实验设备对实验进行探究,并结合“四重表征”方法进行分析[5~7]。
3 实验设计
3.1 实验设计原理
化学反应:不同浓度的盐酸滴入碳酸钠溶液,盐酸先与碳酸根离子反应生成碳酸氢根。若酸过量,则会生成碳酸,并分解为二氧化碳逸出。
传感器:随着信息技术的发展,传感器产生并应用于中学实验教学,对于发展学生“宏观辨识与微观探析”等化学学科核心素养有三点优势:实验证据更加充足,可以得到实验进程中变化的数据;实验重复性好,相比传统实验,数字化实验条件的控制更精确,实验过程更稳定;增强了实验的探究性,可让学生通过曲线分析,培养和提高其探究能力。
四重表征:多重表征理论是应用于概念教学的理论,将多重表征理论与化学教学相结合一直是研究的热点[8]。从宏观、微观、符号、曲线四个角度分析实验并联系学生已有知识,能提高实验教学的有效性,增强科学探究的指向性。
3.2 实验仪器及用品
仪器:pH传感器、液滴数传感器及配套滴管、磁力搅拌器、数据采集器及其配套软件、烧杯、量筒、胶头滴管、玻璃棒
药品:12mol/L盐酸、无水碳酸钠粉末、去离子水、酚酞试剂、甲基橙试剂
3.3 实验装置
实验装置如图1所示。
3.4 实验步骤
(1) 分别配制1.0mol/L盐酸、0.5mol/L盐酸、0.1mol/L盐酸、饱和碳酸钠溶液。
(2) 按图1组装实验装置,调节滴管末端恰在液滴数传感器的中间位置。向滴管中加入去离子水,调节阀门控制至适宜流速,并确保液滴数传感器能准确记录数据。
(3) 润洗滴管2~3次,关闭开关阀,加入1.0mol/L盐酸,向烧杯中加入20mL饱和碳酸钠溶液,安装好pH传感器,确保pH传感器的玻璃泡浸没在溶液中,最后放入磁子。
(4) 向烧杯中滴入2~3滴酚酞指示剂,开始数据采集,缓慢打开磁力搅拌器,调整至合适转速,再打开开关阀。观察屏幕曲面变化和溶液颜色变化。待红色褪去后,立刻加入几滴甲基橙,继续观察屏幕曲线变化和溶液颜色变化,直至曲线完成第二个突跃,且曲线有变平的趋势时,关闭开关阀,停止数据采集。
(5) 依次用0.5mol/L、 0.1mol/L盐酸重复上述(3)、 (4)步骤,得到滴定曲线。
(6) 实验结束,拆除装置,洗净实验仪器,并规范收好传感器。
4 实验数据分析与结果
4.1 1.0mol/L盐酸滴定饱和碳酸钠溶液
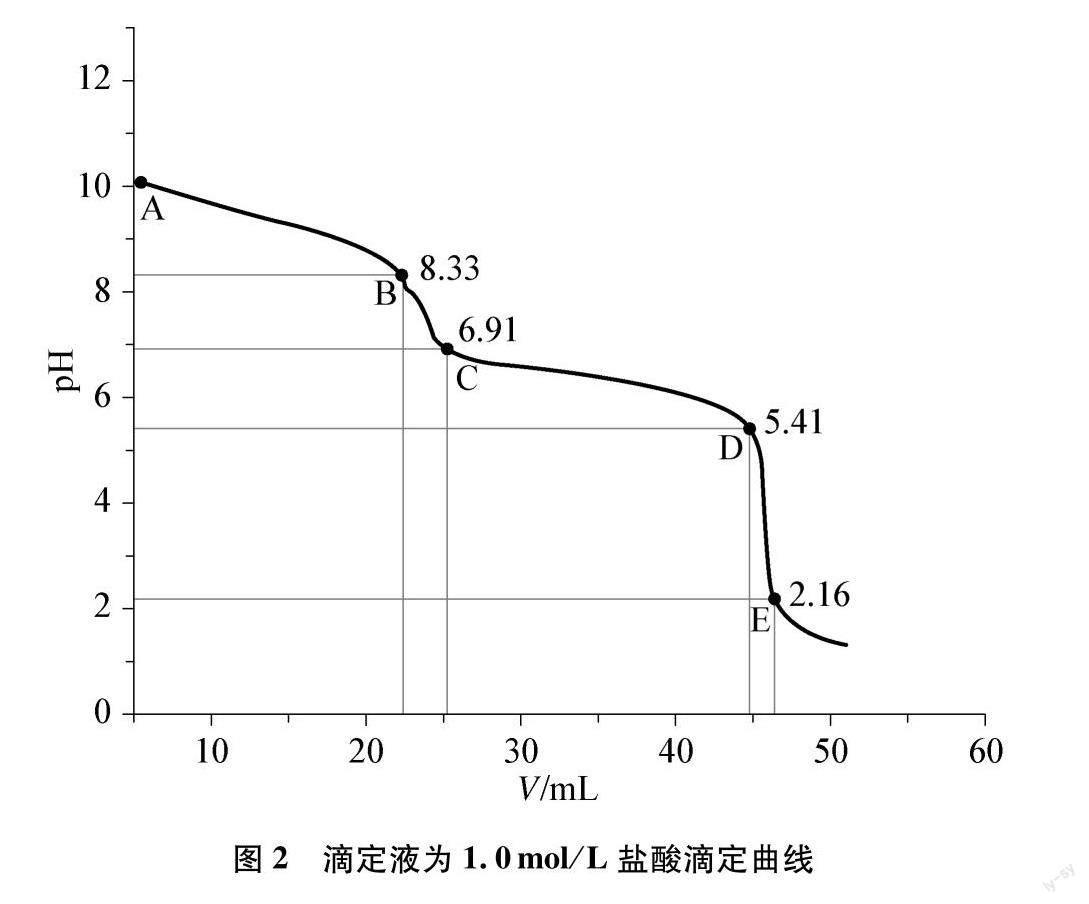
滴定曲线如图2所示。
[AB段]
曲线:曲线缓慢下降。
宏观:溶液红色逐渐变淡,有气泡产生。
微观:此时的气泡是由于局部浓度过大,盐酸在与碳酸钠接触的一瞬间,生成碳酸并分解为二氧化碳逸出,但总体上还是碳酸根向碳酸氢根离子转化的过程。
符号:
[BC段]
曲线:曲线迅速下降,在BC之间存在一个点代表碳酸根离子完全变为碳酸氢根。
宏观:溶液红色继续变淡直至无色,有气泡产生。
微观:当pH小于8后,酚酞完全褪色;剩余少量的碳酸根离子逐渐变为碳酸氢根,也有少量的碳酸氢根变为碳酸。
符号:
[CD段]
曲线:曲线缓慢下降。
宏观:溶液黄色逐渐加深,有气泡产生。
微观:此时碳酸氢根离子逐渐变为碳酸,碳酸会分解为二氧化碳逸出。
符号:
[DE段]
曲线:曲线迅速下降,在DE之间存在一个点代表碳酸氢根离子完全变为碳酸。
宏观:黄色继续加深为橙色,继续变为红色,有气泡产生。
微观:剩余少量的碳酸氢根离子逐渐完全变为碳酸,也有少量的碳酸分解为二氧化碳。
符号:
4.2 0.5mol/L盐酸滴定饱和碳酸钠溶液
滴定曲線如图3所示。
该浓度的滴定过程,AC之间不产生气泡,因为盐酸浓度减小,导致碳酸
根离子未能直接转化为二氧化碳逸出,而C点后逐渐产生气泡。反应历程同上。
4.3 0.1mol/L盐酸滴定饱和碳酸钠溶液
滴定曲线如图4所示。
该浓度滴定全程未能观察到明显气泡,因为盐酸浓度与碳酸钠浓度相差过大,无法观察到气泡。反应历程同上。
4.4 结果分析
在本实验条件下,1.0mol/L、 0.5mol/L、 0.1mol/L盐酸滴入饱和碳酸钠溶液产生的现象分别为:始终有气泡产生;先无气泡产生,一段时间后产生气泡;全程很难观察到气泡。因此虽均为“稀盐酸”,但浓度不同与饱和碳酸钠溶液反应的现象也不同。其实本实验现象与“稀盐酸与碳酸钠反应最初不产生气泡,后来产生气泡”并不相悖,碳酸钠溶液的浓度对实验结果也有一定影响,不同的浓度比会产生不同的现象,但本质上盐酸与碳酸钠的反应是分步进行的,因而导致与碳酸钙反应现象的不同。
参考文献:
[1]王祖浩,王磊主编. 义务教育课程标准实验教科书·化学(九年级上册)[M]. 上海: 上海教育出版社,2012: 43.
[2]王祖浩主编. 普通高中课程标准实验教科书·化学1[M]. 南京: 江苏凤凰传媒出版社,2014: 51.
[3]肖中荣,周萍. 再谈碳酸钠和盐酸反应的实验改进[J]. 化学教学,2019,(10): 54~57.
[4]郭雨琦,孟庆华,刘翠,邢蓓蓓.盐酸与碳酸钠分步反应探究实验装置的改进[J]. 化学教学,2022,(11): 70~74.
[5]韩慧磊,信欣,孙影. 运用数字化技术探究盐酸滴定碳酸钠溶液的反应[J]. 化学教学,2020,(3): 56~60.
[6]张磊,王璇,孙美华. 基于传感器检测探究盐酸与碳酸钠溶液的反应[J]. 化学教学,2021,(6): 74~77.
[7][8]林建芬,盛晓婧,钱扬义. 化学“四重表征”教学模式的理论建构与实践研究———从15年手持技术数字化实验研究的回顾谈起[J]. 化学教育,2015,(7): 1~6.
