氧化锌纳米颗粒在体内和体外对角膜的毒性评估
2023-07-11侯晓璐崔冬梅牛灵芝孙晓彤赵宇航宋爱萍
侯晓璐,崔冬梅, 牛灵芝,孙晓彤,于 涛, 赵宇航,宋爱萍,李 玮
0 引言
氧化锌纳米颗粒(zinc oxide nanoparticles, ZnO NPs)属金属氧化物产品,是一种多功能性的新型无机材料,颗粒大小约1~100nm。由于晶粒的细微化,氧化锌纳米颗粒表面电子结构和晶体结构发生变化,因此,具有普通氧化锌无法比较的特殊性质,在眼科领域得到广泛的应用。作为新兴的药物载体,氧化锌纳米颗粒有使药物作用时间延长、到达眼后部等优点,改变了传统的眼部用药方式[1]。黄啸等[2]将氧化锌纳米颗粒表面修饰成药物载体,把具有抗氧化作用的锌和褪黑素运送到视网膜,实现对视网膜色素上皮层的联合抗氧化作用。Agban等[3]将氧化锌纳米颗粒作为药物载体,将毛果芸香碱在眼内持续作用时间延长至14d,提高了青光眼患者的依从性和临床治疗效果。
随着纳米材料在眼科疾病诊治等领域的广泛应用,纳米材料的眼健康问题成为近年来的研究热点[4]。氧化锌纳米颗粒对紫外线UV-A和UV-B均具有良好的防护效果[5],因而被广泛应用于防晒霜和化妆品中。防晒霜和化妆品常应用于靠近眼睛的地方,从而增加了氧化锌纳米颗粒眼部暴露的可能性。氧化锌纳米颗粒可以有效地减少和抑制革兰氏阳性和革兰氏阴性微生物的生长,因此,氧化锌纳米颗粒已用于隐形眼镜的护理液中[6]。角膜直接与外界环境接触,最容易受到破坏,并发炎症引起眼部损伤[7]。眼睛尤其是角膜,与皮肤和气道一样暴露于空气中。由于角膜的免疫赦免状态和对透明度的特殊要求,角膜对暴露可能做出不同于其他组织和器官的独特方式反应。目前大多数文献的内容都集中在纳米材料眼科治疗应用方面的研究,有关角膜毒性及机制的研究较少。因此纳米材料与眼睛的生物相容性和对人类的健康影响亟待系统的科学研究进行评估。本研究选择与眼科密切相关的新型纳米材料——氧化锌纳米颗粒,通过构建体内和体外染毒模型,观察氧化锌纳米颗粒对角膜的毒性影响。
1 材料和方法
1.1 材料
1.1.1 实验材料氧化锌纳米颗粒分散液及粉体(50~100nm)购于杭州万景新材料有限公司。原代人角膜上皮细胞(human corneal epithelial cells,HCEpiC)购于上海弘顺生物科技有限公司。DMEM高糖培养液(Gibco,C11995500BT),胎牛血清(Gibco,10270106),胰酶消化液(兰杰柯科技有限公司,BL512A),青霉素-链霉素溶液(兰杰柯科技有限公司,BL505A),磷酸盐缓冲溶液(PBS)(Servicebio,G4202-500ML),MTT细胞增殖及细胞毒性检测试剂盒(Gibco,C0009S)、5%水合氯醛溶液(麦克林,C804539),荧光素钠(麦克林,F809553)、苏木精染液(Servicebio,G1004-100ML),伊红染液(Servicebio,G1001-100ML),TNF-α一抗(Servicebio,GB11188),IL-6一抗(Servicebio,GB11117),HRP标记山羊抗兔二抗(Servicebio,GB23303)。超声波细胞破碎仪(宁波新芝,JY88-IIN)、超声波清洗器(昆山,KQ-500VDE)。石蜡切片机(德国徕卡,RM2235)、显微镜(OLYMPUS,BX51T)。
试验采用的输电塔原型为100kV双回路角钢塔,塔高89.6m,呼高66m,基底宽度为17.315m,塔身顶部宽度为2.5m,在塔顶段23.6m范围内设置有三层横担,如图3所示。输电塔气弹模型缩尺比为1∶50,模型材料为铝材。为了尽量减小输电塔模型各杆件节点处胶接导致的阻尼问题,采用线切割方式沿高度方向分段整体雕刻输电塔的主杆及斜直杆,而后沿各杆件轴线弯折为∟型模拟角钢横断面,最后采用高强粘结剂连接模型各段,输电塔模型的横担和塔腿也采用类似的制作方式。
1.1.2 实验动物昆明系(KM)雌性小鼠36只,4周龄,22~24g,购于北京维通利华实验动物技术有限公司,饲养于山东第一医科大学第一附属医院医学研究中心。将小鼠分笼饲养(5只/笼),温度23℃±1℃、相对湿度恒定50%±10%、12h光照/12h暗循环交替照明,自由摄食和水,实验在小鼠适应新环境7d后进行。本研究的实验动物的使用严格遵循《实验动物管理条例》的规定。本研究通过山东第一医科大学第一附属医院动物伦理委员会批准{No.SYDWLS【2022】004号}。
1.2 方法
1.2.1 体外染毒实验方法
1.2.1.1 氧化锌纳米颗粒表征及配制使用X射线衍射仪(X-ray diffractometer,XRD)检测氧化锌纳米颗粒的物理学特性,使用纳米粒度仪检测纳米溶液分散指数。用细胞培养液将氧化锌纳米颗粒分散液配制成实验所需浓度,每次细胞实验操作前,纳米分散液现配现用,使用前在超声波清洗器水浴池里超声震荡10min,超声分散结束,氧化锌纳米颗粒分散液用紫外线照射法灭菌。
1.2.1.2 细胞培养和形态及活性检测原代人角膜上皮细胞在含有10%的胎牛血清、1%青霉素-链霉素、89%高糖DMEM 培养液,37℃,5%CO2,湿度100%的恒温培养箱中培养,取对数生长期的原代人角膜上皮细胞稀释为7×104/mL,每孔100μL接种于96孔板,将培养板置于37℃,5% CO2培养箱中培养24h后,分为空白对照组(除换液外不做任何处理)、氧化锌纳米颗粒实验组(在正常换液时加入经超声分散后0.5、5、12.5、25、50、100、250μg/mL分散液),各组均设置6个复孔,于同样条件培养箱中培养24h后于倒置显微镜下观察细胞形态变化,拍照记录。每孔加入10μL MTT溶液(5mg/mL, 0.5%MTT)继续培养4h,每孔加入100mL DMSO,低速匀速摇晃20min,待结晶完全溶解,使用酶联免疫检测仪检测490nm处的OD值,实验重复3次以上。细胞存活率=氧化锌纳米颗粒实验组OD值/空白对照组细胞OD值×100%。
1.2.2 体内染毒实验方法
1.2.2.1 小鼠眼球染毒模型建立存在于化妆品中的氧化锌纳米颗粒暴露于皮肤的浓度为60~120μg/mL,故在此范围内设定氧化锌纳米颗粒溶液浓度。每次实验将12只小鼠分为4组:对照组(PBS溶液点眼),25、50和100μg/mL氧化锌纳米颗粒实验组,每组3只小鼠。实验重复3次,共计36只小鼠。每次动物实验操作前,纳米分散液现配现用,使用前在超声波清洗器水浴池里超声震荡10min,利用与细胞等渗、具有盐平衡作用的PBS溶液,制备浓度为25、50和100μg/mL的氧化锌纳米颗粒悬液,配制好的氧化锌纳米颗粒悬液再置于涡旋混合器混匀3min,然后取10μL直接暴露于麻醉后的小鼠右眼眼表(结膜囊内),每天3次,暴露7d。
1.2.2.3 角膜组织学观察暴露7d后进行角膜取材。5%水合氯醛溶液对小鼠腹腔注射进行麻醉,麻醉剂量:0.1mL/10mg。处死小鼠后小心取出眼球,置于40g/L多聚甲醛中于4℃固定24h,石蜡包埋,组织切片,厚度为4μm。将切好的石蜡切片于二甲苯中进行脱蜡,HE染色,中性树胶封片,镜检及拍照。利用Image J软件对各组小鼠角膜上皮层厚度、基质层厚度、每高倍镜下基质层免疫细胞数进行测量(相同角膜位置、同等放大倍率下拍照,计算免疫细胞数目)。
1.2.2.4 免疫组织化学染色观察TNF-α和IL-6的表达暴露7d后取眼球石蜡切片,进行免疫组织化学染色。脱蜡、梯度脱水,充分水洗。滴入3%过氧化氢溶液,室温孵育25min,PBS清洗3min;用5%BSA覆盖眼球组织,室温封闭1h。轻轻甩掉封闭液,滴加TNF-α和IL-6一抗(TNF-α抗体稀释比1∶200,IL-6抗体稀释比1∶800),湿盒内4°过夜孵育。PBS洗涤3次每次5min,加HRP标记山羊抗兔二抗2滴,常温孵育60min。采用DAB显色,梯度酒精脱水,二甲苯使切片透明化5min;中性树胶封片。用Image J软件计算各组角膜基质中表达TNF-α阳性的免疫细胞数量、IL-6阳性的免疫细胞数量、TNF-α相应区域的平均光密度值(IOD值)以及IL-6相应区域的IOD值后进行统计分析。

2 结果
2.1 纳米溶液颗粒表征氧化锌纳米颗粒的XRD图显示氧化锌纳米颗粒2θ值中出现7个明显的波峰,分别是31.7°、34.4°、36.2°、47.5°、56.6°、62.8°、68.0°,证实氧化锌纳米颗粒晶体的特质。纳米溶液分散指数PDI∶0.467,见图1。

图1 氧化锌纳米颗粒的XRD图。
2.2 氧化锌纳米颗粒对细胞形态的影响正常培养的人角膜上皮细胞形态呈不规则梭形,伪足纤长,随着细胞的生长,伪足部分相互连接呈膜状,同时细胞逐渐伸展,显现成不规则的多边形并聚集成蜂巢样,细胞边界清晰、胞浆丰富。随着细胞密度的增加,伪足逐渐收缩,细胞间膜性连接不明显,细胞排列越来越紧密,细胞呈不规则的多边形,排列整齐,最后融合成清晰的磨玻璃样外观铺满培养瓶瓶底,见图2A。氧化锌纳米颗粒组细胞失去正常多边形形态,细胞膜破裂,细胞呈现圆形,随着处理浓度的升高,氧化锌纳米颗粒穿透细胞膜进入细胞内在细胞内沉积,致细胞死亡,见图2B。
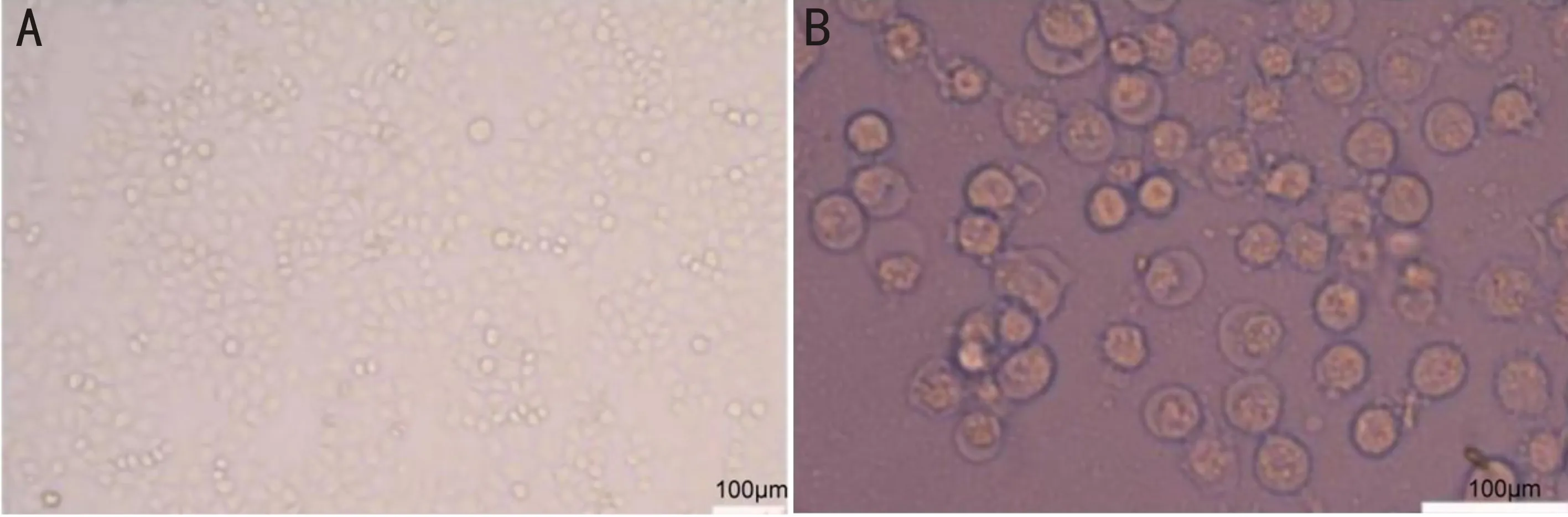
图2 氧化锌纳米颗粒对人角膜上皮细胞形态的影响 A:正常角膜上皮细胞;B:人角膜上皮细胞暴露于0.5μg/mL氧化锌纳米颗粒24h的形态结构。
2.3 MTT法检测角膜上皮细胞活性Welch检验结果表明各组人角膜上皮细胞活性比较差异有统计学意义(F=448.3,P<0.0001)。两两比较结果表明,各组细胞活性与空白对照组相比,差异均有统计学意义(P<0.05)。0.5μg/mL氧化锌纳米颗粒组细胞存活率约为80%,5μg/mL氧化锌纳米颗粒组细胞存活率下降至约50%,细胞活力降低具有浓度依赖性,见图3。
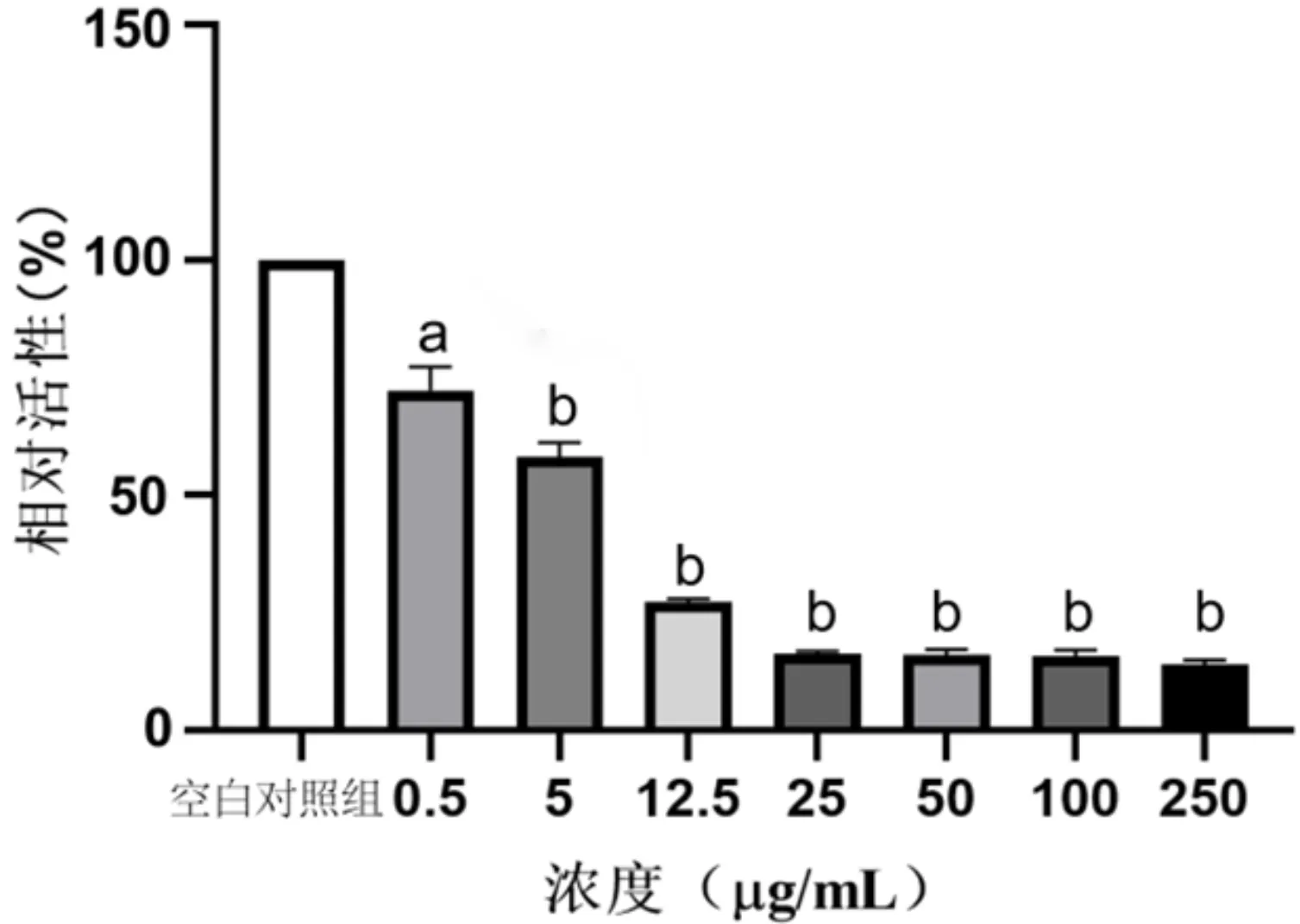
图3 MTT法检测不同浓度氧化锌纳米颗粒对人角膜上皮细胞活性的作用 aP<0.05, bP<0.01 vs空白对照组。
2.4 角膜荧光染色情况25μg/mL和50μg/mL氧化锌纳米颗粒组可见点状荧光素着染,100μg/mL氧化锌纳米颗粒组角膜中央的圆形混浊区见片状着染,见图4。

图4 角膜荧光素钠染色情况 A:PBS对照组;B:25μg/mL 氧化锌纳米颗粒组;C:50μg/mL氧化锌纳米颗粒组;D:100μg/mL氧化锌纳米颗粒组,箭头示角膜中央混浊伴荧光素染色。
2.5 角膜组织HE染色情况与PBS对照组相比,100μg/mL氧化锌纳米颗粒组角膜出现明显的病理特征,表现为角膜上皮层明显变薄,上皮细胞层数明显减少、上皮细胞数目明显减少,基底部上皮细胞排列紊乱、分布不规则,细胞间出现海绵状水肿;角膜基质疏松、水肿,基质层成纤维细胞肥大、增生,纤维母细胞增殖;炎症细胞(嗜酸性粒细胞、中性粒细胞、单核/巨噬细胞、淋巴细胞)分布在角膜基质层、角膜内皮层及角膜缘,多聚集在角膜缘附近和角膜中央病变区的角膜基质层和内皮层。25μg/mL、50μg/mL氧化锌纳米颗粒组可见基质水肿、成纤维细胞肥大,未见其他明显病理改变,见图5。
利用Image J软件对各组小鼠的角膜上皮层厚度、角膜基质层厚度、每高倍镜下基质层免疫细胞数目进行测量(由于角膜前弹力层、后弹力层及角膜内皮层太薄,故在此未统计其厚度)。各组角膜上皮层厚度比较差异有统计学意义(H=10.9,P<0.05)。100μg/mL氧化锌纳米颗粒组角膜上皮层厚度与PBS对照组相比明显变薄,差异有统计学意义(P<0.05)。各组角膜基质层厚度比较差异有统计学意义(H=12.8,P<0.01),100μg/mL氧化锌纳米颗粒组角膜基质层与PBS对照组相比明显增厚,差异有统计学意义(P<0.01)。各组角膜基质层免疫细胞数目比较差异有统计学意义(H=10.7,P<0.05),100μg/mL氧化锌纳米颗粒组基质层免疫细胞数显著增多,与PBS对照组相比差异有统计学意义(P<0.05),见图6。
2.6 各组免疫组织化学染色情况阳性细胞主要在细胞膜和胞浆内着色,呈棕褐色颗粒。各氧化锌纳米颗粒处理组产生TNF-α、IL-6的角膜基质免疫细胞数及角膜基质TNF-α、IL-6的IOD值比较差异均有统计学意义(均为H=8.2,P<0.05)。100μg/mL氧化锌纳米颗粒组产生TNF-α、IL-6的角膜基质免疫细胞数及角膜基质TNF-α、IL-6的IOD值均明显高于PBS对照组,差异均有统计学意义(P<0.05),25μg/mL和50μg/mL氧化锌纳米颗粒组免疫细胞数和IOD值与PBS对照组相比均无明显增高,差异无统计学意义(P>0.05),见图7、8。
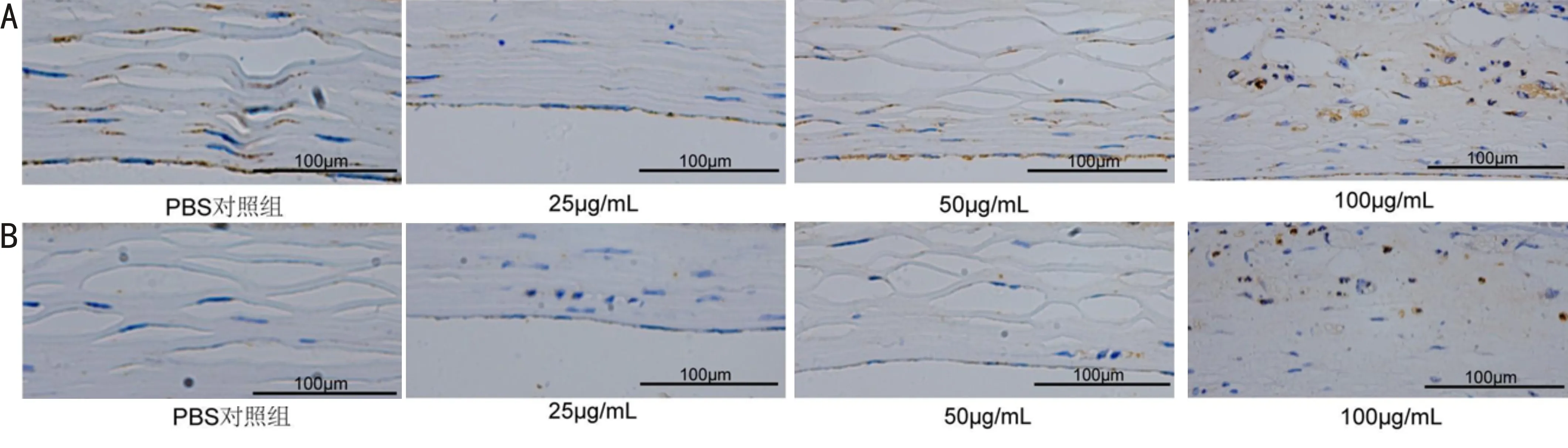
图7 各组角膜免疫组织化学染色情况 A:角膜基质内表达TNF-α免疫组织化学染色图;B:角膜基质内表达IL-6免疫组织化学染色图。
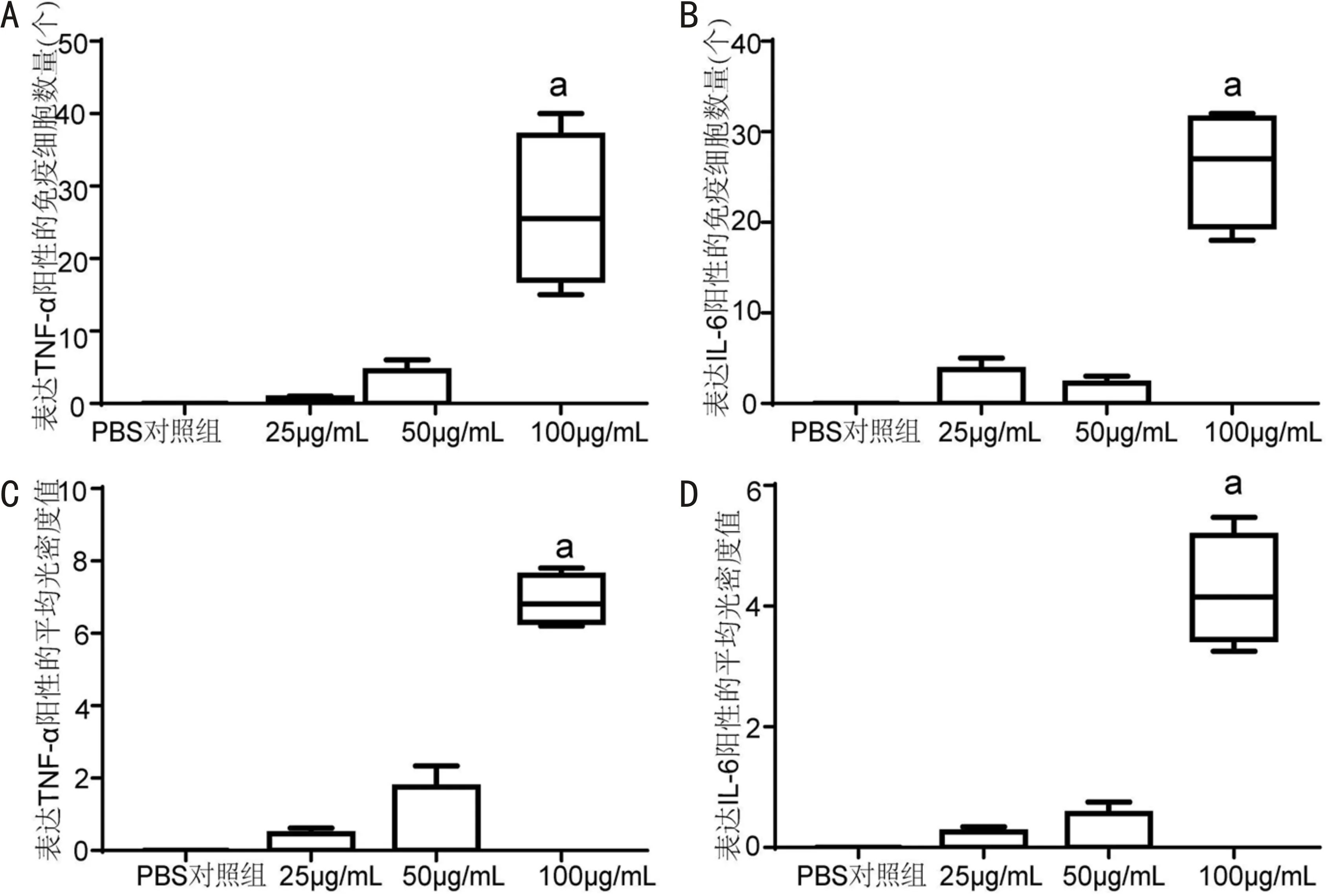
图8 角膜基质内表达TNF-α和IL-6阳性的免疫细胞数量和平均光密度值 A:表达TNF-α阳性的免疫细胞数量;B:表达IL-6阳性的免疫细胞数量;C:表达TNF-α阳性的平均光密度值;D:表达IL-6阳性的平均光密度值;aP<0.05 vs PBS对照组。
3 讨论
角膜是兼具屈光功能和屏障功能的透明组织。眼表的解剖、生理及物理屏障使药物不易进入眼内,生物利用度往往低于5%[8]。纳米材料体积小,表面积大,能够跨越生物屏障[9-10]。纳米制剂被广泛应用于眼科药物运送载体[11]。纳米颗粒也广泛应用于化妆品领域,并存在于空气污染物[12-13]中,这些都增加了眼部尤其是角膜暴露的风险。目前,纳米材料对眼睛组织结构的影响仍然知之甚少。因此,本研究选择与眼科密切相关的氧化锌纳米颗粒,从体外和体内两方面评估纳米颗粒的角膜安全性。
目前,有关氧化锌纳米颗粒眼部安全性的体外实验局限于视网膜和晶状体。Guo等[14]采用大鼠视网膜神经节细胞(retinal ganglion cells,RGC)与不同浓度的氧化锌纳米颗粒溶液作用。实验表明5μg/mL氧化锌纳米颗粒作用24h显著降低RGC-5细胞活力,2.5μg/mL氧化锌纳米颗粒作用48h显著降低RGC-5细胞活力,呈现浓度和时间依赖性特征。小鼠光感受器细胞(661W细胞系)暴露于不同浓度氧化锌纳米颗粒,结果发现31.25μmol/L作用24h降低细胞活力[15]。Wang等[16]采用人晶状体上皮细胞,与不同浓度氧化锌纳米颗粒溶液相作用,实验显示5μg/mL氧化锌纳米颗粒作用24h显著降低细胞活力。角膜上皮是抵御病原微生物侵袭角膜的第一道屏障[17],角膜上皮的正常结构和功能对维持角膜的透明性和发挥屏障功能至关重要。因此,本研究选择体外培养人角膜上皮细胞作为研究对象,观察体外状态下氧化锌纳米颗粒的安全性。通过本研究中发现体外培养人角膜上皮细胞暴露于0.5μg/mL的氧化锌纳米颗粒24h,与空白对照组相比,细胞活力明显下降。本研究证实了短期暴露于较低浓度氧化锌纳米颗粒,可对人角膜上皮细胞产生毒性作用,并具有浓度依赖性的特征。通过体外实验,证明了氧化锌纳米颗粒对角膜上皮细胞的高度毒性作用,并为体内实验提供依据。
体内实验浓度选择是基于体外最小损伤浓度的100倍,原因是泪膜作为眼表的第一个功能屏障,当外源性物质进入眼内,会在30s内通过反射性流泪、眨眼和泪道引流的方式被稀释[18]。商用防晒霜产品含有高达25%w/w(通常为10%~20%w/w)的氧化锌纳米颗粒。单次应用于人体皮肤后相当于暴露于60~120μg/mL的氧化锌纳米颗粒[19]。因此,本研究中体内实验的浓度与氧化锌纳米颗粒在眼表的潜在生理暴露量一致。100μg/mL氧化锌纳米颗粒点眼5d,角膜见点片状荧光素着染;25μg/mL和50μg/mL氧化锌纳米颗粒点眼7d,角膜可见荧光素的点状着染。研究结果说明氧化锌纳米颗粒会造成角膜屏障功能破坏,引起小鼠角膜上皮损伤,呈时间依赖性和浓度依赖性。HE染色结果显示,与PBS对照组相比,25μg/mL和50μg/mL氧化锌纳米颗粒组的角膜上皮层厚度、基质层厚度、基质层免疫细胞数目无明显改变(P>0.05),而100μg/mL氧化锌纳米颗粒组角膜上皮层变薄、角膜基质层变厚、基质层免疫细胞明显增多(均P<0.05),100μg/mL氧化锌纳米颗粒组角膜基质层显著增厚、水肿,基质纤维增生,并出现大量免疫细胞。Kim等[20]将不同浓度的氧化锌纳米颗粒暴露于兔眼的结膜囊,结果发现泪膜无明显改变,但未对角膜进行综合评估。氧化锌纳米颗粒可通过角膜上皮细胞的跨细胞转运途径进入角膜深层[21]。与角膜上皮相比,角膜基质对纳米颗粒的屏障作用更为强大。角膜基质由紧密堆叠的网状结构组成,类似于分子筛的功能,筛孔的直径只有20~40nm[22],本研究中氧化锌纳米颗粒直径50~100nm,超过了角膜基质多重网状结构的筛孔直径,可能是毒性影响局限在角膜的主要原因。
已有研究表明,氧化锌纳米颗粒可在身体其他系统中诱发炎症[23]。诱导炎症反应是纳米颗粒在化妆品和防晒霜中的潜在毒性问题[20]。本次实验表明,100μg/mL氧化锌纳米颗粒组角膜基质层含有TNF-α、IL-6的免疫细胞显著增多且TNF-α和IL-6的IOD明显高于对照组(均P<0.05),25μg/mL和50μg/mL的氧化锌纳米颗粒的TNF-α、IL-6表达未见明显增高(均P>0.05),证明一定浓度的氧化锌纳米颗粒会引起小鼠眼球发生炎症反应且具有炎症反应程度具有浓度依赖性。Senapati等[24]认为JNK、ERK1/2和p38为构成MAPK级联反应,在氧化锌NPs的炎症反应中起关键作用。他们的实验表明,氧化锌纳米颗粒通过内吞作用或吞噬作用进入人单核细胞,诱导该细胞产生氧化应激,激活NF-κB信号通路,增加IL-1β和TNF-α等炎症细胞因子产生,这些炎症细胞因子进一步激活JNK、ERK1/2和p38在内的MAPK信号通路,诱导炎症基因的转录增强,引发促炎反应和基因毒性。
本研究仍存在局限性。纳米颗粒的性质、大小、表面修饰等因素都有可能影响眼毒性作用,未来将进一步细化纳米颗粒。纳米颗粒对细胞损伤相关的机制如炎症反应、氧化应激、细胞凋亡、DNA损伤、细胞自噬、离子通道改变和物理损伤等,这些机制是否参与了氧化锌纳米颗粒的眼毒性,下一步将继续研究。
综上所述,通过体外和体内的研究,证实了氧化锌纳米颗粒对角膜具有毒性损伤作用。该研究丰富了氧化锌纳米颗粒眼毒性的数据,提醒在纳米材料广泛应用的同时应警惕毒性作用,为氧化锌纳米颗粒眼部安全性评价提供了一定的理论依据。
