普瑞巴林联合神经阻滞在神经病理性疼痛患者中的应用效果观察
2023-07-11郭玉龙
郭玉龙
(河南省灵宝市第一人民医院疼痛科 灵宝 472500)
神经病理性疼痛属慢性疼痛,由躯体损伤或疾病引起,也可继发于外周性疾病或损伤[1]。神经病理性疼痛可分为外周性和中枢性两种,该病的诊断主要依靠病史采集、查体及电生理检查。神经病理性疼痛的原因包括代谢性、营养性、病毒、神经毒性、神经递质功能障碍等,主要临床表现为自发性疼痛、痛觉过敏、感觉异常等,疼痛程度较为剧烈,加之该病难以治愈、病程长、易反复发作,患者极易出现失眠、抑郁、焦虑等负面情绪,降低其生活质量[2~3]。现阶段,神经病理性疼痛的治疗常采用抗抑郁、抗癫痫及阿片类镇痛药,普瑞巴林作为近年在美国和欧洲大量应用于治疗中枢、外周神经病理性疼痛的一线药物,属新型γ-氨基丁酸(GABA)受体阻滞剂,可减少去甲肾上腺素、P 物质、谷氨酸盐等兴奋性递质的释放,抑制神经元异常,缓解疼痛症状[4]。神经阻滞是一种在神经元干上使用相应药物,暂时阻断、干扰神经放电和传导的治疗方法,可阻断神经疼痛的传导,达到止痛目的[5]。本研究分析普瑞巴林联合神经阻滞治疗神经病理性疼痛的应用效果。现报道如下:
1 资料与方法
1.1 一般资料 按随机数字表法将2020 年7 月至2022 年7 月医院收治的80 例神经病理性疼痛患者分为对照组和研究组,各40 例。对照组年龄31~65岁,平均(46.84±9.61)岁;男16 例,女24 例;病程3~9 个月,平均(5.32±1.94)个月;周围神经病理性疼痛21 例,中枢神经病例性疼痛19 例。研究组年龄32~68 岁,平均(47.21±8.59)岁;男18 例,女22 例;病程2~9 个月,平均(5.36±1.98)个月;周围神经病理性疼痛23 例,中枢神经病理性疼痛17 例。两组一般资料对比,差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会审核批准。
1.2 入组标准 纳入标准:符合《神经病理性疼痛诊疗专家共识》[6]中相关诊断标准;患者依从性较好,且签署知情同意书;临床病历齐全。排除标准:合并恶性肿瘤;伴有其他神经性疾病、心血管疾病;合并严重肝肾功能异常、凝血功能异常、感染性疾病、内科基础疾病;无法配合完成本研究;对本研究药物存在特异质反应。
1.3 治疗方法 两组患者均常规予以神经营养药物治疗。口服维生素B1 片(国药准字H14021291),10 mg/次,3 次/d;甲钴胺片(国药准字H20052325)口服,0.5 mg/次,3 次/d。对照组在常规治疗基础上口服普瑞巴林胶囊(国药准字H20223712)治疗,75 mg/次,2 次/d。研究在对照组基础上联合神经根阻滞治疗,据患者疼部位在B 超扫描下确定受累神经根具体位置并实施穿刺,之后在神经根周围注射10 mg 醋酸曲安奈德注射液(国药准字H20033524)+10 ml 盐酸利多卡因注射液(国药准字H43021930),1次/周。两组均持续治疗4 周。
1.4 观察指标 (1)临床疗效。治疗后疼痛视觉模拟评分(VAS)下降>3 分,睡眠正常为显效;治疗后VAS 评分下降1~3 分,睡眠基本正常为有效;治疗后VAS 评分下降<1 分,睡眠情况与治疗前相同为无效。总有效=显效+有效。(2)疼痛程度。治疗前后采用VAS 进行评估,0 分为无疼痛,10 分为极度疼痛,分数越高疼痛程度越严重。(3)睡眠质量。治疗前后采用匹兹堡睡眠质量指数量表(PSQI)评估睡眠质量,包含入睡时间、睡眠时间、睡眠障碍等7 个部分,每个部分按0~3 分4 级计分,总分为21 分,分数与睡眠质量成反比。(4)焦虑情绪。治疗前后采用汉密尔顿焦虑量表(HAMA)评估焦虑情绪,包含紧张、害怕、认识功能等14 个项目,所有项目采用0~4分5 级评分法,评分>7 分认为病人存在焦虑症状,分数与焦虑程度成正比。(5)抑郁情绪.治疗前后采用汉密尔顿抑郁量表(HAMD)评估抑郁情绪,该量表包含17 项,共68 分,分数与抑郁程度成正比。(6)致炎因子。治疗前后采集患者空腹静脉血3 ml,肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-18(IL-18)、核转录因子-κB(NF-κB)采用酶联免疫吸附法检测。(7)不良反应。记录患者出现呕吐、头晕、嗜睡等不良反应情况。
1.5 统计学分析 采用SPSS22.0 统计学软件处理数据。计量资料以(±s)表示,采用t检验;计数资料用%表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效对比 研究组总有效率高于对照组(P<0.05)。见表1。
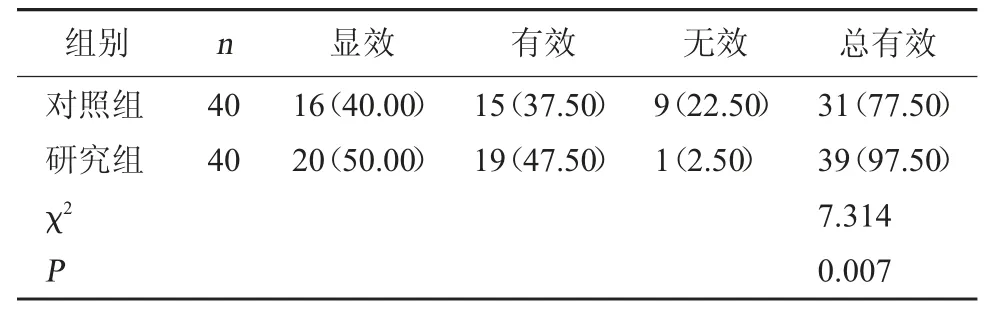
表1 两组临床疗效对比[例(%)]
2.2 两组VAS 评分、PSQI 评分对比 治疗后研究组VAS 评分、PSQI 评分低于对照组(P<0.05)。见表2。
表2 两组VAS 评分、PSQI 评分对比(分,±s)
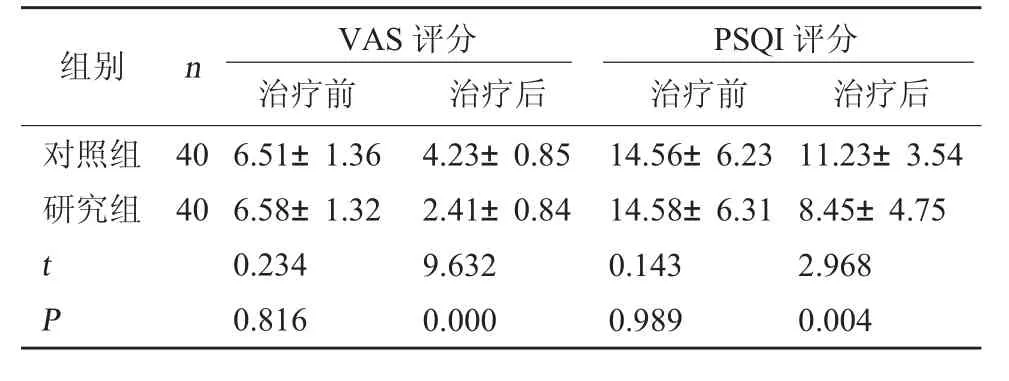
表2 两组VAS 评分、PSQI 评分对比(分,±s)
?
2.3 两组HAMA、HAMD 评分对比 治疗后研究组HAMA 评分、HAMD 评分低于对照组(P<0.05)。见表3。
表3 两组HAMA、HAMD 评分对比(分,±s)
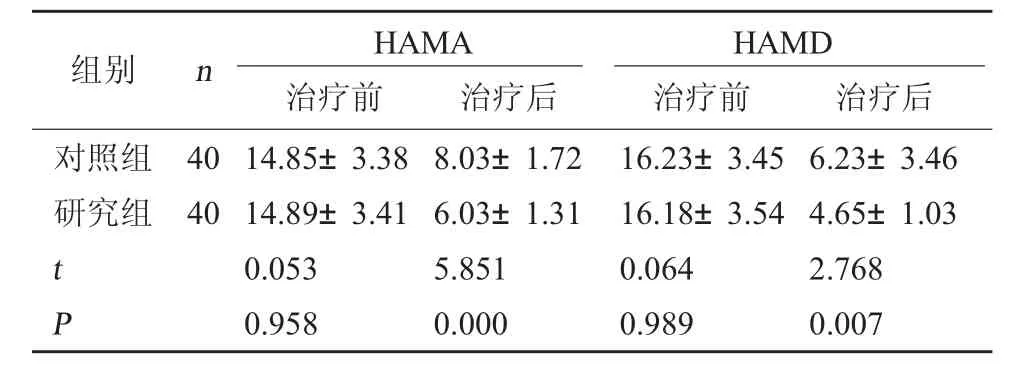
表3 两组HAMA、HAMD 评分对比(分,±s)
?
2.4 两组致炎因子水平对比 治疗后研究组TNF-α、IL-6、IL-18、NF-κB 水平低于对照组(P<0.05)。见表4。
表4 两组致炎因子水平对比(±s)
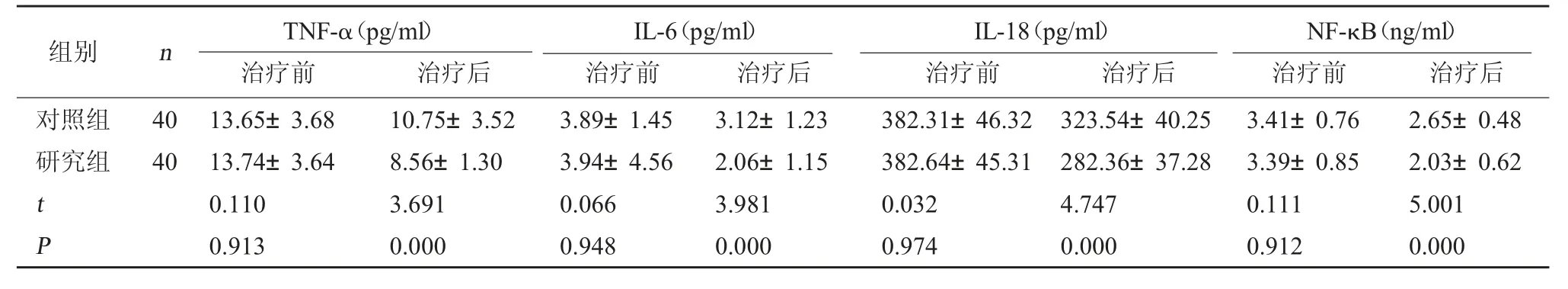
表4 两组致炎因子水平对比(±s)
?
2.5 两组不良反应发生率对比 两组不良反应总发生率对比,差异无统计学意义(P>0.05)。见表5。
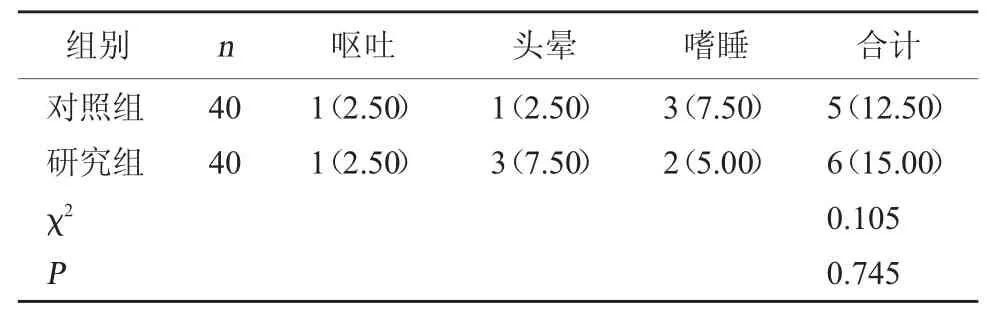
表5 两组不良反应发生率对比[例(%)]
3 讨论
神经病理性疼痛是神经科常见症状之一,发病率约为1%,由于病因多种多样、发病机制复杂,属难治性疾病,可分为原发性和继发性两类[7]。神经病理性疼痛发病机制与中枢神经损伤或疾病诱发的中枢敏化、神经兴奋性增高导致的神经递质过度释放有关,常见病因包括神经损伤、感染、代谢紊乱、梗死等,患者主要表现为钝痛、灼痛、搏动性疼痛,该病显著特点为损伤治愈后疼痛仍然存在,可持续数周、数月,甚至数年,易造成患者出现一定的焦虑及抑郁情绪,负面心理状态可加剧患者疼痛感,造成恶性循环[8~9]。相关研究表明,焦虑及抑郁程度与主观疼痛程度成正相关,严重影响患者身心健康[10]。目前,临床并无明确治疗神经病理性疼痛的方法,其治疗是一个持续的过程,病情可能出现反复,需要长期治疗,一般多采用阿片类药物、抗抑郁药物等,但上述药物不良反应较多,且阿片类药物成瘾性较大[11]。
神经病理性疼痛外周机制包括细胞膜兴奋性增高和周围神经的高致敏性。相关研究表明,突触前神经末梢有大量的离子通道,包括钙离子通道、钠离子通道、钾离子通道等,其中钙离子通道在神经递质释放的过程中尤为重要,参与神经递质释放的每个步骤[12]。欧洲神经学会联盟、国际疼痛协会(IASP)等均推荐普瑞巴林为治疗神经病理性疼痛的一线药物,在英国卓越临床研究院指南中,普瑞巴林是唯一被推荐用于治疗中枢神经和外周性神经性病理性疼痛的药物。普瑞巴林是一种新型钙离子通道调节剂,具有亲脂性,能够通过血脑屏障,抑制神经系统电压依赖性钙离子通道的亚基α2-δ 蛋白,减少谷氨酸、去甲肾上腺素和P 物质释放,抑制交感神经及肾上腺兴奋,同时抑制兴奋信号在中枢的传导,缓解疼痛,一定程度上减轻患者的焦虑、抑郁情绪;此外,普瑞巴林可直接作用于前触前2-δ 亚单位,抑制神经元兴奋性,并不对正常神经功能产生影响,仅抑制疼痛信号产生;另外,该药起效快、生物利用度高,服用1 h 后就可达到血药浓度峰值,生物利用度≥90%,且不与血浆蛋白结合,药物的吸收受食物影响较小,98%的普瑞巴林可经肾脏排出体外,具较高的安全性[13~14]。
有研究表明,神经病理性疼痛的发生和发展与致炎因子的表达关系密切[15]。本研究结果显示,研究组总有效率高于对照组,治疗后VAS 评分、PSQI 评分、HAMA 评分、HAMD 评分和致炎因子水平均低于对照组(P<0.05),且两组不良反应发生率对比,差异无统计学意义(P>0.05)。表明神经病理性疼痛患者应用普瑞巴林联合神经阻滞治疗可缓解患者疼痛症状和负性情绪,提升睡眠质量,用药安全。部分患者原发性疼痛的病因可能已去除,但恶性循环仍残留,导致周围或中枢神经系统的敏感化局部疼痛经感觉神经传入脊髓,通过脊髓的反射,引起交感兴奋,使血管收缩,缺氧,代谢异常,局部的病损不易修复,同时产生致痛物质,使疼痛加重,形成恶性循环。近年来,B 超技术开始应用于神经组织的定位与引导,其可为神经阻滞的穿刺和给药提供实时影像,直视穿刺针的路径,避免了传统盲探法穿刺造成的神经和血管损伤;此外,B 超引导下进行神经阻滞治疗,可直观分辨出神经和周围组织,将药物准确注入病灶部位,起效快,可触及传入感受器产生异位电活动,降低周围或中枢神经系统的敏感化,松弛肌肉,改善血液循环,使局部血流增加,减轻神经水肿,营养神经,有效地阻断疼痛的恶性循环[16]。慢性疼痛会引起患者心理障碍,情绪不稳,烦躁,苦闷,加重患者局部疼痛,神经阻滞治疗可使患者疼痛立即消除或明显减轻,使其心情愉快,从而增加治病的信心和康复速度。但神经阻滞的药物选择必须要考虑不良反应、联合用药的利弊、药物的作用机制与治疗目的,做好充分的病情评估,把握神经阻滞的适应证,熟悉阻滞部位的解剖结构、阻滞用药的作用机制,规范穿刺及操作技术,准确地进行神经阻滞效果评价,了解其可能发生的并发症及预防措施。
综上所述,普瑞巴林联合神经阻滞治疗神经病理性疼痛效果显著,有助于缓解疼痛,改善患者抑郁、焦虑情绪和睡眠质量,且不良反应较少,临床应用安全有效,值得推广应用。
