哺乳动物雷帕霉素靶蛋白与结直肠癌关系的生物信息学分析
2023-07-11韩丽红陈婧茹林丽蓉闫斌
韩丽红,陈婧茹,林丽蓉,闫斌
1.莆田学院基础医学院,福建莆田 351100;2.莆田学院肿瘤转化医学福建省高校重点实验室,福建莆田 351100
结直肠癌的发生与饮食、遗传、肠道炎症、生活方式及生活环境等因素有关,但其发生机制尚未完全清楚[1]。岳芙蓉等[2]、卫星等[3]指出哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路激活后,可操控人类体内癌细胞增长与消失,由于癌细胞病变时,mTOR 信号通路常处于过度激活状态,对癌细胞吸收养分、分裂增长、生存等一系列正常活动造成影响。顾超等[4]指出磷脂酰肌醇-3-激酶(phosphatidylinositol-3-hydroxykinase, PI3K)、丝氨酸∕苏氨酸蛋白激酶(proteinserinethreonine kinase, AKT)与mTOR 蛋白分子在肿瘤病发过程中可通过调节细胞增长、繁殖、存活等方式抑制或增强肿瘤生长速度。这与肿瘤细胞的主要生物学特性,即生长增殖失控相符。本文分析2013年5 月—2021年5 月TCGA 公共数据库的COAD &READ 患者数据698 份,研究mTOR 在结直肠癌发病进程中的影响和发挥的作用,为该病的诊疗工作提供帮助。现报道如下。
1 材料与方法
1.1 TCGA 数据采集
结直肠癌的原始mRNA 表达数据从癌症基因组图谱(the cancer genome atlas, TCGA)数据库(https:∕∕portal.gdc.cancer.gov∕)下载。共收集标本698份,其中正常组51 份,肿瘤组647 份。下载基因型-组织表达(genotype-tissue expression, GTEX)数据库,比较正常组(n=51)、GTEX(n=308)和GSE73360的结直肠癌数据表达差异。
1.2 共表达分析
为研究mTOR 基因的共表达并分析受mTOR 调控的信号通路,本研究分析了TCGA 结直肠癌患者的表达谱。以r=0.4,P=0.05 为条件筛选mTOR 表达最显着的基因后,使用“Corrplot”和“Circlize”软件包绘制mTOR 相关性分析的圆图,并可视化mTOR 相关性的调控机制。
1.3 基因组变异分析
本研究从分子标记数据库(7.0 版)下载了基因组,并使用基因组变异分析(gene set variation analysis, GSVA)算法对每个基因组进行综合评分,以评估不同样本中潜在的生物功能变化。
1.4 基因组富集分析
本研究使用基因组富集(gene set enrichment analysis, GSEA)分析比较高表达组和低表达组之间信号传导途径的差异。筛选出肿瘤患者,按照其中位值(8.040 58)将肿瘤患者分为高表达组和低表达组,高表达组409 份,低表达组289 份,以探索两组之间结果差异的可能分子机制,排列数量设定为1 000,排列类型设定为表型[5-6]。
1.5 统计方法
采用R 语言包4.0.3 软件对数据进行统计分析,计数资料采用例数(n)表示,计量资料经检验符合正态分布,采用(±s)表示。采用秩和检验分析数据集中的正常组织与肿瘤组织样本mTOR 表达量之间的差异。采用ggcorrplot 和ggstatsplot 进行Spearman 相关性分析及可视化。基于Kaplan-Meier法绘制生存曲线,采用Log-Rank 检验进行显著性分析。P<0.05 为差异有统计学意义。
2 结果
2.1 mTOR 在结直肠癌的mRNA 表达及KM-plot生存分析
mTOR 在结直肠癌中的具体机制未明。本研究从TCGA 数据库下载已处理的结直肠癌原始mRNA表达数据共698 份,正常组51 份,肿瘤组647 份。结果表明,mTOR 在正常组织中表达(6.202 742±1.369 486 872),mTOR 在肿瘤组织中表达(5.401 705±2.087 202 686),mTOR 在肿瘤组织和正常组织中表达,差异无统计学意义(P>0.05),见图1A。此外,基于GSE73360 数据集分析mTOR 在组织中的表达差异,结果显示,mTOR 在正常组织中表达(7.008 4±0.429 089 872),mTOR 在肿瘤组织中表达(8.040 58±0.784 400 233),mTOR 在肿瘤组织中表达升高,差异有统计学意义(P<0.05),见图1B。本研究基于mTOR 基因的表达量进行KM-plot 生存分析(纳入患者生存时间需>30 d),通过遍历mTOR 基因的所有截点选取具有最优生存意义的截点值,结果表明,当mTOR 截点值为3.633 6 时,高风险组患者预后显著较低风险组预后较好,见图2。
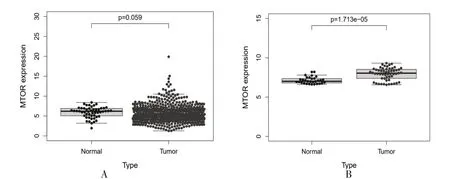
图1 mTOR 在结直肠癌的mRNA 表达
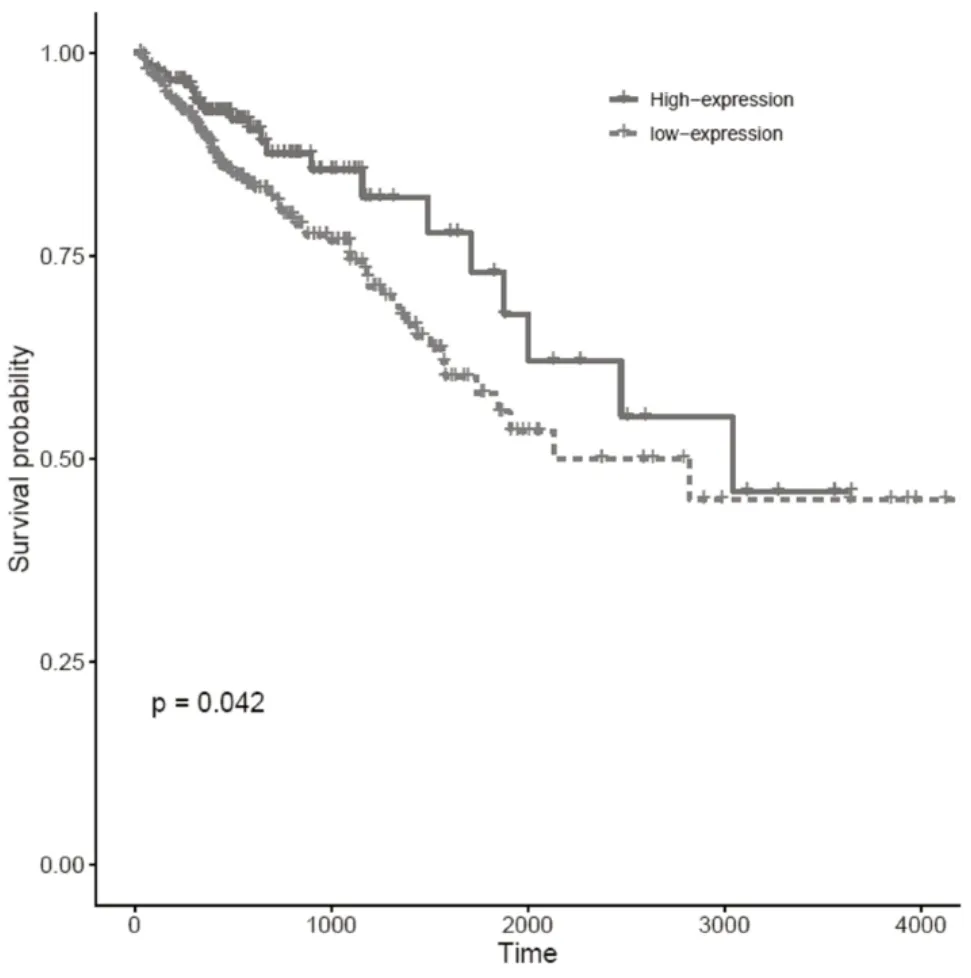
图2 KM-plot 生存分析
2.2 mTOR 的共表达网络
本研究进一步通过相关性分析探讨mTOR 的共表达网络,过滤条件为r=0.4,P<0.05。共筛选出541个与mTOR 表达显著相关的基因,见图3。
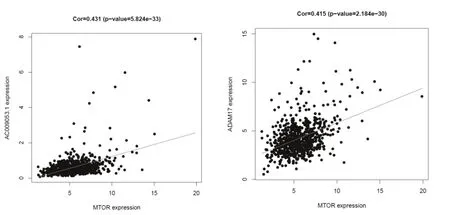
图3 与mTOR 表达显著相关的基因
2.3 mTOR 与信号通路
GSVA 结果表明,高低表达两组患者的差异通路主要富集到了MITOTIC_SPINDLE、G2M_CHECKPOINT 以及OXIDATIVE_PHOSPHORYLATI ON 信号通路,见图4。
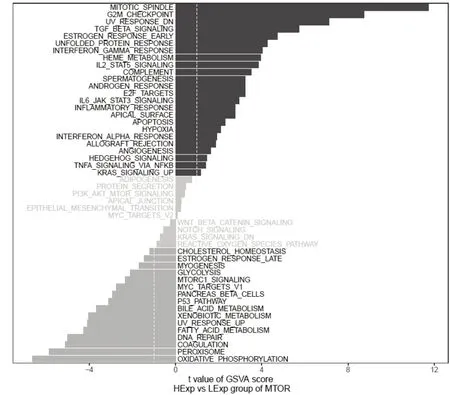
图4 mTOR 基因涉及的信号通路
2.4 mTOR 与微卫星不稳定性、肿瘤突变负荷的关系
本研究发现,高表达mTOR 组微卫星不稳定性(microsatellite instability, MSI)为(0.346 5±0.228 324 831),低表达mTOR 组为(0.340 8±0.200 818 483)。高表达mTOR 组肿瘤突变负荷(tumor mutation burden,TMB)为(3.881 578 948±47.556 343 52),低表达mTOR 组为(3.5789 473 68±23.947 834 78)。核心基因高低表达在MSI 和TMB 方面比较,差异有统计学意义(P<0.05),见图5。
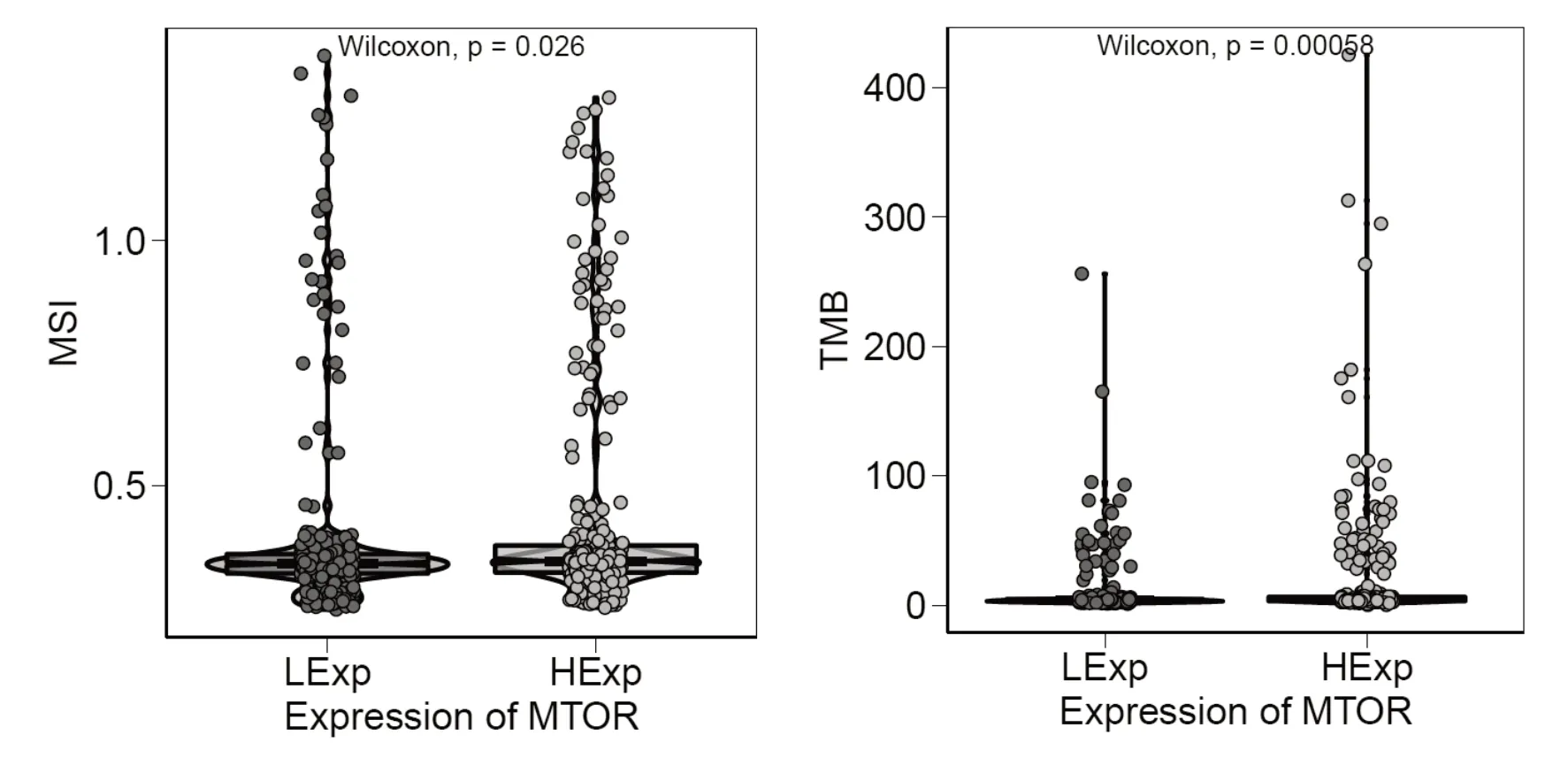
图5 mTOR 基因高低表达间与MSI 和TMB 的关系
3 讨论
mTOR 信号传导通路与恶性肿瘤的关系越来越多地受到人们的关注。未见有相关报道关于mTOR与结直肠癌生物信息学分析研究。TCGA 数据库下载已处理的结直肠癌的原始mRNA 表达数据共698份,mTOR 在正常组织中表达(6.202 742±1.369 486 872),mTOR 在肿瘤组织中表达(5.401 705±2.087 202 686),mTOR 在肿瘤组织和正常组织中表达,差异无统计学意义(P>0.05)。基于GSE73360 数据集分析mTOR 在组织中的表达差异,mTOR 在正常组织中(7.008 4±0.429 089 872),mTOR 在肿瘤组织中表达(8.040 58±0.784 400 233),mTOR 在肿瘤组织中表达升高(P<0.05)。共筛选出541 个与mTOR 表达显著相关的基因。GSVA 结果高低表达两组患者的差异通路主要富集到了MITOTIC_SPINDLE、G2M_CHECKPOINT 以及OXIDATIVE_PHOSPHORYLATION 信号通路。高表达mTOR 组MSI 为(0.346 5±0.228 324 831),低表达mTOR 组为(0.340 8±0.200 818 483)。高表达mTOR 组TMB 为(3.881 578 948±47.556 343 52),低表达mTOR 组为(3.578 947 368±23.947 834 78)。核心基因高低表达在MSI 和TMB 方面比较,差异有统计学意义(P<0.05)。
关于mTOR 与结直肠癌发生发展的研究比较多。Wang XW 等[7]研究显示结直肠癌细胞主要通过细胞内分裂增殖基因进行细胞复制,通过mTOR信号通路对细胞增殖基因过度刺激获得mRNA,而后mRNA 进行大量转录,合成病变细胞分裂所需的蛋白质,进而提高细胞增殖速度。CyclinDI 是一种原癌基因,再加之其分裂行为不受控制,造成病变细胞内激酶活化并与受体结合进行繁殖,从而导致病变细胞激增。mTOR 信息通道合并激活后,与酸化后两个蛋白因子进行反应,达到促进细胞增殖的作用[7-18]。周钊等[8]指出哺乳动物mTOR 是一种可直接吸收营养的激酶,并且受成长基因与外在环境影响,存在于机体内各种细胞的分裂、生长、死亡循环调节,是一种极强的黏结性因子。钟南英等[9]指出肿瘤的并发与mTOR 激活有着密不可分的联系,并且该通道激活与病变细胞分裂、生长、血管生成、转移等相关。同时,PI3K 既有蛋白激酶活性,同时又有磷脂激酶活性,为病变细胞大量增殖形成肿瘤打下了基础。AKT 为mTOR 的上游信号分子,在结直肠癌形成过程中,参与调节VEGF 介导的血管生成过程中的多个阶段。胡树坚[10]在其研究中表示由于mTORC1 主要负责细胞的增殖等活动,使得肿瘤恶化或瘤转移与mTORC1 的异常运作密切相关,由于mTORC1 具有促进新陈代谢功能,并且兼备脂质代谢、抑制细胞吞噬等作用,为病发细胞提供了“立足”基础;而mTORC2 则是通过提高激酶数量进行化学反应,以调控肌动蛋白细胞。
综上所述,本研究仅针对mTOR 在结直肠癌中的生物信息分析,局限于mTOR 信息通路,也可围绕mTOR 信息通路对结直肠癌细胞影响与扩散进行研究。mTOR 信号通路与结直肠癌的发生发展密切相关。了解mTOR 在癌细胞形成过程中的作用,可对我国后续抗癌医疗发展添砖加瓦。
