航天诱变小麦突变体籽粒表型分析和真实性鉴定
2023-07-08张福彦朱保磊陈晓杰王嘉欢程仲杰范家霖张建伟
张福彦,朱保磊,陈晓杰,王嘉欢,程仲杰,范家霖,张建伟
(1.河南省科学院 同位素研究所有限责任公司,河南省核农学重点实验室,河南 郑州 450015;2.信阳市农业科学院,河南 信阳 464000)
小麦是我国最主要的口粮作物,在国家粮食安全战略中具有极其重要的地位。从近年来国家冬小麦区域试验品系的遗传多样性和产量结果看,当前我国小麦育种面临资源狭窄、模式单一等问题,严重制约着小麦产量的提高[1-2]。从粮食生产的发展进程来看,粮食产量的每次重大突破都与一些关键优异种质资源的利用密切相关,其已成为制约我国粮食增产潜力的关键因素[3]。航天诱变是利用特殊空间环境,使植物性状发生改变,之后经过地面人工选育出新品种、新材料以及特色基因资源的育种技术,为解决目前生产上小麦新品种同质化严重、亲本资源遗传基础狭窄等问题提供了有效途径[4-5]。
1987年,我国首次利用返回式卫星将第1批农作物种子带到太空,开始进行航天诱变育种研究,经过几十年的发展,我国航天育种技术研究和应用得到迅速发展,已取得了大量突破性的成果[6-7]。目前,航天诱变研究已逐步深入到突变体基因变异、表达以及转录组、蛋白质组变异特征等基因组学和分子生物学领域[8-9],但受天然异交混杂或人为混杂等因素影响,在一定程度上存在假突变体的可能性,而利用表型分析通常难以鉴定诱变后代突变体的真实性,这严重影响了突变体中功能基因的遗传研究。随着分子生物学技术不断发展,利用分子标记技术可以有效鉴定诱变后代中优异突变体的真实性[10]。
郭奕生等[11]筛选出4对简单重复序列标记(Simple sequence repeats,SSR)核心引物用于不同水稻品种的真实性鉴定,从而为加强水稻品种权的保护及种子质量监测工作提供重要理论依据。张维宏等[12]以甲基磺酸乙酯(Ethyl methane sulphonate,EMS)诱变处理小麦抗叶锈病近等基因系TcLr19的种子,共鉴定出146个M3感病突变体。为保证结果的可靠性,同时利用Lr19的分子标记对突变体进行分子筛选,鉴定出M36-2、M333-8、M333-9、M333-11、M344-4和M396-8等6个遗传稳定率达70%以上的M3感病突变材料,可用于抗病基因功能和机制研究。马超等[13]以EMS诱变小麦-西尔斯山羊草Pm57易位系为材料,利用Pm57基因特异分子标记和小麦全国区试品系进行特异性、一致性和稳定性(Distinctness,uniformity and stability,DUS)测试所用的42对SSR核心引物,鉴定筛选出70个Pm57基因白粉病抗性丧失的真实突变体。王春语等[14]利用扩增目标条带较单一、多态性丰富的30个SSR标记对高粱EMS诱变突变体的真伪进行鉴定,发现筛选的≥3 bp重复的30个SSR分子标记完全可以用于鉴定EMS诱变高粱突变体的真伪。以上说明,采用SSR标记技术对水稻、小麦、高粱等诱变突变体真实性鉴定是完全可行的。但SSR标记受位点数量和方法的限制,无法从全基因组水平上对突变体进行高通量真实性鉴定。单核苷酸多态性(Single nucleotide polymorphism,SNP)是普遍存在于生物基因组中的一种新型分子标记,是在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性,具有在基因组中分布密度高、代表性强、遗传稳定性高、易实现高通量自动化检测和分析等优点[15-16]。耿皆飞等[17]利用90K SNP芯片对小麦品系H261及其EMS突变体进行检测,发现突变体与其亲本的相同SNP位点的一致性高达99.2%以上,且二者之间没有发现纯合差异SNP,认为突变体与亲本H261的遗传背景高度一致,是经过EMS诱变的后代,可以进行后续的功能基因遗传研究。杨丽娟等[18]采用15K SNP芯片数据分析了15份黑、紫色小麦种质资源的遗传差异,共获得7 116个有效SNP位点,SNP多态性比率为77.12%,每条染色体上有128~682个SNP位点,且在A、B、D染色体组中不均匀分布,SNP标记的数量表现为B组>A组>D组,15份小麦种质资源之间的遗传相似度为44.58%~99.94%,可见SNP芯片技术可以准确鉴定出不同小麦材料的遗传相似度。
小麦籽粒发育状况决定着小麦的产量和品质,因此,籽粒遗传发育机制一直是小麦研究的热点之一。优异籽粒突变体是小麦高产育种的重要亲本资源,也是研究小麦籽粒发育机制和相关基因克隆的重要材料。小麦产量性状突变体的鉴定对于解析小麦籽粒发育和产量形成均具有重要意义。Wu等[19]利用诱变技术获得产量性状相关突变体Meh0239,与野生型相比,该突变体从苗期开始表现出明显的表型差异,包括株高降低,叶片变宽变短,穗、小穗和籽粒缩短以及小穗分布更加紧密等,进一步研究发现,由于小麦7DS染色体上的一个隐性突变(Yt1)致使小麦植株体内脱落酸、吲哚-3-乙酸等内源性激素水平的改变,从而导致该突变体产量相关性状表现明显差异。Zhang等[20]从利用EMS诱变小麦品种烟农15产生的突变体库中获得大粒突变体M8008,构建其F2及其衍生的F2:3群体,并对控制籽粒大小相关基因进行精细定位、克隆以及功能分析等,发现大粒亲本M8008在2D染色体上控制粒宽和千粒质量的QTL(QGw和QTgw)具有减少粒宽和降低千粒质量的作用。截至目前,国内外研究人员基于各种需求已构建多个小麦突变群体或突变体库,并对单个突变性状进行评估,但同时利用SSR标记和SNP芯片对航天诱变小麦突变体进行真实性鉴定的研究尚无报道。本研究以河南省科学院同位素研究所前期利用实践十号卫星搭载创制周麦18 SP5籽粒突变群体为材料,对其籽粒表型进行分析,同时利用SSR标记和55K SNP基因芯片技术对籽粒表型差异较为显著突变体材料的真实性进行鉴定,旨在为进一步利用籽粒突变体进行小麦遗传改良、功能基因克隆、转录组测序等后续研究提供一定的理论依据。
1 材料和方法
1.1 供试材料
138份周麦18 SP5籽粒突变群体是前期利用实践十号卫星搭载周麦18(ZM18)干种子而诱变创制的,且经过连续多代自交后,各性状已基本能够稳定遗传。所有材料于2020年10月种植于河南省科学院新郑试验基地,每个SP5突变体材料种植2行,且每隔20行种植2行野生型对照(CK),行长2.5 m,行距0.25 m,每行播50粒种子,待出苗后每行定苗至30株左右,每个突变体株行按田间试验序号如ZM18-01、ZM18-02、ZM18-03等依次编号。田间管理同大田生产,正常成熟后人工收获,及时晾晒,储藏备用。
1.2 表型测定
粒长和粒宽测定:每个SP5突变体材料和野生型对照材料中均随机取出20粒,重复3次,利用20 cm得力塑料直尺测量粒长和粒宽。
千粒质量测定:采用Contador型全自动数粒仪(德国福弗公司)进行种子计数,每个突变体材料和野生型对照材料均取1 000粒,重复3次;并采用LT1002E型电子天平(常熟市天量仪器公司)进行称质量。
1.3 SSR标记检测
从籽粒表型差异较为显著的突变体材料和野生型对照中各随机选取5粒种子,混合粉碎后分别放入3个2 mL离心管中,采用SLS(十二酰肌氨酸钠)法快速提取小麦籽粒DNA,具体操作根据Chen等[21]提取DNA的方法而改进。
利用小麦染色体上分布均匀、多态性信息指数高、特异性和稳定性较好的42对SSR引物[22]对部分SP5突变体及其亲本进行检测。PCR反应体系为20 μL,主要包括10×Buffer 2.0 μL,TaqDNA聚合酶(2.5 U/μL)0.4 μL,dNTP(200 μmol/L)1.0 μL,上下游引物(10 μmol/L)各0.5 μL,模板DNA 2.0 μL,ddH2O 13.6 μL。在Tprofessional standard型PCR仪(Biometra)中进行扩增,PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,55~65 ℃(依据不同引物的退火温度改变)退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。反应程序结束后,取5 μL PCR扩增产物用6.0%聚丙烯酰胺凝胶电泳分离,按照郭培国等[23]银染方法进行操作,用Fire Reader凝胶成像系统拍照,并保存至计算机以备统计分析。
1.4 SNP芯片分析
委托北京博奥晶典生物技术有限公司利用美国昂飞公司(Affymetrix,Inc.)研发的Axiom Wheat 55K 384S384 Layout芯片检测SP5中籽粒表型差异较为显著的突变体及其野生型对照材料的全基因组SNP,检测方法编号AG-XN-WL01-01-2012,SNP芯片的多态性分析采用GeneChip®Operating Software(GCOS)Version 1.2软件。
1.5 统计与分析
利用Excel 2013软件进行所有试验数据的统计,并对138份周麦18 SP5籽粒突变体材料及其野生型对照的粒长、粒宽和千粒质量等籽粒表型进行差异显著性分析。同时对籽粒表型差异较为显著的4个突变体进行SSR标记检测和SNP芯片分析。
2 结果与分析
2.1 籽粒表型分析
野生型对照周麦18的粒长、粒宽和千粒质量分别为13.40 cm、7.00 cm和48.16 g,同等条件下,对138份周麦18 SP5突变体籽粒表型分析发现,突变群体的平均粒长、粒宽和千粒质量均显著高于其野生型。突变群体中以千粒质量的变异最为丰富,变异系数较高,为8.30%;其次是粒长;而粒宽变化范围最小,变异系数最低,仅为3.61%(表1)。
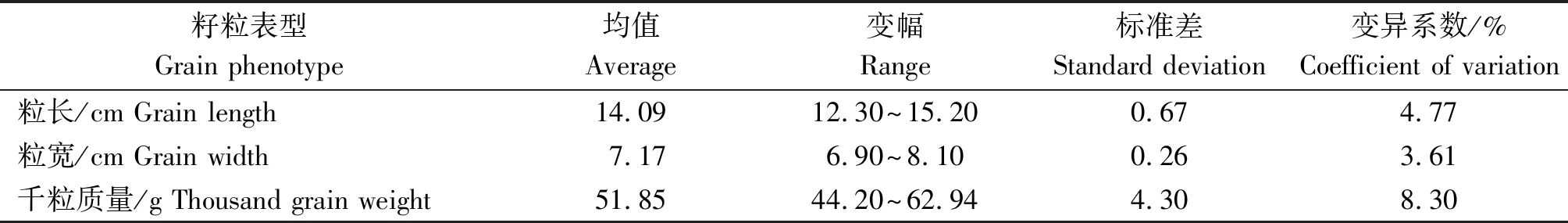
表1 周麦18 SP5籽粒突变体籽粒表型分析Tab.1 Analysis of grain phenotype of Zhoumai 18 SP5 grain mutants
进一步分析发现存在多个籽粒表型差异较为显著的突变体材料,从中选取4份千粒质量差异较大的突变体ZM18-7、ZM18-26、ZM18-105和ZM18-112进行表型分析和真实性鉴定。从图1可知,周麦18突变型籽粒与其野生型的籽粒表型存在显著差异(P<0.05)。大粒突变体ZM18-26和ZM18-112的千粒质量、粒长与野生型相比存在显著性差异,小粒突变体ZM18-7和ZM18-105的千粒质量、粒长与野生型相比也均存在显著性差异,但其粒宽与野生型相比差异不显著。
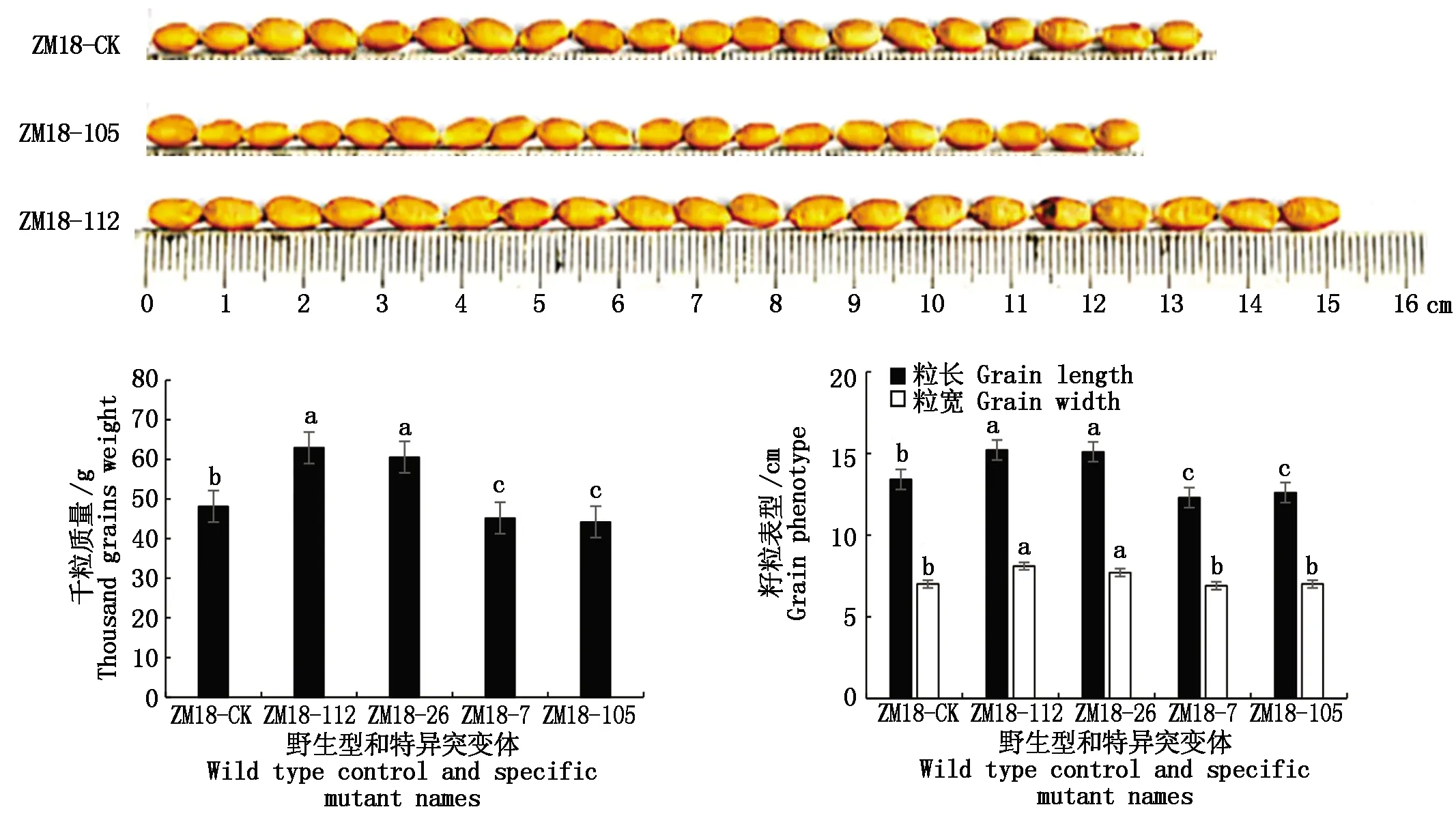
不同小写字母表示同一性状变异存在显著差异(P<0.05)。Different lowercase letters indicate significant difference(P<0.05).
2.2 突变体SSR标记检测
SSR标记分子检测结果表明,突变体ZM18-112与其野生型的差异标记为18个,多态性比例高达42.85%,而突变体ZM18-105、ZM18-26和ZM18-7与其野生型的差异标记分别为1,0,2个,多态性比例分别为2.38%,0,4.76%(表2、图2)。根据王立新等[24]提出的杂株判定标准,在待测小麦品种的种子之间,比对核心SSR分子标记位点的带型,当差异标记≥3个位点的带型不同时,表示差异个体与亲本之间的遗传相似性低,存在异花授粉或机械混杂的可能性,即可判定为杂株。突变体ZM18-112与其野生型周麦18的差异标记位点为18个,故可以判定航天诱变突变体ZM18-112是由异花授粉或机械混杂产生的假突变体,而突变体ZM18-105、ZM18-26和ZM18-7与其野生型周麦18的差异标记位点均≤3个,说明突变体ZM18-105、ZM18-26和ZM18-7与野生型周麦18的遗传背景基本一致,是经过航天诱变而产生的真实突变体。
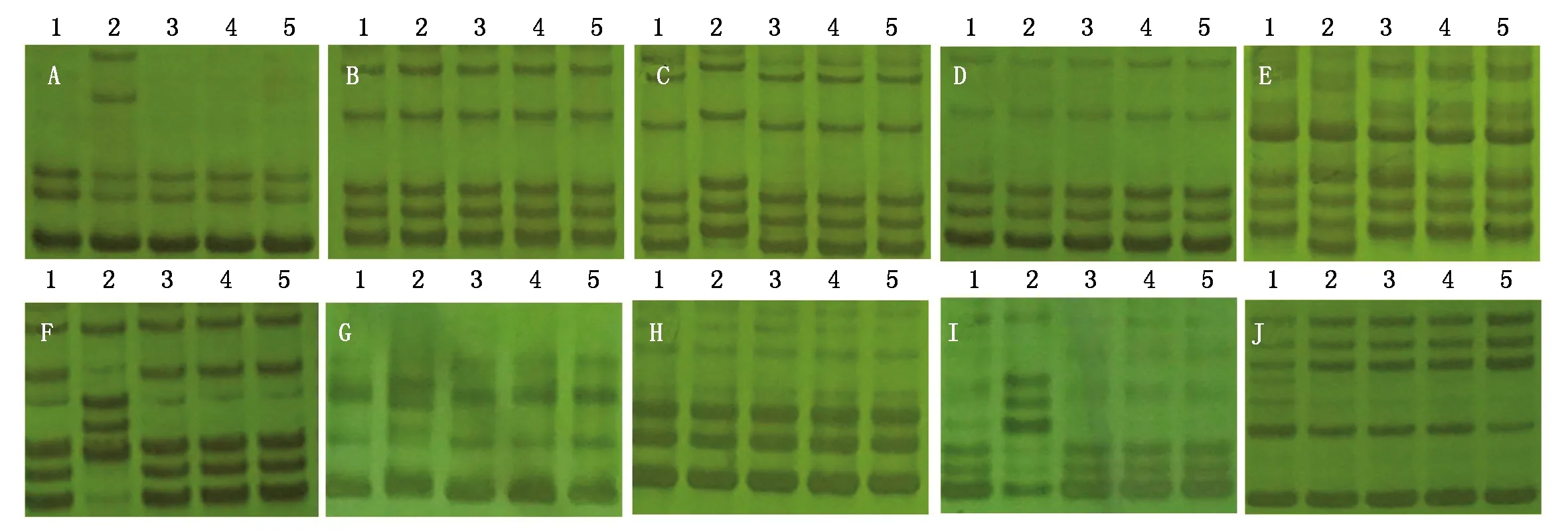
A.Barc80; B.Cfd72; C.Gwm285; D.Cfd29; E.Cfd76; F.Wmc522; G.Barc164;H.Gwm495; I.Barc345; J.Gwm44.1.ZM18-CK; 2.ZM18-112; 3.ZM18-105; 4.ZM18-26; 5.ZM18-7。

表2 周麦18 SP5突变体与野生型之间的42个SSR标记多态性检测Tab.2 Polymorphism of 42 SSR markers between SP5 mutants and wild type of Zhoumai 18
2.3 突变体SNP芯片分析
为进一步鉴定突变体的真实性,同时分析航天诱变突变体的遗传背景与其野生型之间的关系,利用Axiom Wheat 55K 384S384 Layout芯片的53 063个SNP标记对周麦18及其SP5中籽粒表型差异较为显著的突变体进行多态性分析。结果发现(表3),突变体ZM18-112与野生型的差异SNP位点高达7 058个,占SNP总数的13.301 2%,其中纯合SNP位点多态性数量为2 609个,占总数的4.9168%,进一步分析发现,这些差异SNP位点随机分布在除1A和1D以外的染色体上;而突变体ZM18-105、ZM18-26和ZM18-7与野生型的差异SNP位点分别为386,315,408个,分别占总数的0.7274%,0.5936%,0.7689%,其中纯合SNP位点多态性数量分别为110,63,166个,分别占总数的0.2073%,0.1187%,0.3128%,进一步分析发现,这些差异SNP位点主要分布在2B和3D染色体上。上述SNP芯片分析结果从基因组水平上进一步证实了ZM18-112与其野生型的遗传背景差异较大,是假突变体,而ZM18-105、ZM18-26和ZM18-7则为周麦18经过航天诱变而产生的真实突变体,可进行功能基因克隆、转录组测序等后续研究。

表3 周麦18 SP5突变体与野生型之间的SNP标记多态性检测Tab.3 Polymorphism of SNP marker between SP5 mutants and wild type of Zhoumai 18
3 结论与讨论
航天诱变对小麦的株高、穗长、产量以及品质等性状均有重要影响,航天诱变的性状遗传稳定快,有益性状的变异频率高。王美芳等[25]研究发现,小麦种子经航天诱变后能引起后代表现型的广泛变异,但不同品种和不同性状对空间环境的敏感性、诱变效果不同,SP3株高、穗长、产量性状、品质性状的变异尤为突出。本研究仅对航天诱变突变体的籽粒表型进行分析,结果表明,周麦18 SP5突变群体中的籽粒表型变异尤为丰富,以千粒质量的变异系数最大,粒宽变异系数最小,且该突变群体的粒长、粒宽和千粒质量均值均显著高于野生型。然而,对上述航天诱变获得籽粒表型差异较为显著的突变体进行诱导突变分子机制研究时,必须借助于分子标记鉴定技术区分真实突变体和假突变体。
吕兴娜等[26]采用21对核心SSR引物对航天诱变衍生系与亲本进行分子检测,并对其遗传相似性进行评估,发现兰天15的航天诱变衍生系与亲本间差异标记数量在4~12个,且部分性状发生严重分离,推测可能是由于异花授粉产生的假突变体,而郑麦9023的航天诱变衍生系与亲本间差异标记数量少于3个,仅有成株期抗性等少数性状发生分离,推测其可能是航天诱变产生的真实突变体。耿皆飞等[17]采用相同的21对核心SSR引物对小麦品系H261及其EMS突变体进行分子检测,结果发现,H261与突变体LF2010和LF2099的差异SSR标记数量为0个,但与突变体LF2100的差异SSR标记数量为10个,多态性比例为47.62%,进而认为LF2010和LF2099是H261经过EMS诱变产生的真实突变体,而LF2100则是由于天然异交或机械混杂产生的假突变体。本研究利用42对SSR引物(21对核心引物和在小麦染色体上分布均匀、多态性信息指数高、特异性和稳定性较好的21对扩展引物)对4份千粒质量差异较大的航天诱变突变体ZM18-7、ZM18-26、ZM18-105和ZM18-112进行真实性鉴定,结果表明,航天诱变突变体ZM18-112与其野生型的差异标记为18个,多态性比例高达42.85%,且多数性状发生严重分离,认为ZM18-112是由于异花授粉或机械混杂产生的假突变体,而突变体ZM18-105、ZM18-26和ZM18-7与其野生型的差异标记均不超过3个,且仅有千粒质量等少数性状发生分离,认为突变体ZM18-105、ZM18-26和ZM18-7与野生型的遗传背景基本一致,是经过航天诱变而产生的真实突变体。
由于SSR与相关序列扩增多态性(Sequence related amplified polymorphism,SRAP)等标记受位点数量和方法的限制,即使突变位点发生在SSR、SRAP等引物结合位点,该突变位点也不一定能被标记检测出来,故无法从全基因组水平上对突变体进行高通量真实性鉴定。随着新一代测序技术的快速发展,高通量测序和SNP芯片技术在水稻、烟草、小麦等作物基因研究上广泛应用。Cheng等[27]利用γ射线诱变水稻9311得到优异突变体Red-1,并对其进行全基因组重测序,结果发现,Red-1的14 493个基因中存在381 403个SNP、50 116个小片段插入/缺失(Insertions/deletions,Indels)、1 279个拷贝数变异(Copy number variations,CNVs)和10 026个存在/缺失变异(Presence/absence variations,PAVs),改变序列占整个基因组序列的9.19%,而点突变是Red-1基因组的主要变异类型。周世奇等[28]为研究烟草航天诱变机理,对航天诱变突变体进行全基因组重测序,结果表明,突变体NC89-M和其野生型重测序后对比得到271 655个SNP,分布在8 378个基因上,23 450个Indels造成2 156个基因突变,进一步分析发现航天诱变引起的烟草基因组变异以单碱基突变为主。耿皆飞等[17]对小麦品系H261经EMS诱变得到的LF2099、LF2010和LF2100突变体进行高通量SNP芯片检测和分析,结果发现,在检测的81 597个SNP中,LF2099和LF2010突变体与野生型之间的差异SNP数量分别为12,66个,仅占0.0147%,0.0809%,且纯合的差异SNP位点均为0个,进一步证实了LF2099和LF2010突变体是EMS诱变产生的真实突变体。Daba等[29]通过全基因组关联研究小麦株高,利用测序基因分型产生的38 693个SNP标记,进一步结合表型分析检测到3个与性状关联紧密的标记(Marker-trait associations,MTAs),即QPLH-2D、QPLH-4B.2和QPLH-4D,能单独解释10%~16%的表型变异。本研究利用小麦55K基因芯片的53 063个SNP标记对周麦18及其SP5中籽粒表型差异较为显著的突变体进行多态性分析,发现突变体ZM18-112与野生型的差异SNP位点所占比例高达13.301 2%,二者遗传背景差异较大,是假突变体,而另外3个突变体与野生型的差异SNP位点所占比例不超过0.768 9%,说明它们之间的遗传差异较小,是航天诱变的真实突变体。以上研究说明,利用高通量测序和SNP芯片技术可以从全基因组水平上对突变体进行高通量真实性鉴定。
综上,对航天诱变获得的138份周麦18 SP5突变体籽粒表型进行分析,结果发现,突变群体的千粒质量、粒长差异显著,其中千粒质量的变异最为丰富,粒宽变异不显著,且突变群体的粒长、粒宽和千粒质量均值均显著高于其野生型,说明航天诱变的有益突变频率较高。同时利用SSR分子标记和55K SNP基因芯片对籽粒表型差异较为显著的突变体进行真实性鉴定,结果表明,上述2种方法均能够很好地鉴别出纯合基因型与杂合基因型,可以有效鉴定航天诱变突变体的真实性。此外,SNP基因芯片鉴定方法可以在全基因组水平上对突变体进行高通量分析,提供的遗传信息也更为完整,为进一步利用优良突变体进行遗传改良、功能基因克隆、转录组测序等后续研究提供更为可靠的理论依据。
