大豆GmGRAS69基因过表达增强拟南芥的耐旱性
2023-07-08张斌
张 斌
(湖南科技学院 化学与生物工程学院,湖南省银杏工程技术研究中心,湖南 永州 425199)
植物作为固着生物,在其整个生命周期经常会受到不利的环境因素影响,如盐、干旱等都能影响植物正常发育过程,严重时则导致作物减产或绝产。为了适应不利的生存条件,在不断地自然选择和进化过程中,植物形成了多种策略提高自身对环境的适应能力。植物对环境胁迫适应的调控机制主要是通过激活或抑制胁迫响应途径中的基因表达来实现的[1]。已有研究指出,多种转录因子家族成员在胁迫响应基因的表达调控方面发挥功能,从而调节植物对不利环境的适应能力[2]。如WRKY、AP2/ERF、MYB、NAC、bZIP和GRAS等家族成员在植物对盐、干旱等胁迫中的功能和分子机制已被报道[3-5]。
GRAS是植物中特有的转录因子家族,至今在其他物种中未见有关该家族成员的报道。通常GRAS蛋白的C端高度保守,被称为GRAS结构域,该保守结构域由SAW、RVER、PFYRE、V/IHIID等基序组成。到目前为止,已有多种植物GRAS家族成员被鉴定出来,如拟南芥(Arabidopsisthaliana)[6]、水稻(Oryzasativa)[6]、烟草(Nicotianatabacum)[7]、玉米(Zeamays)[8]、胡杨(Populuseuphratica)[9]、甘薯(Ipomoeatrifida)[10]、棉花(Gossypiumhirsutum)[11]和大豆(Glycinemax)[12]等。研究显示,GRAS基因在信号转导、腋生分生组织发育和根细胞伸长调节等过程发挥重要功能[13-14]。GRAS基因正调控植物对生物和非生物胁迫的耐受功能也已被报道,如番茄SlGRAS6沉默的植株表现出更高的抗病能力,而过表达SlGRAS40基因的转基因番茄植株则表现出对盐和干旱胁迫更强的耐受性[15]。结缕草(ZoysiajaponicaSteud.)GRAS家族成员ZjCIGR1,其表达水平在冷冻胁迫下显著上升,其过表达可增强转基因材料耐冷性[16]。山葡萄(Vitisamurensis)GRAS家族基因VaPAT1在拟南芥中异源表达可增强AtSIZ1、AtCBF1、AtATR1/MYB34、AtMYC2、AtCOR15A、AtRD29A和AtRD29B等逆境相关基因的表达;在寒冷、干旱和盐胁迫下,过表达株系通过积累较高水平的脯氨酸和可溶性糖含量增强胁迫耐受性[17]。Yang等[18]在甘蓝型油菜中鉴定到一个GRAS家族LAS亚族基因BnLAS,该基因过表达可通过激活蜡质合成相关基因(CER1、CER2、KCS1和KCS2)的表达,增加蜡质在莲座叶表皮的积累,进而赋予转基因拟南芥更强的耐旱能力。白菜型油菜GRAS家族基因BrLAS也具有类似的功能,其过表达拟南芥植株的发育受到抑制,如抽薹和开花时间延迟、育性降低和衰老延迟等;干旱胁迫下,BrLAS可通过增强拟南芥SOD、POD、CAT2和APX等基因表达水平,提高抗氧化酶活性,清除过量的ROS,最终使过表达植株表现出更强的耐旱性[19]。Ma等[20]研究发现,干旱和盐处理能够导致杨树PeSCL7基因(属于GRAS家族)的表达水平显著上调,同时过表达PeSCL7基因的拟南芥耐旱和耐盐性均明显增强。而Wang等[2]发现大豆GmGRAS37基因的表达水平在干旱和盐胁迫处理下显著上调,过表达GmGRAS37的大豆毛状根对干旱和盐胁迫的抗性明显增强,且非生物胁迫相关的基因(GmDREB1、GmNCED3、GmCLC1、GmSOS1、GmSOD1和GmSOD2)的表达水平较EV植株显著上调。大豆是一种原产于中国的重要豆科植物,为人类生产生活提供大量的蛋白质和植物油,也是动物饲料的主要原材料,但其生长和产量易受到干旱胁迫影响。探究大豆耐旱的机理,寻求调控耐旱的关键基因对增强大豆抗旱性至关重要。前期研究中,在栽培大豆中鉴定到78个GRAS家族成员;通过转录组测序和荧光定量PCR检测,发现大豆GmGRAS14、GmGRAS33和GmGRAS69的相对表达水平在盐处理后显著增加[12]。本研究发现,GmGRAS69的表达水平受干旱诱导上调,过表达GmGRAS69的转基因拟南芥的耐旱性明显增强,这些结果可为解析大豆耐旱机理和培育耐旱品种提供理论支持和重要的候选基因。
1 材料和方法
1.1 序列多重比对和系统进化树构建
使用氨基酸序列构建不同植物GRAS家族成员的系统进化树。首先将所需的GRAS成员氨基酸序列整理成FASTA格式,然后利用多序列比对分析软件(Clustal X)进行多重比对[21],保存比对结果。使用MAGA-X软件再次分析氨基酸多重比对结果,然后基于邻接法和泊松模型构建不同植物GRAS家族成员的进化树[22]。
1.2 植物材料培养和干旱处理
本研究使用的植物材料包括栽培大豆Williams 82和拟南芥(Col-0)。将大豆和拟南芥种子直接播种于营养土和蛭石混合(1∶1)基质中,用Hoagland营养液浇灌,在植物培养室生长,培养室条件:长日照(16 h昼/8 h夜),温度22~25 ℃,空气湿度60%~70%。用30%的PEG溶液模拟干旱条件,处理生长14 d的大豆幼苗,分别在0,1,3,6,9,12 h取大豆的根和叶,用于RNA提取和基因表达水平检测,每种处理均包含3个独立的生物重复样品。
1.3 总RNA提取和荧光定量PCR检测
为了检测大豆GmGRAS69基因是否参与干旱胁迫响应,研究使用30% PEG溶液模拟干旱条件处理大豆植株,分别检测基因在根和叶中的表达水平变化。使用液氮将植物组织磨成粉末,然后提取总RNA,并利用琼脂糖凝胶电泳检测RNA提取质量,同时测定RNA浓度。取2 μg RNA使用反转录试剂盒(ThermoFisher scientific,美国)获得cDNA第1条链作为PCR模板。使用实时荧光定量PCR仪(CFX96,Bio-Rad,美国)进行基因表达量检测。荧光定量PCR体系包括10 μL 2×SYBR Green Mix,定量PCR引物(10 μmol/L)1.0 μL,cDNA模板(10 mg/μL)1.0 μL,加入超纯水至总体积20 μL。PCR仪程序设置为:94 ℃预变性3 min;94 ℃变性20 s,60 ℃退火和延伸30 s(40个循环)。以大豆UBI3和拟南芥ACT基因作为内参基因,利用2-ΔΔCt法计算目的基因的相对表达水平。本研究使用的定量PCR引物序列见表1。

表1 用于荧光定量PCR试验的引物序列Tab.1 Primer sequences for Real-time quantitative PCR experiments
1.4 大豆GmGRAS69基因过表达载体构建和拟南芥遗传转化
以大豆cDNA为模板,使用高保真DNA聚合酶克隆GmGRAS69基因的CDS片段,用T4DNA连接酶将克隆得到的片段连至双元表达载体pFGC5941的35S启动子下游。利用根癌农杆菌介导的浸花法转化野生型拟南芥[23],将收获T0种子播种,喷洒草铵膦筛选抗性植株。此外,使用CTAB法提取叶片总DNA用于转基因拟南芥PCR鉴定,提取RNA进行半定量PCR检测外源基因是否成功高表达,选取外源基因高表达的株系,筛选到T3、获得纯合材料用于后续试验。
1.5 转基因拟南芥耐干旱分析
野生型拟南芥和过表达株系(T3)的种子经75%乙醇表面消毒后,均匀播种于湿润的营养土和蛭石混合(1∶1)基质上,在4 ℃冷藏箱放置3 d后转移至植物培养室。14 d后取大小一致的拟南芥用于干旱处理,首先将培养拟南芥的基质吸水饱和,然后停止供水,使其自然干旱,观察野生型和过表达株系的表型变化。测定叶片相对含水量时取叶片称质量即鲜质量(Fresh weight,FW);将叶片浸没在去离子水中,放置在4 ℃冷藏箱12 h,擦干表面水后再次称质量即吸水后的总质量(Total weight,TW);将叶片在75 ℃烘箱烘干,再称质量即干质量(Dry weight,DW);叶片相对含水量=(FW-DW)/(TW-DW)×100%[24]。叶片可溶性糖含量的测定参考Yuan等[17]描述的方法。SOD、POD和CAT活性参考Li等[19]描述的方法测定,利用荧光定量PCR检测对应的SOD、POD和CAT基因在野生型和过表达植株中的表达水平,方法同前述,引物序列见表1。其中,测定鲜质量、叶片相对含水量和可溶性糖含量时均取6个生物重复样品进行试验;SOD、POD和CAT活性及对应的基因表达水平测定时均取3个生物重复样品。
2 结果与分析
2.1 大豆GmGRAS69的结构域和系统进化分析
根据已有报道,本研究整理了植物中参与植物干旱胁迫调控的GRAS家族成员的氨基酸序列,包括大豆GmGRAS37[2]、水稻OsGRAS23[25]、番茄SlGRAS40[15]、山葡萄VaPAT1[17]、白菜型油菜BrLAS[19]、紫花苜蓿MsGRAS51[26]和杨树PeSCL7[20]与GmGRAS69进行序列多重比对。结果显示,C端氨基酸非常保守、相似度很高,其包含高度保守的IHIID、PFYRE、RVER和SAW基序(图1-A)。根据这些氨基酸序列构建进化树,显示大豆GmGRAS69和MsGRAS51、GmGRAS37、VaPAT1具有较近的进化关系(图1-B)。前期已有报道指出GmGRAS37和VaPAT1在干旱胁迫响应中发挥正调控作用,因此,推测大豆GmGRAS69可能具有类似的功能。

A.大豆GmGRAS69和其他GRAS蛋白的氨基酸序列比对;B.GRAS家族的系统进化树。A.Amino acid sequence alignment of soybean GmGRAS69 and other GRAS proteins;B.Phylogenetic tree of the GRAS family.
2.2 干旱处理下GmGRAS69基因表达变化
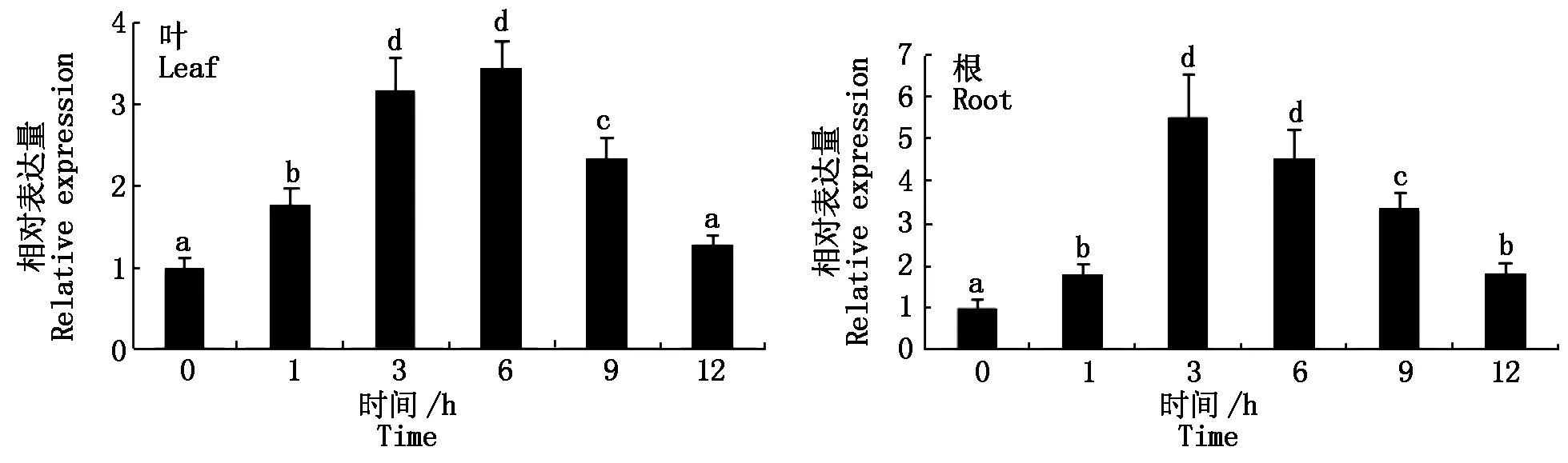
荧光定量PCR结果显示,GmGRAS69基因的表达水平在大豆根和叶中均受PEG诱导上调;PEG处理6 h,在叶中的表达水平达到最高(上调约3.4倍),然后逐渐下降,在12 h与对照(0 h)无显著差异(图2)。GmGRAS69基因的表达水平在根中受PEG诱导上调更显著;处理3 h上调约5.5倍,随后表达水平逐渐下降,但12 h仍显著高于0 h(图2)。这一结果说明GmGRAS69基因能够响应干旱胁迫,导致表达水平发生改变。
不同小写字母表示差异显著。图4—5同。Different lowercase letters indicate significant difference.The same as Fig.4—5.
2.3 GmGRAS69基因过表达拟南芥转化和鉴定
本研究克隆了大豆GmGRAS69基因的CDS序列,片段长度为1 638 bp(图3-A);回收片段后插入植物表达载体pFGC5941,再利用XhoⅠ和XbaⅠ双酶切验证片段成功插入目的位点(图3-B),最终获得构建成功的重组载体(图3-C)。利用根癌农杆菌介导的浸花转化法将重组载体转化野生型拟南芥,利用草铵膦筛选T0抗性植株(即对草铵膦有抗性、叶片呈绿色且可正常生长的幼苗)(图3-D)。进一步进行PCR验证显示,编号1,2,3,5号植株都能扩出目的条带,说明这些植株为转基因材料(图3-E)。进一步提取RNA检测基因表达水平,显示野生型材料中未检测到GmGRAS69基因的表达;转基因植株#1、#2和#3中外源基因GmGRAS69则能够表达(图3-F),说明成功获得GmGRAS69基因过表达株系,这些株系可用于下一步功能分析。
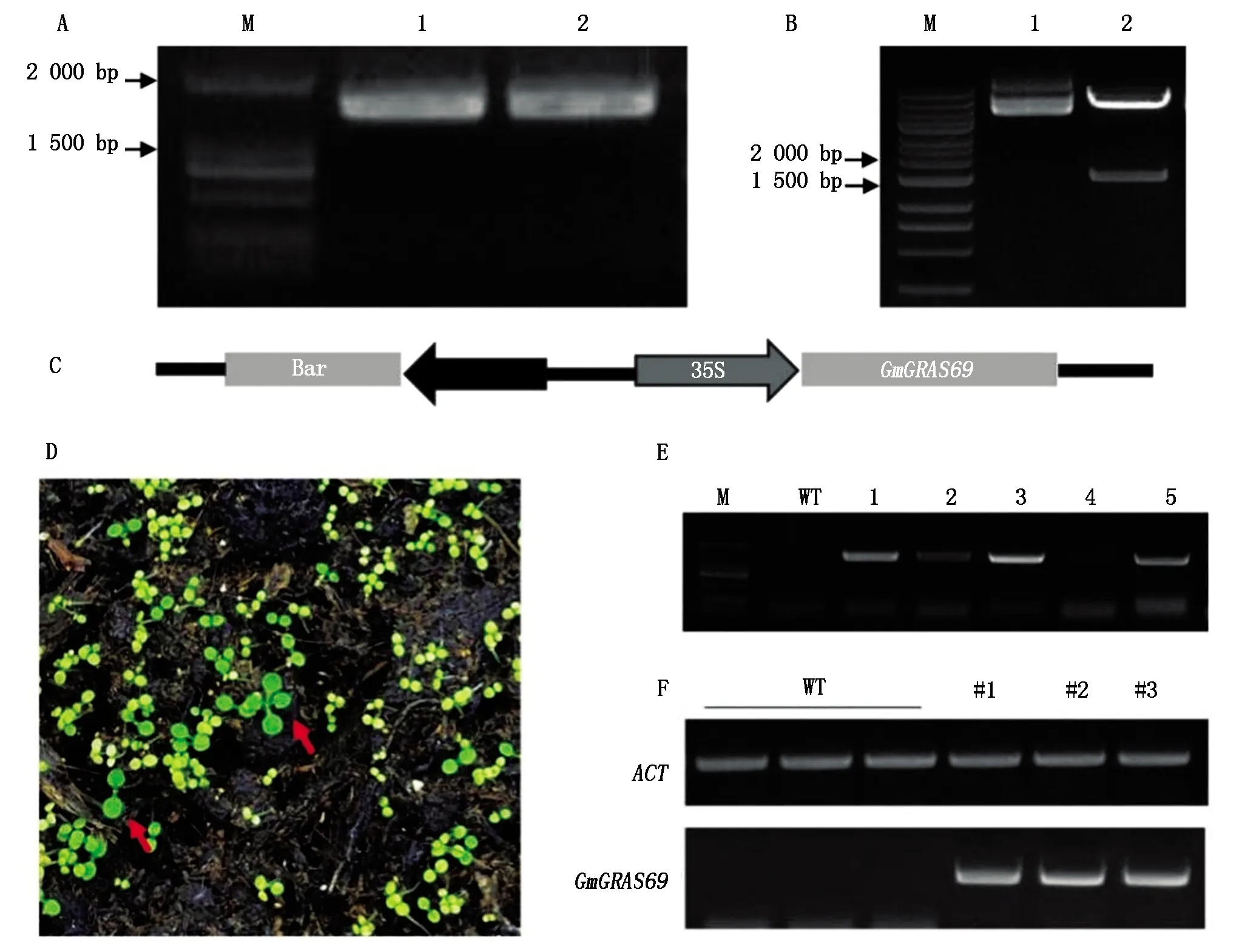
A.GmGRAS69基因CDS片段克隆;B.重组载体酶切验证;C.过表达载体示意图;D.抗草铵膦的拟南芥植株筛选;E.转基因拟南芥PCR鉴定;F.GmGRAS69基因异源表达的半定量PCR检测。A.Cloning of CDS fragment of GmGRAS69;B.Enzyme digestion verification of recombinant vector;C.Schematic diagram of overexpression vector;D.Screening of Arabidopsis plants resistant to glufosinate;E.PCR identification of transgenic Arabidopsis;F.Semi-quantitative PCR detection of heterologous expression of GmGRAS69.
2.4 GmGRAS69基因过表达拟南芥耐旱性分析
选取2个过表达株系(OE#1和OE#2)纯合植株(T3)进行耐旱性分析。野生型和过表达植株正常培养14 d后,分成对照组和干旱处理组,其中对照组营养基质吸水饱和后仍正常浇水,处理组营养基质吸水饱和后停止供水。处理14 d后,发现对照组植株长势正常,植株大小和单株鲜质量无显著差异;而处理组植株生长虽然都受到了抑制、叶片失绿,但是WT受抑制更严重,其莲座叶萎蔫,单株鲜质量显著低于过表达株系OE#1和OE#2(图4-A、B)。干旱处理后,拟南芥WT、OE#1和OE#2植株叶片相对含水量都显著下降,但是,在OE#1和OE#2植株中显著高于WT;干旱处理导致叶片中可溶性糖含量显著上升,在过表达植株中的积累量比WT更高(图4-C、D)。这些植株生长表型和生理指标表明大豆GmGRAS69基因异源表达增强了拟南芥的耐旱性。

图4 GmGRAS69基因过表达拟南芥的耐旱性分析Fig.4 Analysis of drought tolerance of Arabidopsis overexpressing GmGRAS69
2.5 GmGRAS69基因过表达植株中抗氧化途径被激活
为了探究GmGRAS69基因调控植物耐旱的可能机理,测定拟南芥叶中SOD、POD和CAT活性。结果显示,正常生长的拟南芥WT和过表达植株中的酶活性无显著差异;干旱处理后,野生型WT和过表达植株的SOD、POD和CAT活性均显著增强,且在过表达植株中显著高于WT(图5)。检测对应的SOD、POD和CAT基因表达水平,发现干旱处理后3个基因在拟南芥WT和过表达植株(OE#1和OE#2)中的表达水平都显著上调,并且在OE#1和OE#2植株中上调倍数显著高于WT(图5)。说明GmGRAS69可以通过上调抗氧化酶编码基因的表达、增强抗氧化酶的活性赋予转基因拟南芥更强的耐旱性。

图5 GmGRAS69基因过表达对抗氧化酶活性和抗氧化酶基因表达水平的影响Fig.5 Effects of overexpression of GmGRAS69 on antioxidant enzyme activity and expression level of antioxidant enzyme genes
3 结论与讨论
研究表明,植物GRAS蛋白,如大豆GmGRAS37、山葡萄VaPAT1、白菜型油菜BrLAS、杨树PeSCL7等在植物干旱胁迫响应过程发挥重要作用[2,17,19-20]。本研究通过氨基酸结构分析表明,大豆GmGRAS69蛋白与上述蛋白在C端具有共同的保守结构域。对基因家族或同源基因进行系统进化分析时,一般认为属于同一亚家族或同一进化分支的基因同源性较高、可能具有类似的生物学功能[10]。本研究中构建的系统进化树显示GmGRAS69与MsGRAS51、GmGRAS37、VaPAT1具有更近的进化关系,表明其在大豆干旱胁迫响应和适应过程也发挥特定功能。前期研究表明,GmGRAS69基因在大豆根中受盐胁迫诱导表达上调[12]。本研究显示PEG处理的大豆根和叶中GmGRAS69基因的表达水平都显著上调,且在根中上调倍数更高,这种干旱诱导的表达特性可能与其对干旱胁迫的适应有关。为了探究GmGRAS69参与植物耐旱的功能,获得了GmGRAS69基因过表达拟南芥植株。有研究显示,外源基因的表达会对抑制转基因拟南芥的正常生长、延缓发育过程[19]。比较正常培育和干旱处理后的拟南芥野生型WT和GmGRAS69过表达株系(OE#1和OE#2)生长表型发现,正常条件下过表达植株和WT的表型无显著差异,说明大豆基因的异源表达未对拟南芥的生长发育产生不利影响;而在干旱处理后,所有植株均表现为生长受到抑制,叶片失氯、萎蔫,但是过表达植株的长势明显由于WT,主要体现在单株鲜质量和叶片相对含水量均显著高于WT,说明GmGRAS69基因过表达增强了转基因拟南芥的耐旱性。可溶性糖是一种十分重要的渗透调节物质,多种非生物胁迫(干旱、盐、冷胁迫等)都会导致植物体内的可溶性糖含量变化;一般认为胁迫条件下可溶性糖含量积累越多,植物抗逆性越强[17]。干旱胁迫下,WT和过表达植株中的可溶性糖含量都显著增加,但是过表达植株中的可溶性糖含量显著高于WT;因此,相比于WT,OE#1和OE#2植株受到的伤害减轻,长势优于WT。干旱胁迫能够直接引起氧化损伤,植物中的ROS清除酶(包括SOD、POD、CAT、APX和GST)能够减轻氧化损伤,增强植物的耐旱性[20,27]。为了进一步解析GmGRAS69参与耐旱的分子机制和调控途径,测定了正常培育和干旱处理的WT和过表达植株中SOD、POD和CAT活性,发现干旱处理的所有植株中上述酶活性均显著增强,而在过表达植株中显著高于WT。检测拟南芥叶中SOD、POD和CAT对应编码基因的表达水平发现,干旱胁迫下过表达植株中的SOD、POD和CAT基因表达水平也显著高于WT。以上结果说明,大豆GmGRAS69蛋白可以通过激活抗氧化途径,增强抗氧化酶活性,清除干旱胁迫导致的ROS,以缓解对植物的损伤。类似的,已有研究证明白菜型油菜GRAS家族成员BrLAS也可以通过增强SOD、POD和CAT活性、清除干旱胁迫下过量积累的ROS,提高对应的SOD、POD和CAT2基因的表达水平,增强BrLAS基因过表达拟南芥的耐旱性[19]。本研究从大豆GRAS家族中筛选到一个受干旱诱导的成员GmGRAS69,通过序列比对和进化分析以及对转基因拟南芥的表型分析,初步证明了GmGRAS69通过抗氧化途径和增加渗透调节物质可溶性糖的积累,增强转基因植株的耐旱性。但是转录因子GmGRAS69是如何参与调控抗氧化酶的活性,通过哪种机制调控下游基因的表达,这是一个复杂的调控过程,值得进一步探究,也是接下来的研究方向。
