二甲双胍通过AMPK/STAT3信号通路抑制星形胶质细胞的反应性*
2023-07-07林海旭管徒晨巫荣华
林海旭 管徒晨 巫荣华
(南通大学, 江苏 南通 226000)
脊髓损伤(Spinal cord injury,SCI)是一种临床上常见的神经系统损伤疾病,具有较高的致死率和致残率,其导致的运动及感觉功能障碍给患者及社会带来了沉重的经济和精神负担[1-3]。脊髓损伤后神经再生困难的主要原因有中枢系统神经元轴突再生能力有限,轴突生长的微环境中存在抑制因素,以及胶质瘢痕的形成阻碍了轴突再生[4]。脊髓损伤后星形胶质细胞活化增生,形成反应性星形胶质细胞(Reactive astrocytes,RAs)。研究[5]发现,按照反应性星形胶质细胞对神经元轴突生长的影响,可以分别分为:抑制轴突生长作用的反应性星形胶质细胞(A1型星胶)和促进轴突生长或神经保护作用的反应性星形胶质细胞(A2型星胶)。另有研究[6]指出,创伤后微环境中的肿瘤坏死因子(Tumor necrosis factor-α, TNF-α)、白介素1α(IL-1α)、补体1q(C1q)三种因子(简称三因子)的含量上升,将其加入正常状态星形胶质细胞中可以诱导其成为A1型星胶,而补体成分3(Complement component 3, C3)被认为是A1型星胶的标记物[7]。2019年,Vismara等[8]发现在小鼠脊髓损伤后选择性抑制A1型星胶进程可以促进功能恢复,提示调节A1型星胶可以作为治疗脊髓损伤修复的方向之一。
二甲双胍是Ⅱ型糖尿病的经典用药,被广泛报道[9-11]在多种领域中具有潜在功效,比如可以作用于肺部、肠道等。近年有研究[12-13]报道二甲双胍具有抗炎、抗氧化、抗凋亡和神经保护的作用,其主要机制包括激活AMPK通路增加细胞代谢、线粒体呼吸和葡萄糖摄取[14]、抑制mTOR通路抑制细胞凋亡促进自噬等。二甲双胍可以促进大鼠脊髓损伤后后肢运动功能恢复,其机制可能与抗炎和神经保护作用有关、与抑制内质网应激相关、通过对自噬通量的调节、与稳定微管和抑制氧化应激及线粒体功能障碍有关[13, 15-17]。另有研究[18-19]表明,二甲双胍可以通过调节小胶质细胞促进髓鞘碎片清除,加速脊髓损伤后的神经修复。并显著促进轴突生长。本研探讨二甲双胍对体外培养的大鼠脊髓星形胶质细胞反应性的作用及可能机制,为二甲双胍治疗脊髓损伤提供实验研究数据。
1 资料与方法
1.1 TNF-α、IL-1α、C1q及二甲双胍溶液配制 实验中所用的细胞因子TNF-α(货号: abs04232-10 μg)购自上海爱必信生物科技公司;IL-1α(货号:400-01A)购自Peprotech公司;C1q(货号:NBP2-62410)购自Novus公司;盐酸二甲双胍(货号:M107827)购自上海阿拉丁生化科技公司。药物在超净工作台中分别使用相应的溶剂溶解至储存浓度,使用一次性注射器及无菌滤器过滤并分装,置于-80 ℃长期保存,见表1。
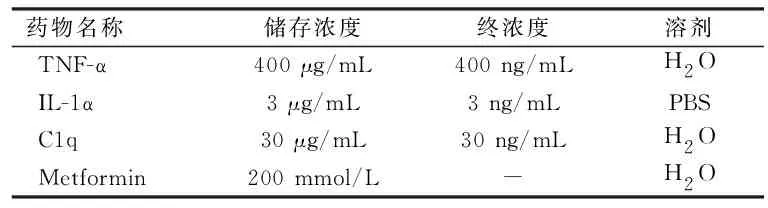
表1 细胞因子及二甲双胍的使用浓度Table 1 Concentrations of cytokines and metformin
1.2 原代脊髓星形胶质细胞的培养 实验所用SPF级SD大鼠乳鼠由南通大学实验动物中心提供,并在南通大学动物护理和使用委员会的指导方针下进行动物实验(伦理号为S20200330-003)。对出生1 d的SD乳鼠进行取材,具体过程如下:将乳鼠使75%酒精擦拭消毒后,用眼科剪断头处理,随后沿脊柱将皮肤剪开,暴露乳鼠脊椎椎骨。使用显微剪插入锥孔沿脊柱将脊椎剖开,暴露脊髓。使用显微弯镊沿脊髓两侧对神经束进行离断,将脊髓完整取出,浸泡于含2%青链霉素(碧云天,货号:C0222)的Hanks液(美仑生物,货号:MA0015)中。体式显微镜下,使用显微直镊与显微弯镊将脊髓表面脊膜剥离,剥离后的脊髓浸泡于含2%青链霉素的Hanks液中。使用1000 μL移液器将组织吹散,然后收集至15 mL离心管中,1200 rpm室温离心3 min。去上清,加入2 mL 0.25%胰酶(Gibco,货号:25200072)消化,置于37 ℃细胞培养箱中消化15 min,每5 min振荡1次,每次15 s。加入2倍体积含有10%胎牛血清 (LONSERA,货号:S711-001S)的DMEM/F12(Corning,货号:10092022)完全培养基终止消化,过40 μm筛网后收集细胞悬液至15 mL离心管中,1000 rpm离心5min后弃上清。加入适量的完全培养基重悬细胞,按5×106的细胞量接种至T75细胞培养瓶中,随后使用含10%胎牛血清、1% 青链霉素、1% L-谷氨酰胺(碧云天,货号:C0212)及0.1% 两性霉素B(美仑生物,货号:MB1014)的DMEM/F12完全培养基培养于5% CO2的37℃细胞培养箱内,2~3 d换液,至其长满后备用。
1.3 A1型反应性星形胶质细胞模型的建立 P2代星形胶质细胞用0.25% 胰蛋白酶消化后计数后按5×104个/孔接种到6孔板中。待细胞贴壁2 h后,按照表1加入三因子(TNF-α、IL-1α、C1q)继续培养3 d。使用徕卡DMi8显微镜拍摄细胞形态,并使用实时荧光定量PCR检测基因的mRNA表达水平。
1.4 二甲双胍和Compound C处理A1型星胶二甲双胍处理 A1型星胶实验中将P2代星形胶质细胞用0.25% 胰蛋白酶消化后计数后按5×104个/孔接种到6孔板中。待细胞贴壁1 h后按照表1加入三因子(TNF-α、IL-1α、C1q)和不同浓度的二甲双胍,继续培养3 d后进行后续实验;将细胞分为对照组、A1型星胶组、二甲双胍处理组(5、10、20 mM)。使用Compound C处理星胶实验中待细胞贴壁后使用不同浓度(5 μM、15 μM)Compound C(简称CC, MCE公司,货号:1219168-18-9)处理细胞1 d后进行后续实验;细胞分组为对照组、CC处理组(5 μM、15 μM)。二甲双胍和Compound C处理星胶细胞实验中待细胞贴壁1 h后使用20 mM二甲双胍预处理细胞1 h,后加入三因子继续培养2 d,然后加入15 μM Compound C处理细胞1 d后进行后续实验;细胞分组为对照组、A1型星胶组、20 mM二甲双胍处理组、20 mM二甲双胍+15 μM CC处理组。
1.5 实时荧光定量PCR检测不同处理组的星胶细胞 使用1×PBS洗涤3次后使用微量RNA提取试剂盒(Magen,货号:R4012-02)提取总RNA,使用逆转录试剂盒(诺唯赞,货号:R312-01/02)将RNA逆转录为cDNA,使用TB Green®Premix Ex TaqTMII试剂盒(takara,货号:RR820)进行实时荧光定量PCR检测,反应体系总体积为10 μL:TB Green®Premix Ex TaqTMII 5 μL,cDNA 1 μL,Sense Primer(10 μM)0.5 μL,Antisense Primer(10 μM)0.5 μL,RNase-Free H2O 3 μL。通过2-△△Ct方法分析相对基因表达,GAPDH作为内参基因。引物序列,见表2。

表2 实时荧光定量PCR引物信息Table 2 The sequences of the primers for RT-qPCR
1.6 Westernblot实验 不同处理组的星胶细胞使用1×PBS洗涤3次后加入适量含有1% PMSF(碧云天,货号:ST506)、2%磷酸酶抑制剂(碧云天,货号:P1045)的细胞裂解液(碧云天,货号:P0013B)冰上裂解30 min。然后收集至1.5 mL EP管中,4 ℃,12,000 rpm离心15 min。收集上清,采用BCA蛋白浓度测定试剂盒(碧云天,货号:P0012)测定浓度,将蛋白样品的终浓度定为2 mg/mL,按比例加入6×SDS loading buffer,置于100 ℃水浴锅煮沸5 min。使用Express cast Page彩色凝胶快速试剂盒(新赛美,货号:P2011)配置凝胶,进行SDS蛋白电泳,随后将蛋白转移至PVDF膜(默克,货号:ISEQ00010)。将膜置于5%脱脂牛奶中封闭2 h后,4 ℃使用一抗(C3(Abcam,ab200999,1∶1000)、p-AMPK(Cellsignalingtechnology,#2535,1∶1000)、AMPK(Cellsignalingtechnology,#5832,1:1000)、STAT3(Cellsignalingtechnology ,#9139,1∶1000)、p-STAT3(Cellsignalingtechnology,#9145,1:1000)和α/β-Tubulin(Cellsignalingtechnology,#2148,1∶2500))孵育过夜,1×TBST摇床洗涤PVDF膜3次,每次10 min,然后室温孵育相应二抗(1∶2500)2 h,使用1×TBST洗涤3次,每次20 min。采用High-sig ECL发光试剂(Tanon,货号:180-501)曝光条带,使用Tanon仪器进行拍照。

2 结果
2.1 三因子诱导A1型反应性星形胶质细胞模型的建立 为了验证原代培养的脊髓星形胶质细胞是否可以诱导为A1型星胶,使用三因子(TNF-α、IL-1α、C1q)进行诱导,在第1~3 d收集细胞并提取RNA,逆转录后进行RT-qPCR检测。结果显示加入细胞因子后,星形胶质细胞形态由星形转变到狭长的梭形(见图1A);同时A1型星胶标记物C3基因在mRNA水平上的表达量显著上升,差异有统计学意义(P< 0.05, 见图1B)。上述结果表明,在原代培养的脊髓星形胶质细胞中加入三因子后,可以成功诱导成A1型反应性星形胶质细胞。

图1 三因子诱导星形胶质细胞为A1型反应性星形胶质细胞Figure 1 Astrocytes induced by three factors are A1 type reactive astrocytes注:A.星形胶质细胞中加入三因子1 d和3 d的形态变化;B.加入三因子1~3 d后星形胶质细胞中C3的mRNA表达情况。
2.2 二甲双胍对A1型星形胶质细胞反应性的影响 在A1型星胶中加入了不同浓度的二甲双胍,3 d后提取RNA,逆转录为cDNA进行RT-qPCR检测。A1型星形胶质细胞C3的表达在mRNA和蛋白水平都随着二甲双胍浓度的增加而逐渐降低并呈剂量依赖性,差异有统计学意义(P< 0.05),特别是二甲双胍浓度为20 mM时,C3的蛋白表达水平恢复到与对照组一致。上述结果表明二甲双胍可以抑制A1型星胶的产生。见图2。

图2 二甲双胍抑制A1型星胶细胞标志物C3的表达Figure 2 Metformin inhibits the expression of type A1 astrocyte marker C3注:A.不同浓度二甲双胍处理后星形胶质细胞中C3的mRNA表达水平;B.不同浓度二甲双胍处理后星形胶质细胞中C3的蛋白表达水平。a.代表性的Westernblot图;b.C3蛋白水平统计图。
2.3 二甲双胍对星形胶质细胞AMPK和STAT3表达的影响 检测AMPK和STAT信号通路,结果显示,在星形胶质细胞中加入不同浓度的二甲双胍后p-AMPK表达升高,同时抑制p-STAT3的表达,且呈浓度依赖性,差异有统计学意义(P< 0.05),见图3。

图3 二甲双胍对星形胶质细胞中AMPK和STAT3表达的影响Figure 3 Effect of metformin on AMPK and STAT3 expression in astrocytes注:A.不同浓度二甲双胍处理后星形胶质细胞中AMPK和STAT3的蛋白表达水平;B.AMPK和STAT3蛋白表达的统计图。
2.4 二甲双胍通过AMPK/STAT3信号途径抑制A1型反应性星形胶质细胞 为了进一步确认二甲双胍是否通过AMPK/STAT3信号轴来发挥作用,在培养的星形胶质细胞中加入5 μM和15 μM的AMPK信号通路抑制剂(Compound C,简称CC)来抑制AMPK的活性,发现加入15 μM CC后具有较好的抑制作用,差异有统计学意义(P< 0.05,见图4A)。然后在三因子诱导的A1星胶和二甲双胍处理A1型星胶中,加入15 μM CC处理(见图4B),结果提示,抑制AMPK活性后,STAT3的活性升高,同时C3表达也升高,差异有统计学意义(P<0.05,见图4C)。上述结果表明,二甲双胍通过AMPK信号通路抑制A1型星形胶质细胞的反应性。
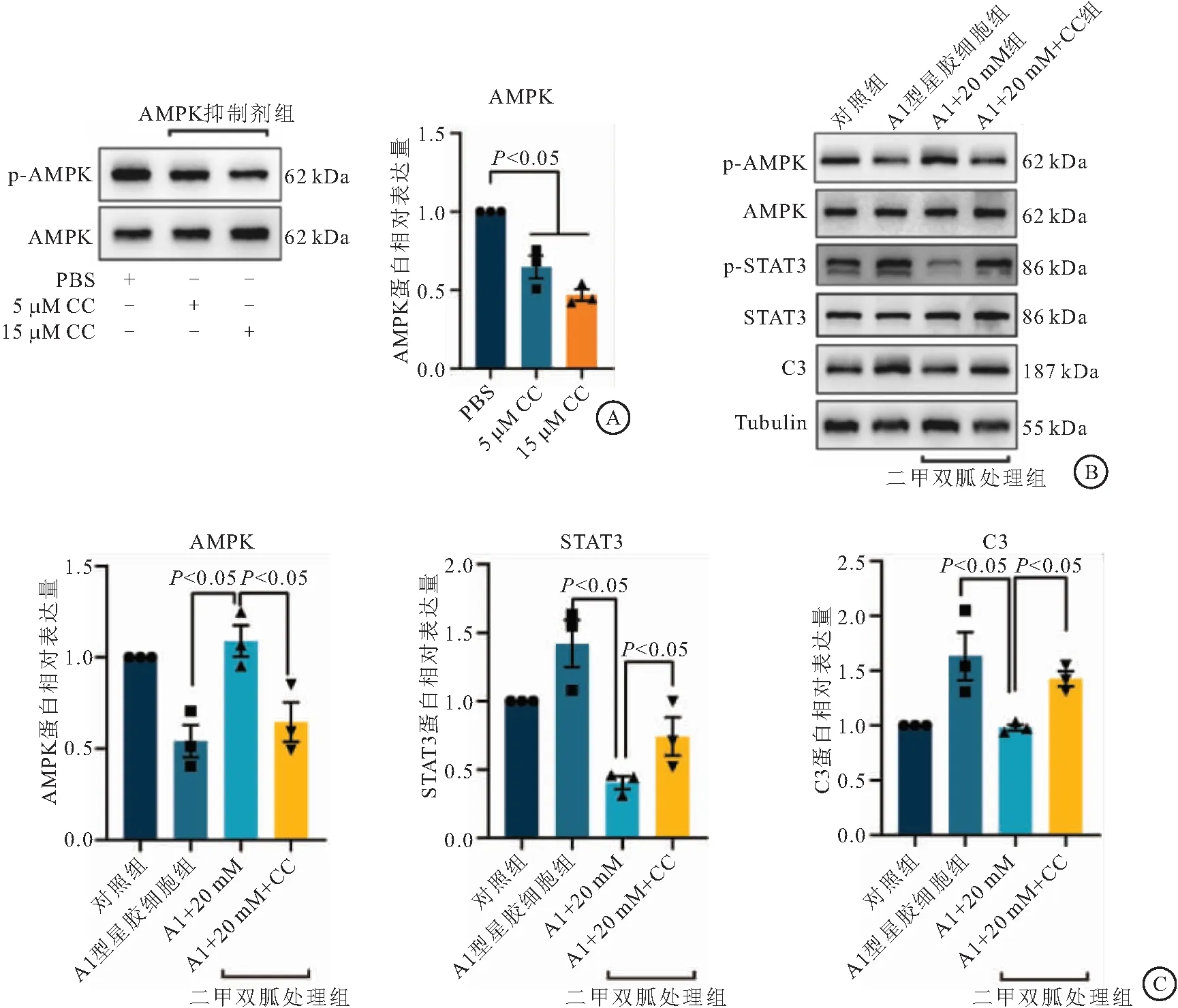
图4 二甲双胍通过AMPK/STAT3信号途径抑制A1型反应性星形胶质细胞Figure 4 Metformin inhibits type A1 reactive astrocytes through AMPK/STAT3 signaling pathway注:A.不同浓度Compound C对AMPK的抑制作用;B.二甲双胍和Compound C处理星形胶质细胞后AMPK、STAT3和C3的蛋白表达;C.二甲双胍和Compound C处理星形胶质细胞后蛋白表达的统计。
3 讨论
星形胶质细胞是中枢神经系统中最多的神经胶质细胞,随着研究进展,星形胶质细胞越来越被认为在大脑和脊髓中都具有关键功能。在生理条件下,星形胶质细胞主要参与维持中枢神经系统稳态相关的多种功能,包括血脑屏障 (bLOOD BRAIN BARRIER,BBB) 和血脊髓屏障(Blood spinal cord barrier,BSCB) 的形成和维持、跨突触的信号传递、维持神经元功能和代谢调节[20]。然而,在病理背景下,星形胶质细胞会被激活,这些细胞的终生适应性、可塑性和疾病背景下的复杂性决定了损伤后星形胶质细胞亚群的多样性[21]。2017 年,Liddelow 等[5]发现了他们命名为 A1 型星形胶质细胞具有神经毒性,其神经毒性作用已在多种中枢神经系统疾病中得到证实[22, 23-24]。研究[25-27]表明,脊髓损伤后,A1型反应性星形胶质细胞增多,抑制A1型反应性胶质细胞的活化可以促进脊髓损伤后的功能恢复。因此,通过药物、基因调控等手段抑制A1型反应性星形胶质细胞的活化可能是治疗脊髓损伤一个有效的方向。
二甲双胍是用于治疗Ⅱ型糖尿病的降糖药,且已用于各个方面的实验性研究,如生殖医学、肿瘤化疗、代谢性疾病[28]并且对多种不同病因的神经系统疾病动物模型具有保护作用[29]。最近,Song等[13]发现二甲双胍可以促进小鼠脊髓损伤后后肢运动功能恢复,目前,其对神经系统的研究主要在神经元和小胶质细胞中探讨其可能的作用[16, 18],在脊髓损伤后对星形胶质细胞反应性方面还未曾见报道。AMPK作为调控能量稳态的重要激酶,是真核生物细胞和有机体代谢的中心调节剂之一,负责监管细胞的能力输入和输出,维持细胞生理活动的平稳运转。Zhang 等[30]发现,miR-299a-5p通过激活AMPK通路对脊髓损伤有保护作用。Hu等[31]表明锌通过激活AMPK途径来调节脊髓和神经元的葡萄糖代谢,进而促进脊髓损伤后的功能恢复。本研究结果发现,在星形胶质细胞中加入不同浓度二甲双胍后P-AMPK表达升高,同时抑制P-STAT3的表达,且呈浓度依赖性。已有文献[14]表明,二甲双胍的主要作用靶点是AMPK,而活化的AMPK可以起到神经保护作用。STAT3是反应性星形胶质细胞中一个重要的转录因子,研究[32]表明AMPK可以负性调节STAT3的磷酸化。
有研究报[5,27]道通过三因子(TNF-α、IL-1α、C1q)可以诱导星形胶质细胞反应性,然而对于体外培养的大鼠脊髓星形胶质细胞往A1型反应性星胶诱导的模型尚未有明确文献。本研究通过三因子处理原代培养的脊髓星形胶质细胞,发现A1星形胶质细胞的标志分子C3的转录水平在24 h已有明显升高,而在72 h增加了数千倍,蛋白水平有显著升高,表明成功建立了体外A1星形胶质细胞反应性模型。进而在此模型中,研究了二甲双胍对星形胶质细胞活化的影响,发现不同浓度的二甲双胍可以明显减少A1型标记物C3的表达且呈现浓度依赖性。脊髓损伤后,小胶质细胞激活产生三因子等细胞因子进而活化星形胶质细胞[25],由于二甲双胍具有抗炎作用,我们首先检测了NF-κB信号通路,结果显示二甲双胍处理A1型星胶后,其NF-κB的磷酸化水平未发生明显改变(数据未显示)。本研究检测了AMPK/STAT3通路,结果显示二甲双胍可以升高AMPK的磷酸化,降低STAT3的磷酸化水平;进一步地通过AMPK的特异性抑制剂,发现二甲双胍激活AMPK是其作用于星形胶质细胞反应性的信号通路。
4 结论
本研究结果表明,二甲双胍可以通过AMPK/STAT3信号途径抑制星形胶质细胞A1型反应性,为二甲双胍治疗脊髓损伤提供参考。
