微滴式数字PCR定量检测禽脑脊髓炎病毒方法的建立
2023-07-07谢志勤谢芝勋张艳芳谢丽基万丽军罗思思张民秀曾婷婷黄娇玲李小凤任红玉阮志华
谢志勤,谢芝勋,张艳芳,范 晴,谢丽基,万丽军,罗思思,李 孟,张民秀,曾婷婷,黄娇玲,王 盛,李 丹,韦 悠,李小凤,任红玉,阮志华
(广西壮族自治区兽医研究所 广西兽医生物技术重点实验室 农业农村部中国-东盟(广西)跨境动物疫病防控重点实验室,广西 南宁 530001)
禽脑脊髓炎病毒(avian encephalomyelitis virus,AEV) 是引起鸡发生急性、高度接触性传染病的一种常见病原之一,该病毒除感染鸡外,还会引起雉鸡、鹌鹑和火鸡等禽类致病[1]。AEV对鸡危害严重,尤其是雏鸡,1~7日龄的雏鸡感染后,病毒主要侵害雏鸡的中枢神经系统,初期引起雏鸡出现震颤、运动失调等症状,故又被称为流行性震颤。随着病情加重,雏鸡开始行走不便,食欲减退,最后因衰竭而死亡,死亡率高达25%。AEV感染产蛋鸡及种鸡,虽没有表现出明显的神经和运动失调等症状,引起的死亡率也低,但对产蛋鸡及种鸡的产蛋量产生严重影响,使产蛋鸡产蛋量突然下降5%~10%[2-3]。更为严重的是产蛋鸡或种鸡感染AEV后可以成为隐性带毒者,对鸡造成持续感染或潜伏危害,病毒不但可以经种蛋垂直传播,导致鸡胚孵化率、出壳率下降[4],还造成防控困难。有效防控AEV的关键是早诊断及早预防,实验室方法如病毒分离鉴定[5]、PCR[6]、荧光PCR[7-9]、LAMP[10]等是诊断AEV的最准确方法,但这些方法或多或少都存在一些不足或检测局限,尤其是对隐性带毒及感染早期的鸡中AEV载量低时的检测,尚没有很好的方法。
近年来,随着微滴式数字PCR(droplet digital PCR,ddPCR)技术的不断发展与完善,使得该技术在很多领域迅速得到应用[11-13]。其技术方法是将反应液通过油包水方式分为独立的数万个纳米反应微滴,根据每个反应微滴信号逐个统计带荧光(阳性)与未带荧光(阴性)微滴个数与比例,并自动计算出核酸(阳性模板)的微滴数(拷贝数)来实现对核酸的绝对定量,结果更为直观准确。由于ddPCR具有特异、敏感和准确定量的特点,对AEV隐性感染及感染早期的准确检测成为可能。
本研究采用AEV VP1基因为靶基因,通过在靶基因保守序列中设计引物和探针,并应用合成的引物和探针研究建立ddPCR检测AEV的方法,旨在为检测诊断AEV提供更加准确的技术,为有效防控AEV提供技术支撑。
1 材料与方法
1.1 毒株AEV Van株和AEV 19株、禽偏肺病毒(acian metapneumovirus,aMPV)MN-10株由美国康涅狄格州大学MAZHAR I.KHAN教授惠赠;鸡传染性喉气管炎病毒(avian infectious laryngotracheitis virus,ILTV)BJ株购自中国兽医药品监察所;鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)Mass 41株、禽呼肠孤病毒(avian reovirus,ARV) S1133株、鸡新城疫病毒(Newcastle disease virus,NDV)LaSota株、H9N2亚型禽流感病毒(H9N2 subtype avian influenza virus,H9N2 AIV)066C株均由本实验室保存;65份病鸡脑样品分别于2020年1-12月从广西5个鸡场中采集,保存于-70℃。
1.2 主要试剂Supermix for Probe ddPCR(No dUTP,Lot:1863024)、Droplet Generation Oil for Probes ddPCR(Lot:1863005)、Droplet Reader Oil(Lot:1863004)、DG8 Cartridges(Lot:1863008)、DG8 gaskets(Lot:1863009)、Pierceable Foil Heat Seal(Lot:1814040)购自美国Bio-rad公司;EasyPure Virual DNA/RNA Kit(Lot:N20527)、Gel Extration Kit(Lot:L41118)购自北京全式金生物技术有限公司;RT-PCR(PCR)扩增试剂盒、100bp DNA Ladder、pMD18-T、大肠杆菌DH5α、T4连接试剂盒、凝胶回收试剂盒购自宝生物工程(大连)有限公司。
1.3 主要仪器微滴生成仪(QX200 Droplet Generator)、热封仪(PX1)、微滴数字读取仪(QX200 Droplet Reader)、梯度PCR扩增仪(T-100)购自美国Bio-rad公司;荧光 PCR 仪(quantStudio 5)、分光光度计(Nanodrop 2000)购自美国Thermo Fisher Scientific公司。
1.4 引物设计与合成根据GenBank中已发表的AEV VP1 基因序列(No.JQ894852.1),利用在线(https://bioinfo.ut.ee/primer3-0.4.0/)软件设计ddPCR特异性引物和探针,并在线对设计的引物和探针序列进行BLAST分析。在探针序列的5′端添加FAM荧光基团,3′端添加BHQ1淬灭基团。引物和探针由生工生物工程(上海)股份有限公司合成并进行HPLC纯化,引物和探针序列见表1。
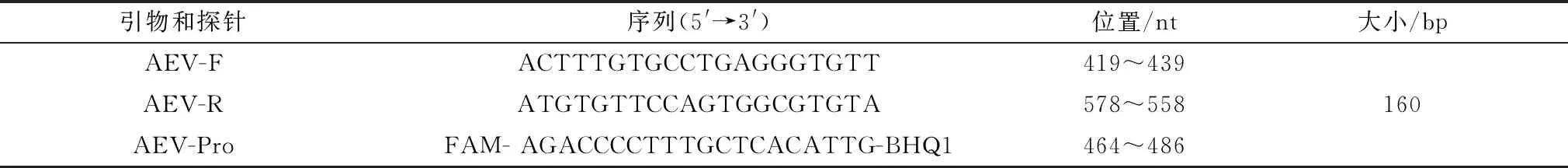
表1 引物和探针寡核苷酸序列
1.5 重组质粒标准模板的构建与鉴定将提取的AEV Van株RNA反转录成cDNA作为模板,然后用设计的引物APV-F/APV-R进行扩增后,将大小约160 bp条带的电泳凝胶切下并回收纯化,与pMD18-T载体连接并转染至大肠杆菌DH5α,构建重组质粒pMD18-AEV。重组质粒经PCR鉴定后送宝生物工程(大连)有限公司进行序列测定,序列正确的重组质粒经DNA用分光光度仪测定D260 nm/D280 nm的值,并按公式计算拷贝数。拷贝数=(浓度×阿伏加德罗常数)/(1个碱基对的平均分子质量×总长度)。
1.6 ddPCR反应的建立及条件优化20 μL反应体系:2×Supermix 10 μL,5.0~40.0 μmol/L的AEV-F/AEV-R引物各1 μL,2.5~40.0 μmol/L的AEV-Pro 1 μL,重组质粒经DNA 1 μL,加灭菌ddH2O补足至20 μL。微滴生成:在DG8 Cartridges的第2排孔分别加入上述反应液20 μL,第3排孔每孔加入Droplet Generation Oil 70 μL,盖上DG8 gasket,置微滴生成仪上自动生成微滴于第1排孔。封膜:吸取生成的微滴至96孔板内,加铝膜Pierceable Foil Heat Seal置PX1热封仪上,程序设置为180℃ 10 s进行封膜。PCR扩增:封膜的96孔板放入PCR扩增仪上进行扩增,设计反应程序:95℃ 10 min;94℃ 30 s,退火温度设置54~61℃ 1 min(2℃/s),共进行40个循环;98℃ 10 min,4℃结束。数据读取及分析:反应结束后将96孔板置QX200 Droplet Reader上读取信号并进行数据分析。
1.7 ddPCR特异性测定按EasyPure Virual DNA/RNA试剂盒说明书方法,提取AEV Van、AEV19以及H9N2 AIV、IBV、ARV、NDV、APV的RNA后反转录为cDNA。提取ILTV的DNA,然后分别加入已优化好的ddPCR反应体系中进行特异性检测。
1.8 ddPCR灵敏性及重复性测定测定重组质粒DNA的浓度并作10倍递减稀释,取10-4~10-11共8个连续稀释的重组质粒DNA作为模板加入到已优化的ddPCR反应中,以验证ddPCR反应的灵敏性。用同样的引物和探针对相同重组质粒DNA的浓度进行荧光定量PCR平行检测,比较2种方法的反应灵敏性。取10-5~10-8共4个连续稀释的重组质粒DNA进行4次平行试验,分析ddPCR检测的线性区间。取10-5~10-7共3个连续稀释的重组质粒DNA进行3次重复试验,以检测ddPCR的重复性,分析检测结果的变异情况。
1.9 临床样品检测取约5 g脑样品按1∶8加入无血清的MDEM培养基进行研磨,-70℃反复冻融3次,4 000 r/min离心5 min,取上清200 μL,按EasyPure Virual DNA/RNA Kit说明提取样品的核酸,用建立的ddPCR方法进行检测;同时引用文献[9]中荧光定量PCR方法进行检测,比较2种检测方法的检测效果和符合率。
2 结果
2.1 重组质粒标准模板的鉴定结果重组质粒pMD18-AEV经PCR扩增鉴定,结果扩增出大小约160 bp的明亮条带。重组质粒pMD18-AEV送宝生物工程(大连)有限公司进行序列测定,测定的序列用MegAlign软件与AEV VP1基因(No.JQ894852.1)序列进行Clustal W Method分析,分析结果为测定的序列与AEV VP1基因100%同源,证明插入片段序列正确。用分光光度仪测定重组质粒pMD18-AEV的D260 nm/D280 nm值为1.95,经计算质粒质量浓度为0.107 g/L,按公式计算拷贝数为6.1×108拷贝/μL。
2.2 ddPCR 反应退火温度的优化ddPCR反应中,采用20 μmol/L的AEV-F/AEV-R引物浓度和10 μmol/L的AEV Pro浓度各1 μL(终浓度分别为1.0,0.5 μmol/L),加入模板浓度约为610拷贝/μL时,退火温度设置为54,55,56,57,58,59,60,61℃共8个不同梯度进行ddPCR反应扩增,结果退火温度为58℃时,阳性微滴信号(显示为蓝色)和阴性微滴信号(显示为黑色)之间的荧光信号区分明显,扩增获得的阳性微滴数最高,为605拷贝/μL,综合这些因素,确定最佳扩增的退火温度为58℃。
2.3 ddPCR 反应引物及探针浓度的优化ddPCR反应中对不同的引物浓度和探针浓度进行优化,结果当引物AEV-F/AEV-R的终浓度分别为1.0 μmol/L,探针AEV-Pro的终浓度为0.5 μmol/L时,检测到的阳性微滴信号最高,且阳性微滴与阴性微滴之间的荧光信号区分明显。此时的引物和探针终浓度被确定为最佳的引物和探针浓度。
2.4 ddPCR 反应的建立及反应程序根据优化结果,ddPCR反应体系为20 μL,包含:2×Supermix10 μL,20 μmol/L AEV-F/AEV-R引物各1 μL(终浓度为1 μmol/L),10 μmol/L AEV-Pro 1 μL(终浓度为0.5 μmol/L),模板DNA/RNA 1 μL,用ddH2O补足至20 μL。反应程序:95℃ 10 min;94℃ 30 s,设置退火温度58℃ 1 min(2℃/s),40个循环;98℃ 10 min,4℃结束。
2.5 ddPCR反应特异性测试结果提取AEV Van、19以及H9N2 AIV、IBV、ARV、NDV、APV的RNA后反转录为cDNA,提取ILTV的DNA,然后分别加入已优化好的ddPCR反应体系中进行特异性检测,结果各孔扩增生成的总微滴数(包括阳性和阴性微滴)均达10 000以上,且较均衡,微滴扩增条件成立,出现阳性微滴的样品只有AEV Van和AEV19,对照的H9N2 AIV、IBV、ARV、NDV、APV、ILTV没有出现阳性微滴,且与AEV也没有出现交叉反应,结果表明特异性强(图1)。

1.AEV Van;2.AEV19;3.H9N2 AIV;4.IBV;5.ARV;6.NDV;7.APV;8.ILTV
2.6 ddPCR灵敏性测定结果取10-4~10-11共8个连续稀释的pMD18-AEV重组质粒DNA各1 μL作为模板,分别按照优化的ddPCR和荧光定量PCR检测,结果显示,ddPCR对重组质粒DNA的最低检测限为5.9拷贝/μL(10-8稀释),而荧光定量PCR只检测出10-7稀释的质粒标准品(61.4拷贝/μL),结果见图2,3。结果表明,本方法建立的ddPCR检测敏感性比荧光定量PCR高10倍,敏感性较高。用10-5~10-8共4个连续稀释的pMD18-AEV重组质粒DNA进行ddPCR检测,检测结果的拷贝数在5.9~6 150.0拷贝/μL之间,用检测结果的阳性拷贝数对数值与对应稀释的拷贝数的对数值绘制的绝对定量曲线,线性方程为y=-0.97x+8.68,结果为线性。由图4可知,R2值为0.999 4,斜率为-0.97x,表明检测结果稳定、可靠。

1~8.10-4~10-11 pMD18-AEV DNA

1~8.10-4~10-11 pMD18-AEV DNA
2.7 临床样品的检测结果对65份鸡脑病料样品的检测,ddPCR检测结果有3份样品为AEV阳性,检测拷贝数为120,135,246拷贝/μL,62份样品为AEV阴性,阳性检出率为4.62%(3/65),与qPCR检测的结果一致。部分样品检测结果见图5,表2。
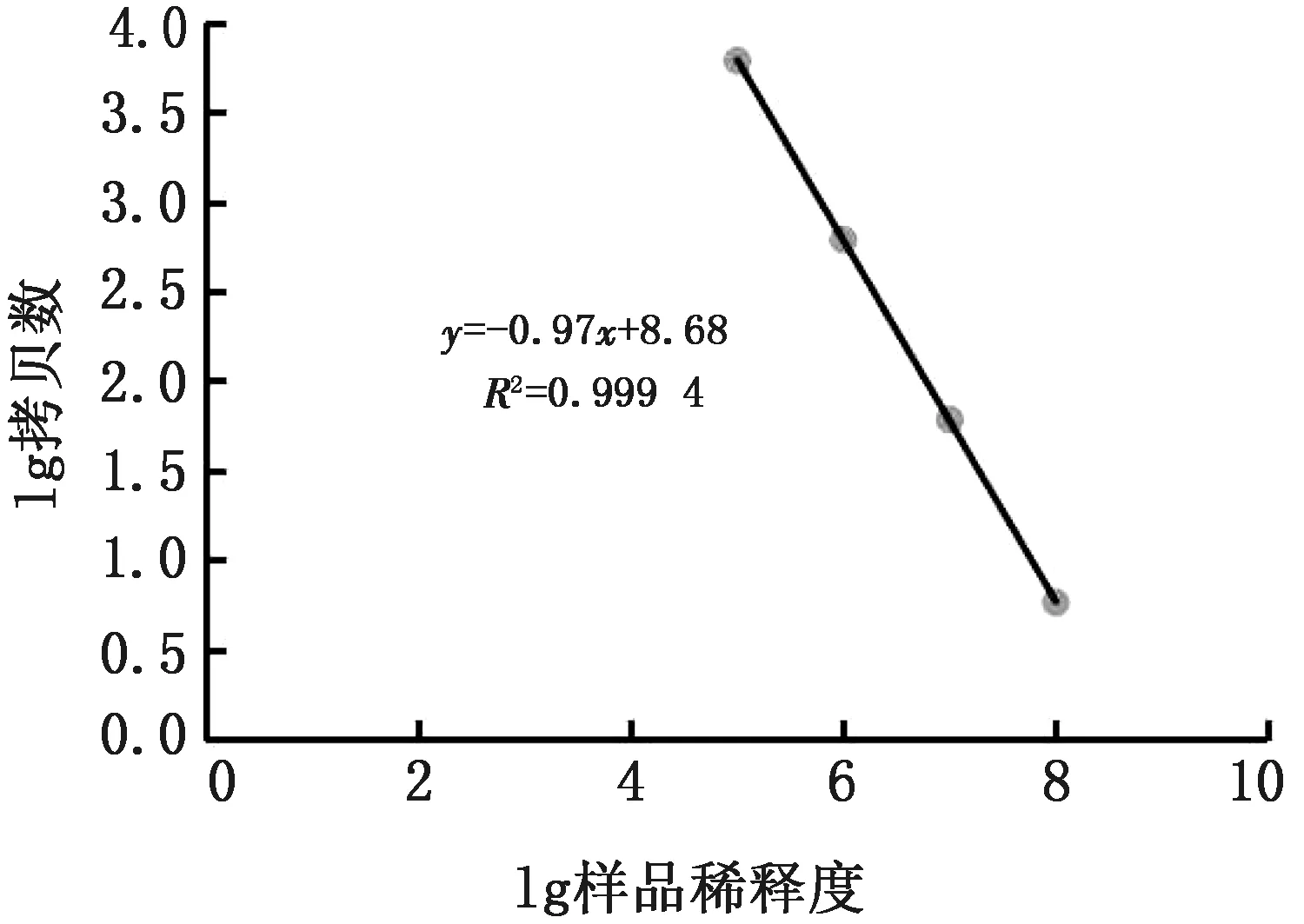
图4 AEV ddPCR标准曲线

1.pMD18-AEV重组质粒(阳性对照);2.SPF鸡脑样品(阴性对照);3.脑样品3(+);4.脑样品5(-);5.脑样品16(+);6.脑样品18(-); 7.脑样品31(+);8.脑样品35(-);9.脑样品38(-);10.脑样品40(-);11.脑样品42(-);12.脑样品45(-);13.脑样品48(-);14.脑样品50(-);15.脑样品55(-);16.脑样品65(-)
3 讨论
AEV感染可引起包括鸡、雉鸡、鹌鹑和火鸡等家禽致病,特别是对1周龄以内的雏鸡危害特别严重,除了引发雏鸡出现震颤、运动失调等症状外,严重时还会导致雏鸡大批死亡。AEV感染产蛋鸡和种鸡时虽不会引起大批死亡,但也会导致产蛋量下降,种胚孵化率降低。及时准确诊断是防控AEV的关键手段之一,常规的实验室诊断方法如原分离鉴定诊断周期长、技术要求高而达不到快速诊断的目的。普通PCR方法较分离鉴定具有较好的特异性和敏感性,但也不够敏感,存在漏检现象。荧光定量PCR方法比普通PCR方法敏感性高,但对一些病毒载量较低如感染早期或隐性感染时期的样品,也存在检测的局限性而检测不到病原,且不能进行绝对定量。在这种情况下,需要找到一种更敏感的检测方法才能满足临床样品检测的要求。本研究建立的ddPCR检测AEV方法,是在AEV VP1基因序列上设计引物和探针,通过对引物探针浓度及反应条件等进行优化后而建立的一种方法,经特异性检测验证,本方法只检出AEV,没有检出常见的多种禽病病原,且与禽病病原无交叉反应,特异性好。灵敏性检测表明最低检测限为5.9拷贝/μL,ddPCR方法比荧光定量PCR方法灵敏性高10倍,与刘洋等[14]报道的ddPCR方法比荧光定量PCR方法灵敏10倍的结果一致,敏感性好。因此,本方法的建立及应用,对AEV的及早诊断,及早做好相应预防,降低由AEV感染引起的发病率和死亡率均有重要意义。
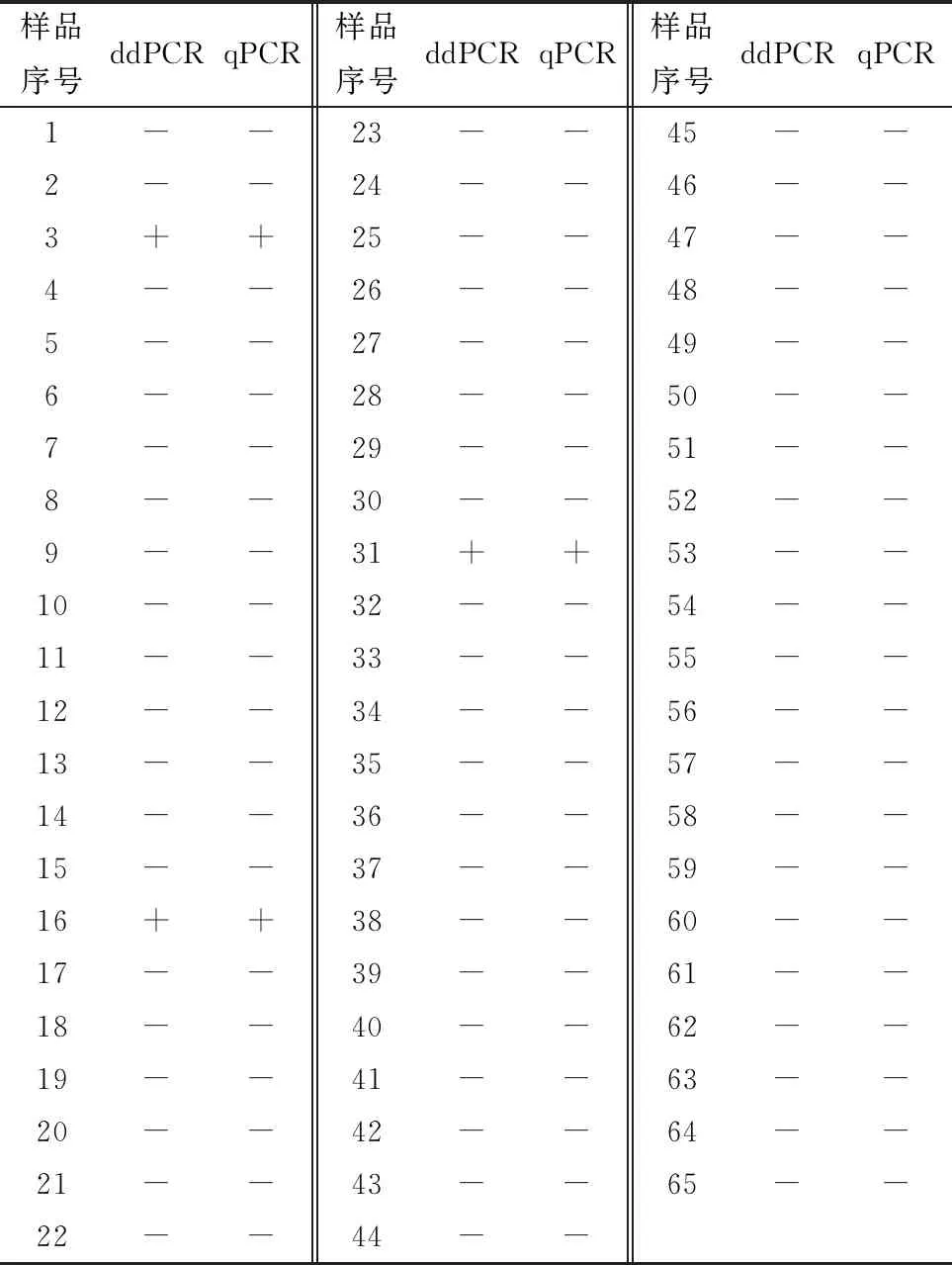
表2 65份临床样品检测结果
本研究中引物和探针浓度是直接影响敏感性检测的关键因素,为了获得更好和更敏感的扩增效果,需要对引物和探针浓度进行优化。经优化发现引物终浓度为1.0 μmol/L,探针终浓度为0.5 μmol/L的情况下,即引物与探针浓度比为2∶1时,ddPCR扩增反应获得的AEV阳性微滴信号(蓝色)最高,且阳性微滴与阴性微滴之间区分明显,反应具有最低的负荧光幅度,敏感性也高。同时,该方法通过对4个连续稀释的pMD18-AEV重组质粒DNA进行检测,用检测结果的阳性拷贝数对数值与对应稀释的拷贝数的对数值绘制的绝对定量曲线,结果为线性。进一步说明本研究建立的方法稳定好,结果可靠,为ddPCR方法的临床应用提供可靠技术。
ddPCR方法从出现至今,由于其具有较高的灵敏性和绝对定量,使得该技术在各领域得到广泛应用与发展,在动物疫病检测方面已发挥了重要作用[15-17]。目前制约该技术应用发展的主要问题是仪器设备及试剂昂贵,随着技术的进步以及ddPCR仪器、试剂国产化的普及,相信在不久的将来,检测成本有望大幅度降低,操作也会进一步简单化。
综上所述,本方法具有特异性好、灵敏性高和绝对定量的特点,能满足临床对病毒载量较低的样品的检测,为及时准确绝对定量检测AEV提供技术支撑,对有效防控AEV感染有重要现实意义。
