羊干扰素α和γ融合表达及抗病毒活性分析
2023-07-07李秀丽豆子航郭笑然雷白时袁万哲
韩 颖,李秀丽,豆子航,郭笑然,雷白时,袁万哲,2*,赵 款,2*
(1.河北农业大学 动物医学院,河北 保定 071001;2.河北省兽医生物技术工程技术创新中心 ,河北 保定 071001)
在养殖业中,抗生素被滥用,导致动物源性食品以及地表生态受到严重的污染[1-2],因此急需一些新的绿色环保药物,使动物源性食品维持绿色健康水平。目前,中国羊养殖行业在逐渐向规模化、集约化的养殖模式发展,多种疾病需要进行防治[3]。
干扰素(IFN)作为一种具有抗病毒、免疫调节、抗肿瘤功能且无残留、无毒性、无副作用的新型生物制品,在1957年被英国科学家发现,随后被广泛研究和应用[4-5]。根据IFN识别受体的不同分为3种类型:Ⅰ型IFN、Ⅱ型IFN、Ⅲ型IFN;根据种属不同分为不同的亚型,例如:已知人IFN-α有23个以上的亚型,分别以IFN-α1、IFN-α2等表示[6]。绵羊IFN分为3型,目前研究最多的为OviIFN-α、OviIFN-τ和OviIFN-γ以及OviIFN-λ。OviIFN-α和OviIFN-τ属于Ⅰ型IFN;OviIFN-γ属于Ⅱ型IFN;OviIFN-λ属于Ⅲ型IFN[7]。IFN的抗病毒功能不是由IFN直接作用于病毒,是IFN与细胞上相应的受体结合引起的IFN级联反应所转录的ISGs发挥抗病毒作用[8]。以Ⅰ型IFN为例,胞外IFN与细胞表面具有高亲和力的IFN受体(IFNAR1)结合,然后与低亲和力IFN受体(IFNAR2)形成受体二聚体,受体构象发生改变,形成有活性的三元复合物,引起与受体相关的JAK激酶招募与活化。被激活的JAK激酶催化受体上的酪氨酸残基发生磷酸化,使信号转导因子发生磷酸化。被磷酸化的信号转导蛋白(STAT1、STAT2)脱离受体,在胞浆中形成二聚体,与IFN调节因子9(IRF9)结合,形成激活的异源三聚体转录因子复合物(ISGF3),转移到细胞核中与IFN刺激基因上游启动子区域的IFN刺激基因反应元件结合(ISRE)刺激ISGs的转录,起到抗病毒功能[9-10]。研究比较广泛的ISGs是OAS、ISG15、Mx、IFITM1[11-14]。
不同的IFN激活的ISGs种类不同,产生的抗病毒效应亦不同,研究发现Ⅰ和Ⅱ型IFN的联合使用对多种病毒感染具有较好的治疗效果[15],体现了一定的协同抗病毒效应[16-17]。因此,本研究拟对羊OviIFN-α和OviIFN-γ基因进行融合表达,以获得具有叠加效应的抗病毒活性的IFN制剂。本试验用柔性连接臂(Linker:GGTGGTGGTTCTGGTGGTGGT)将OviIFN-α和OviIFN-γ序列连接构建到原核表达载体pET28a进行表达,重组蛋白rOviIFN-α、rOviIFN-γ和rOviIFN-α/γ纯化后用于抗病毒活性检测,并互相进行比较分析,为重组蛋白生产工业化提供了经验[18]。
1 材料与方法
1.1 细胞、病毒及主要试剂BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;DMEM培养基、胎牛血清(FBS)购于美国Gibco公司;非洲绿猴肾细胞(Vero)、牛肾细胞(MDBK)、水疱性口炎病毒(VSV)由中国农业科学院上海兽医研究所惠赠。
1.2 重组羊IFN基因的合成参照GenBank登录的OviIFN-α序列(登录号:X59067.1)和OviIFN-γ基因序列(登录号:NM_001009803.1),使用Codon Adaptation tool(http://www.jcat.de/)进行密码子优化以及信号肽序列去除 (http://www.cbs.dtu.dk/services/SignalP-5.0/)。在pET32a载体中选择酶切位点BamHⅠ和XhoⅠ插入目的序列,由生工生物工程(上海)股份有限公司合成重组质粒。OviIFN-α F/R:CGCGGATCCTGCGACCTGTCTCAGA/CCGCTCGAGCGGAGAAGACAGGTCA;OviIFN-γ F/R:CGCGGATCCCAGGGTCCGTT-CTTCA/CCGCTCGAGCATA GAAGCACGACG-A。 引物由生工生物工程(上海)股份有限公司合成,引物序列见表1[19-20]。Linker序列:5′-GGTGGTGGTTCTGGTGGTGGT-3′。
1.3 重组质粒的构建及诱导表达用OviIFN-α F和OviIFN-γ R引物将OviIFN-γ/α序列进行扩增,用OviIFN-α F和OviIFN-α R引物将OviIFN-α序列进行扩增,用OviIFN-γ F和OviIFN-γ R引物将OviIFN-γ序列进行扩增,后进行胶回收。将胶回收产物以及pET28a载体用BamHⅠ和XhoⅠ内切酶进行酶切,将酶切后的产物以及线性载体进行酶连。构建pET28a-OviIFN-γ、pET28a-OviIFN-α、pET-28a-OviIFN-γ/α 3种重组质粒。将重组质粒转入DH5α感受态并进行鉴定,将阳性菌转化到大肠杆菌BL21中。鉴定后进行扩大培养,按体积比1∶100接种到新的LB中(含K+),37℃、200 r/min振荡培养,待D600为0.4~0.6时,加入终浓度1.0 mmol/L 的IPTG,诱导4 h,离心收集菌体,超声波破碎(360 W、30%、10 min)2次后,分离上清液和沉淀,制备样品,进行SGS-PAGE检测,对目的蛋白可溶性进行分析。
1.4 包涵体的纯化、复性以及Western blot鉴定收集诱导表达后的菌体,超声裂解后收集沉淀,沉淀用含2 mol/L尿素的洗涤液洗涤2次,然后将沉淀用10 mL 含8 mol/L尿素的变性液重悬,置冰上2 h直到包涵体溶解。4℃ 10 000r/min离心20 min收集上清,于-80℃保存备用。用His标签蛋白纯化试剂盒纯化蛋白,按说明书进行操作。使用羊抗鼠试剂盒进行Western blot试验。将已经纯化复性好的重组蛋白稀释至1 g/L放置-80℃保存备用。
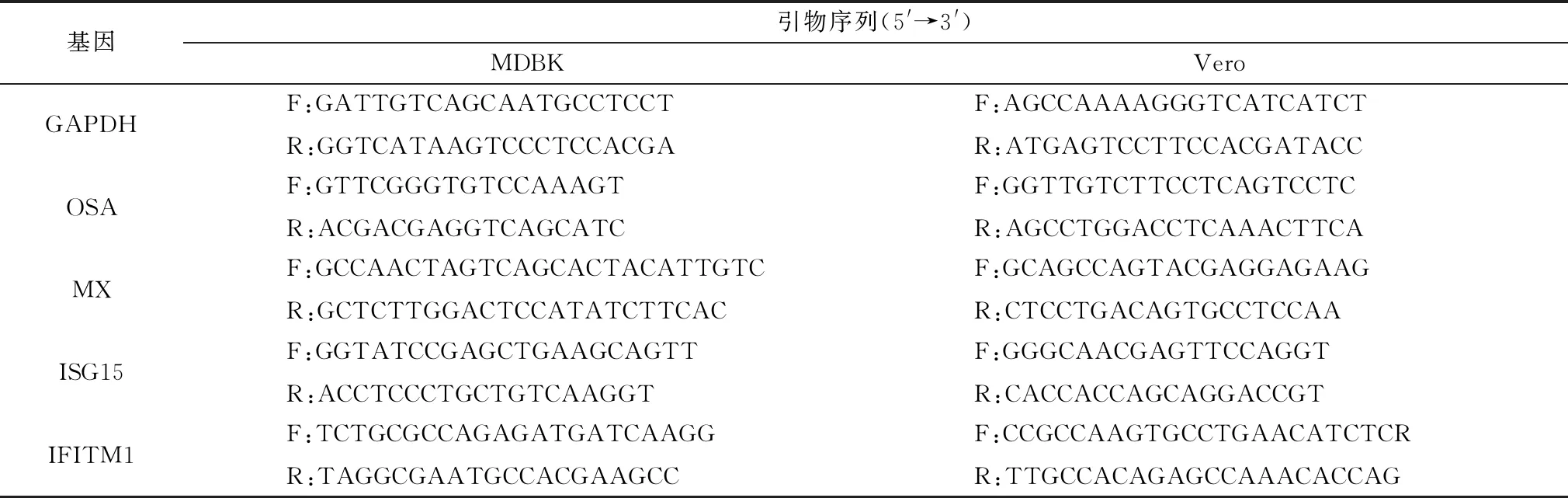
表1 RT-qPCR引物
1.5 重组蛋白抗病毒活性测定将Vero、MDBK细胞于96孔板中培养至单层,弃去培养液,分别取300 μL制备好的3种重组蛋白用900 μL含2%FBS的DMEM营养液进行4-1~4-9倍比稀释,每个梯度8个复孔。弃去培养液,每个梯度取100 μL加至96孔板中,于37℃、5% CO2的细胞培养箱中孵育48 h。使用细胞病变抑制法进行测定。在单层细胞上加入用2%FBS的DMEM营养液稀释至100 TCID50的VSV病毒液100 μL,VSV病毒效价为1×107.45TCID50/mL。设置阴性对照组,于37℃、5% CO2的细胞培养箱中培养,逐日观察病变孔数,并通过Reed-Muench法计算重组蛋白的抗病毒活性。
1.6 IFN刺激基因转录的水平测定使用能够完全抑制VSV感染的重组蛋白浓度对MDBK、Vero进行孵育,于6,12,24,48 h收集细胞,采用TRIzol抽提细胞总RNA,将总RNA样品反转录得到cDNA。根据NCBI中的基因序列信息,引用参考文献中的OAS、IFIT5、Mx、IFITM1特异性引物,选用Gapdh作为内参基因。引物序列见表1。RT-qPCR反应体系20 μL:2×Ague Green qPCR Master Mix 10 μL,上、下游引物各1 μL,cDNA模板1 μL,ddH2O 7 μL。反应程序:95℃预变性5 min;95℃变性20 s,58℃退火20 s,72℃延伸20 s,45个循环;进行熔解曲线分析,95℃ 10 s,65℃ 60 s,97℃ 1 s。
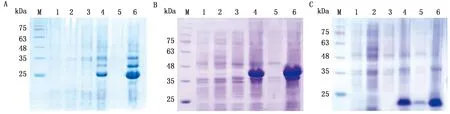
1.7 数据的统计与分析通过RT-qPCR检测后,数据处理采用2-△△Ct法计算。通过IBM SPSS Statistics 26.0软件,采用t检验进行统计学分析,以*0.01 2.1 OviIFN-γ/α、OviIFN-α和OviIFN-γ重组质粒的构建利用常规PCR,扩增含有OviIFN-γ/α成熟肽基因的975 bp片段,含有OviIFN-α成熟肽基因的534 bp片段,含有OviIFN-γ成熟肽基因的447 bp片段。将上述PCR扩增产物使用通用引物进行电泳检测,大小与预期相一致。将片段OviIFN-γ/α、OviIFN-α和OviIFN-γ经BamHⅠ和XhoⅠ双酶切后亚克隆至线性化载体pET28a,构建pET28a-OviIFN-γ、pET28a-OviIFN-α和pET28a-OviIFN-γ/α,克隆测序结果显示所构建的3个重组质粒基因序列与设想完全相符,编码框正确,说明成功构建了pET28a-OviIFN-γ、pET28a-OviIFN-α和pET28a-OviIFN-γ/α(图1)。 2.2 包涵体的纯化及复性构建成功的pET28a-OviIFN-γ、pET28a-OviIFN-α和pET28a-OviIFN-γ/α重组质粒,原核表达后进行SDS-PAGE分析表达情况,结果显示(图2),3种融合基因在大肠杆菌中都能高效表达,rOviIFN-γ/α、rOviIFN-α和rOviIFN-γ重组蛋白大小为43,26,20 kDa,而诱导的空载体pET28a对照则没有相应条带。在当前未进行发酵条件和培养基配方优化的条件下,同样在1 L发酵液(LB培养基)中经过分离纯化后可分别获得rOviIFN-γ/α 50 mg、rOviIFN-α 40 mg、rOviIFN-γ 40 mg。获得融合蛋白rOviIFN-γ/α、rOviIFN-α和rOviIFN-γ的包涵体溶液,稀释复性后采用NanoDrop2000 测定浓度,置于-20℃ 保存。 2.3 纯化蛋白表达结果以及蛋白的Western blot检测如图3所示,SDS-PAGE结果表明,重组蛋白经过镍柱纯化后,rOviIFN-γ/α、rOviIFN-α和rOviIFN-γ在43,26,20 kDa出现明显单一的目的蛋白条带,说明已成功纯化出目的蛋白且没有杂带。rOviIFN-γ/α的表达量明显高于rOviIFN-α和rOviIFN-γ,经过Western blot检测,有明显的目的条带。 M.DL2000 DNA Marker;1.pET28a-OviIFN-γ/α;2.pET28a-OviIFN-α;3.pET28a-OviIFN-γ A.OviIFN-α;B.OviIFN-γ/α;C.OviIFN-γ。M.蛋白Marker;1~6.pET-28a空载未诱导、pET-28a空载诱导、全菌未诱导、沉淀、上清、全菌诱导 A.复性蛋白表达结果;B.复性蛋白的Western blot检测。M.蛋白Marker;1.pET28a-OviIFN-α;2.pET28a-OviIFN-γ/α;3.pET28a-OviIFN-γ;4.pET28a-OviIFN-α;5.pET28a-OviIFN-γ/α;6.pET28a-OviIFN-γ 2.4 重组蛋白活性检测应用MDBK/VSV、Vero/VSV系统和细胞病变抑制法测定rOviIFN-γ/α、rOviIFN-α和rOviIFN-γ的活性,以50%细胞病变保护率的最大稀释度为1单位(U),根据Reed-Muench法计算各种IFN的效价(表2)。检测结果表明,3种重组IFN与一种联合用药方法均表现出显著的抗病毒活性,能有效抑制VSV对MDBK或Vero细胞的致病作用。通过结果显示抗病毒活性依次是: rOviIFN-γ/α>rOviIFN-α>rOviIFN-γ,且在MDBK细胞上比在Vero细胞上的活性高。 表2 抗病毒活性检测 ×104 U/mL 2.5 IFN刺激基因转录水平的测定结果以0.6 g/L 的rOviIFN-α、rOviIFN-γ、rOviIFN-γ/α蛋白质量浓度刺激MDBK或Vero细胞,ISGs 在转录水平的动态变化如图 4~6 所示。相比于对照组,重组蛋白显著增加了 5 种 ISGs 的 mRNA 转录水平。以rOviIFN-γ蛋白刺激 MDBK、Vero细胞,ISG15、MX1、OAS和IFITM1 的转录水平在 12 h 达到最高水平,与对照组相比差异极显著(P<0.01),且对2种细胞中4种ISG的转录水平进行比较,MDBK细胞中4种ISG的转录水平比Vero细胞要高。以rOviIFN-α蛋白刺激 MDBK、Vero细胞,ISG的转录水平与对照组在12 h相比差异极显著(P>0.05),ISG15、MX1、OAS和IFITM1的转录水平在12 h达到最高水平。在Vero细胞上进行试验时,ISG15转录水平在6 h达到最高水平。MDBK细胞中4种ISG的转录水平比Vero细胞要高。以rOviIFN-γ/α蛋白刺激MDBK、Vero细胞,ISG的转录水平与对照组相比在12 h时差异极显著(P>0.05)。通过结果图将3种蛋白以及1种蛋白联合使用方式进行比较,结果显示ISG转录依次是: rOviIFN-γ/α>rOviIFN-α>rOviIFN-γ。 用OviIFN-γ处理Vero和MDBK细胞不同时间,对照组为未经处理的Vero和MDBK细胞,并将GAPDH设为内源性对照,以上数据代表3个独立试验(与对照组相比,*表示P<0.050,**表示P<0.010,***表示P<0.001)。下同 图5 OviIFN-α诱导Vero和MDBK细胞表达MX1、ISG15、IFITM1和OAS 图6 OviIFN-γ-α诱导Vero和MDBK细胞表达MX1、IFITM1、ISG15和OAS 为了研究羊IFN(OviIFN-α、OviIFN-γ)融合表达对抗病毒活性叠加的作用,本试验构建了pET28a-OviIFN-γ、pET28a-OviIFN-α和pET28a-OviIFN-γ/α质粒,使用大肠杆菌表达系统进行原核表达,获得重组IFN。 ECHEBLI等[21]提出在病毒感染过程中的急性或慢性感染阶段大多数ISG都能被Ⅰ和Ⅱ型IFN诱导,并表现出最高的增加作用,表明Ⅰ和Ⅱ型IFN之间有很强的协同作用。张小南[22]应用 Affymetrix cDNA 基因芯片技术检测了Huh7细胞在IFN-α、IFN-γ单独以及联合处理6 h后基因表达谱的变化。结果显示,在IFN联合处理后,细胞内IFN诱导基因谱有明显加强,参与抗病毒及免疫反应。通过 RT-PCR 证实, BcIG(Bcl -2 family protein G)、XAFI(X-linked inhibitor of apoptosis associated factor-1)、TRAIL(TNF-related apoptosis inducing ligand)、TAP1(ransporter 1)的转录在联合处理时比IFN-α或IFN-γ单独处理有极为显著的加强,说明IFN联合使用能诱发宿主产生强大的胞内抗病毒活性。 郑鸣等[23]将猪IFN-α与IFN-γ进行融合表达获得rPoIFN-α/γ,与PoIFN-α、PoIFN-γ进行抗病毒活性测定,证明经纯化复性得到的rPoIFN-α/γ有抗病毒活性,且抗VSV活性rPoIFN-α/γ明显高于非融合的PoIFN-α、PoIFN-γ,体现了一定的抗病毒叠加效应。本试验通过细胞病变抑制法将rOviIFN-α、rOviIFN-γ、rOviIFN-γ/α蛋白在2套细胞系统MDBK、Vero中进行试验,每组试验组都使用300 μL的重组蛋白进行细胞孵育。较郑鸣等[23]的试验设计组,本试验更充分、更完善,在Vero-VSV系统中,Vero细胞自身并不能表达分泌IFN蛋白,说明在本系统中3组试验组产生的抗病毒活性与内源性IFN无关。较李丹等[24]等报道的在BHK细胞中进行DviIFN-α抗病毒活性测定有更强的说服力,排除了内源性IFN产生抗病毒作用的可能性。本试验将IFN联合使用与IFN融合表达2种方式进行对比,以获得Ⅰ与Ⅱ型IFN最高的叠加抗病毒活性。rOviIFN-γ/α蛋白的获得是在整个试验的上游对OviIFN-α和OviIFN-γ的序列进行改造,通过Linker进行连接获得,使OviIFN-α和OviIFN-γ起到一定的叠加效应。3组试验组蛋白用量与所测IFN活性用量一致,取在6,12,24,48 h的Vero和MDBK细胞用1 mL的TRIzol进行RNA的提取,通过RT-qPCR检测不同细胞、不同时间段中ISG15、MX1、OAS和IFITM1 的转录水平,这些ISGs转录水平的上调说明了在mRNA水平上这4种ISG表达水平升高。 将rOviIFN-α与rOviIFN-γ 进行联合使用,采用rOviIFN-α(170 μL)、rOviIFN-γ(130 μL),在MDBK细胞、Vero细胞使用VSV进行抗病毒活性测定,其活性为2.83×104,3.42×104U/mL。通过将单个蛋白进行联合使用与融合蛋白进行比较,结果显示联合使用比融合表达的蛋白抗病毒活性略高,但抗病毒活性仍保持在1个数量级且无明显差异;并且联合使用在生产过程中,成本更高,并不利于生产中的应用。因此本试验将2种蛋白融合表达作为重点进行后续试验。 综上所述,rOviIFN-α、rOviIFN-γ、rOviIFN-γ/α蛋白3组试验组在体外有良好的抗病毒活性,且使ISGs转录水平显著升高,3组试验组通过抗病毒活性的比较也显示出了一定的叠加效应。本试验设置试验组广泛、全面,试验设计的细胞使用种类排除了内源性因素的影响,且该试验主要集中在体外水平进行评价。2 结果






3 讨论
